穿心莲内酯对口腔鳞状细胞癌体内外抑制作用的实验研究
2023-01-17吕艳利商留珂洛阳职业技术学院口腔医学洛阳471000
吕艳利 巴 凯 方 政 商留珂(洛阳职业技术学院口腔医学,洛阳 471000)
口腔鳞状细胞癌(oral squamous cell carcinoma, OSCC)是指发生于口腔内的恶性肿瘤,具有高复发率和转移率[1]。据统计,OSCC五年生存率仅有40%~50%,且发病迅速,预后极差,严重影响人们生命健康和生活质量[2]。目前,国内外针对OSCC的临床治疗方法主要有手术治疗、放化疗、基因靶向治疗和中医中药辅助治疗等[3-5]。穿心莲内酯是天然植物穿心莲的有效成分,难溶于水,具有祛热解毒、消炎止痛之功效,对细菌或病毒性上呼吸道感染有治疗作用[6]。研究表明,穿心莲内酯在多种肿瘤发生发展过程中发挥调控作用,如穿心莲内酯通过上调死亡受体4(DR4)促进人肾癌细胞对TRAIL诱导的细胞凋亡敏感,穿心莲内酯通过ROS/JNK途径诱导人骨肉瘤细胞凋亡,穿心莲内酯通过提高活性氧水平使Hep-2人喉癌细胞对卡铂诱导的细胞凋亡敏感等[7-9]。但穿心莲内酯在OSCC体内外的研究鲜见报道,因此,本研究旨在通过细胞水平及动物水平研究穿心莲内酯在OSCC体内外的影响作用,为穿心莲内酯在OSCC诊断与治疗中的应用提供理论依据。
1 材料与方法
1.1材料
1.1.1药物、试剂及仪器 穿心莲内酯(纯度≥98%)购自四川维克奇生物科技有限公司;OSCC细胞系CAL-27由中国科学院上海细胞库提供;胎牛血清和DMEM培养基购自美国Gibco公司;CCK8试剂盒、BCA蛋白定量试剂盒、RT-PCR试剂盒和Hoechst染色试剂盒均购自北京索莱宝生物科技有限公司;PI单染细胞周期检测试剂盒购自上海碧云天公司;免疫组化试剂盒购自美国Invitrogen公司;caspase-9兔多克隆抗体、caspase-3兔多克隆抗体、cleaved PARP兔单克隆抗体、上皮型钙黏蛋白(Ecadherin)兔单克隆抗体、神经型钙黏蛋白(N-cadherin)兔单克隆抗体、波形蛋白(Vimentin)兔多克隆抗体和TGF-β1兔单克隆抗体均购自美国Abcam公司。
RT-PCR仪(北京东胜创新生物科技有限公司,东胜龙ETC811);台式高速离心机(大龙,D3024R),酶标仪(Rayto,RT6100);光学显微镜(日本尼康,Nikon Eclipse E100);成像系统(上海天能科技有限公司,Tanon-1600R)。
1.1.2动物 雄性BALB/c小鼠(6周龄,体质量20~25 g)购自北京维通利华实验动物技术有限公司,生产许可证号:SCXK(京)2016-0011,使用许可证号:SYXK(京)2017-0022。动物饲养条件:每只小鼠给予24 h昼夜灯光照射控制及严格、规范的卡片登记管理,24℃条件下独立饲养,适应性喂养1周后进行后续实验。
1.2方法
1.2.1动物建模及给药 将小鼠分为对照组、25 mg/kg穿心莲内酯组、50 mg/kg穿心莲内酯组和100 mg/kg穿心莲内酯组。建模:OSCC细胞系CAL-27以5×106个/ml皮下注射小鼠建立移植瘤裸鼠模型,实验给药组参照文献[10]分别灌胃给药25、50、100 mg/kg的穿心莲内酯,4周后分离各组小鼠移植瘤组织并称取肿瘤重量。
1.2.2CCK8检测细胞活力 细胞培养:用含10%胎牛血清的DMEM高糖培养基,5%CO2、37℃细胞培养箱中静置培养,待细胞生长密度达80%且生长状态良好时进行传代培养。收集对数生长期且生长状态良好的CAL-27细胞,按每孔50µl 5×106个/ml接种至96孔板,每组3个复孔,除空白对照孔外,其余孔加入不同浓度(7.5、15和30µmol/L)的穿心莲内酯。37℃、5%CO2培养箱中培养24 h。培养后每孔加入10 µl CCK8试剂避光孵育2 h,使用酶标仪测定450 nm处的吸光值,计算公式:细胞活力(%)=各浓度给药组的A值/空白组的平均A值×100%。
1.2.3流式细胞术检测CAL-27细胞周期变化 取对数生长期且生长状态良好的CAL-27细胞以1×104个/孔接种于6孔板,每组3个复孔,除空白对照孔外,其余孔加入不同浓度(7.5µmol/L、15µmol/L和30 µmol/L)的穿心莲内酯,培养48 h后用胰蛋白酶进行消化处理各组细胞,1×PBS溶液浸洗2次,移至1.5 ml离心管中,加入预冷的70%乙醇固定细胞,4℃过夜。用冷PBS清洗细胞2次,1 000 r/min离心5 min,弃上清液;加入1 ml PI染液,轻轻振荡混匀,室温下避光孵育30 min,流式细胞仪进行细胞周期检测。
1.2.4克隆形成实验检测克隆形成率 收集各组生长状态良好的CAL-27细胞,经胰酶消化处理后,将各组1×102个细胞接种至6孔板,待6孔板中出现肉眼可见的细胞克隆时,弃培养液并用PBS清洗3次,用4%多聚甲醛固定细胞10 min,再加入适量的吉姆萨染液染色10~20 min,根据克隆形成数计算克隆形成率,克隆形成率(%)=(细胞克隆数/100)×100%。
1.2.5RT-PCR检 测PCNA和p21 mRNA表 达 水平 收集对数生长期的CAL-27细胞并制备细胞悬液,用TRIzol试剂盒提取总RNA,分光光度计测定RNA浓度和纯度,按逆转录试剂盒说明书合成cDNA(25℃逆转录15 min,37℃逆转录10 min,85℃灭活5 s),然后按照RT-PCR试剂盒配制反应体系,在PCR扩增仪上进行扩增(95℃预变性30 s,95℃变性5 s,60℃退火34 s,72℃延伸2 min,循环40次后,72℃延伸5 min)。以目的基因和内参比值表示mRNA相对表达水平,采用2-ΔΔCt法分析结果。PCNA正 向 引 物:5'-TAAGGGCTGGAAGATAATGCTGAT-3',反向引物:5'-CCTGTTCTGGGATTCCAAGTT-3';p21正向引物:5'-CGCGGATCCCCTCTCACCCTAAGGGT-3',反向引物:5'-CCGCTCGAGCCCTGCACCTCCTCGTC-3';GADPH正向引物:5'-GACCCCTTCATTGACCTCAAC-3',反向引物:5'-CGCTCCTGGAAGATGGTGAT-3';caspase-3正向引物:5'-TGGTTCATCCAGTCGCTTTGT-3',反向引物:5'-CAAATTCTGTTGCCACCTTTCG-3'。
1.2.6Hoechst染色观察细胞形态变化 收集生长状态良好的CAL-27细胞,4℃、3 000 r/min条件下离心细胞,用1.5 ml离心管收集细胞样品,加入0.5 ml固定液,制备细胞悬液,固定10 min后弃固定液,用PBS洗涤后,将细胞样品液均匀铺于载玻片上,待玻片晾干后,滴加0.5 ml Hoechst染色液染色5~10 min。待晾干后,用PBS洗涤,滴抗荧光淬灭封片液于载玻片上,用荧光显微镜观察细胞,细胞核呈蓝色。
1.2.7Western blot检测caspase-9、caspase-3、cleaved PARP、E-cadherin、N-cadherin、Vimentin和TGF-β1蛋白表达水平 收集各组CAL-27细胞,胰酶消化细胞后制成细胞悬液,4℃、3 000 r/min离心15 min,取上清。用RIPA蛋白裂解液于冰上提取细胞总蛋白,BCA蛋白定量试剂盒测定蛋白浓度,经SDSPAGE凝胶电泳、转膜、脱脂奶粉封闭后,加入caspase-9(1∶500)、caspase-3(1∶500)、cleaved PARP(1∶1 000)、E-cadherin(1∶1 000)、N-cadherin(1∶1 000)、Vimentin(1∶1 000)和TGF-β1(1∶1 000),4℃孵育摇床过夜。加入按比例稀释的HRP标记的对应二抗(1∶10 000),室温避光孵育2 h。采用ECL进行化学发光法于暗室下曝光显影,将胶片进行扫描存档,PhotoShop整理去色,Alpha软件分享光密度值。
1.2.8免疫组化检测Ki67、caspase-3和Vimentin阳性表达率 按0Envision二步法和免疫组化检测试剂盒(PV-6000)说明操作,将石蜡切片脱蜡至水,室温孵育5~10 min,用柠檬酸抗原修复缓冲液(pH=6.0)进行抗原修复,切片放入3%H2O2溶液中室温避光孵育25 min以阻断内源性过氧化物酶,BSA封闭30 min,加入一抗孵育过夜,加二抗(HRP标记)覆盖组织,室温孵育50 min,DAB显色,苏木精复染。用PBS代替一抗作阴性对照。苏木素染细胞核为蓝色,DAB显出来的阳性信号为棕黄色。
1.3统计学处理 所有实验独立重复3次,取平均值,数据处理使用SPSS21.0软件进行分析,正态分布的计量资料表示为±s。采用单因素方差分析,若方差齐则两两比较采用LSD法,若方差不齐则两两比较采用Dunnett-t法。以P<0.05为差异有统计学意义。
2 结果
2.1穿心莲内酯对OSCC细胞活力的影响CCK8检测OSCC细胞活力,0.75、1.5、3、7.5µmol/L穿心莲内酯处理OSCC CAL-27后,细胞活力无明显变化。15、30µmol/L穿心莲内酯处理CAL-27后,细胞活力显著降低(P<0.05)。60、120、240、480 µmol/L穿心莲内酯显著降低CAL-27细胞活力,且细胞活力极低,见图1。本实验选择0、7.5、15、30 µmol/L的穿心莲内酯进行后续实验,探究穿心莲内酯对OSCC细胞的影响作用。
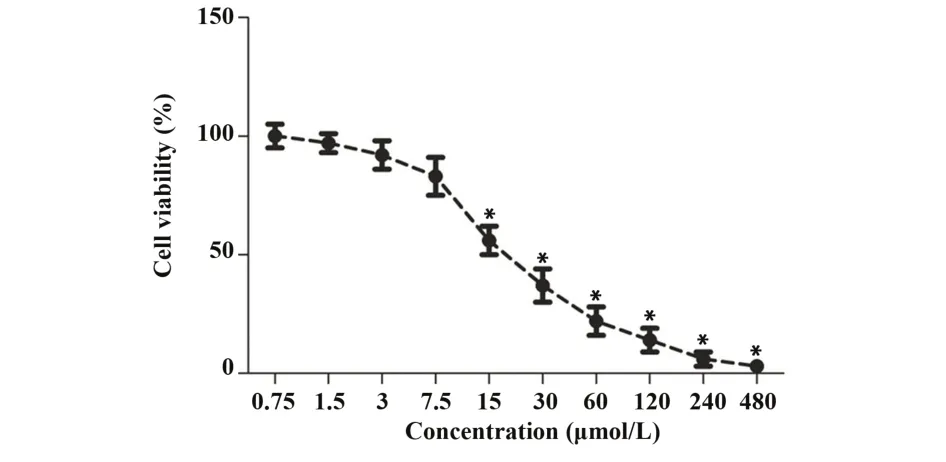
图1 CCK8检测细胞活力Fig.1 CCK8 was employed to detect cell viability
2.2穿心莲内酯对OSCC细胞增殖的影响PI单染法检测CAL-27细胞周期变化,与0µmol/L穿心莲内酯组比较,7.5µmol/L穿心莲内酯组细胞G0~G1期细胞占比差异无统计学意义(P>0.05),15 µmol/L和30µmol/L穿心莲内酯组G0-G1期细胞占比显著上升(P<0.05),见图2A,提示穿心莲内酯可将CAL-27细胞增殖周期阻滞在G0~G1期。克隆形成实验检测细胞克隆形成率,与0 µmol/L穿心莲内酯组比较,
7.5µmol/L穿心莲内酯组细胞克隆形成率差异无统计学意义(P>0.05),15、30µmol/L穿心莲内酯组细胞克隆形成率显著降低(P<0.05),见图2B、C。RTPCR检测PCNA和p21 mRNA表达水平,与0µmol/L穿心莲内酯组比较,7.5µmol/L穿心莲内酯组细胞PCNA和p21 mRNA表达水平差异无统计学意义(P>0.05),15、30 µmol/L穿心莲内酯组细胞中PCNA mRNA表达水平显著降低(P<0.05),p21 mRNA水平显著增高(P<0.05),见图2D。
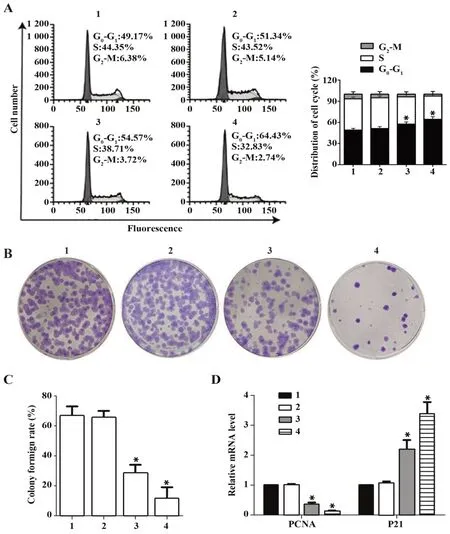
图2 穿心莲内酯对OSCC细胞增殖的影响Fig.2 Effect of andrographolide on proliferation of OSCC cells
2.3穿心莲内酯对OSCC细胞凋亡的影响Hoechst染色观测细胞形态变化,0、7.5µmol/L穿心莲内酯组细胞形态正常,胞核呈圆形,淡蓝色,内有较深的蓝色颗粒,未见凋亡细胞。15、30 µmol/L穿心莲内酯组细胞胞核呈亮蓝色,核呈分叶,碎片状,边集,可见大量凋亡细胞,见图3A。与0µmol/L穿心莲内酯组比较,7.5 µmol/L穿心莲内酯组cleaved cas9/cas9、cleaved cas3/cas3和cleaved PARP蛋白水平差异均无统计学意义(P>0.05),15µmol/L和30 µmol/L穿 心 莲 内 酯 组cleaved cas9/cas9、cleaved cas3/cas3和cleaved PARP蛋白水平显著提高(P<0.05),图3B。
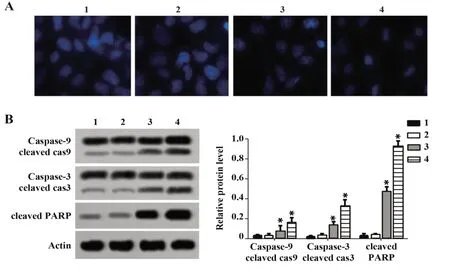
图3 Hoechst染色和Western blot检测细胞凋亡(Hoechst×200)Fig.3 Apoptosis detected by Hoechst and Western blot(Hoechst×200)
2.4穿心莲内酯对OSCC细胞EMT标志蛋白水平的影响 与0µmol/L穿心莲内酯组比较,7.5µmol/L穿心莲内酯组细胞E-cadherin、N-cadherin、Vimentin和TGF-β1蛋白水平差异无统计学意义(P>0.05),15、30 µmol/L穿心莲内酯组细胞中E-cadherin蛋白水平显著增高(P<0.05),N-cadherin、Vimentin和TGF-β1蛋白水平显著降低(P<0.05),见图4。
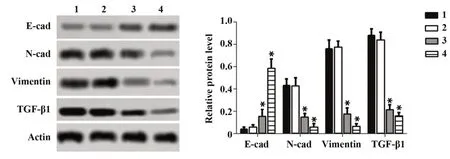
图4 Western blot检 测 细 胞 中E-cadherin、N-cadherin、Vimentin和TGF-β1蛋白水平Fig.4 Expression levels of E-cadherin,N-cadherin,Vimentin and TGF-β1 protein in cells were detected by Western blot
2.5穿心莲内酯对移植瘤裸鼠肿瘤生长的影响测量肿瘤重量,与对照组比较,25 mg/kg穿心莲内酯组肿瘤重量差异无统计学意义(P>0.05),50、100 mg/kg穿心莲内酯组肿瘤重量显著降低(P<0.05)。免疫组化检测caspase-3、Vimentin和Ki67表达量。与对照组比较,25 mg/kg穿心莲内酯组caspase-3、Vimentin和Ki67表达水平差异无统计学意义(P>0.05),50、100 mg/kg穿心莲内酯组caspase-3表达量显著增高(P<0.05),Vimentin和Ki67表达量显著降低(P<0.05),见图5。

图5 免疫组化检测caspase-3、Vimentin和Ki67表达量Fig.5 Immunohistochemical detection of caspase-3,Vimentin and Ki67 expression levels
3 讨论
本研究利用浓度梯度穿心莲内酯处理OSCC细胞系CAL-27,检测穿心莲内酯对OSCC活力、增殖、凋亡及EMT过程的影响。同时,本研究还利用OSCC皮下注射BALB/c小鼠建立移植瘤裸鼠模型,观测肿瘤生长。研究结果显示,经穿心莲内酯给药处理后,OSCC细胞活力显著降低,癌细胞克隆形成率显著降低,凋亡细胞明显增多,运动能力显著被抑制,且肿瘤生长明显被抑制。结果提示,穿心莲内酯在OSCC中具有调节作用。
癌细胞异常增殖是促进癌细胞发生发展进程的重要因素,因此,抑制癌细胞增殖能有效调控癌细胞发生发展过程。增殖细胞核抗原(PCNA)是一种细胞增殖标志物,只存在于正常增殖细胞和肿瘤细胞中,与启动细胞增殖、DNA合成等过程有关[11]。P21是细胞周期素依赖性激酶抑制因子,与肿瘤抑制作用密切相关,还通过抑制周期素依赖激酶复合物活性协调细胞周期、DNA复制与修复之间的关系,有研究报道,P21在OSCC细胞中的表达水平与癌细胞发生发展过程密切相关[12]。本研究结果显示,经穿心莲内酯给药处理后,OSCC细胞克隆形成率显著降低,PCNA表达水平明显降低,P21表达水平明显增高,结果提示,穿心莲内酯能够抑制OSCC细胞增殖。
细胞凋亡是指为维持机体内环境稳定性,由基因控制的细胞程序性死亡过程。凋亡发生时,上游细胞凋亡起始蛋白caspase-9诱导并活化下游细胞凋亡执行蛋白caspase-3,凋亡蛋白caspase-3和caspase-9被异常激活,使得大脑组织产生大量的cleaved cas-3和cleaved cas-9,并进一步执行DNA裂解及细胞凋亡过程[13]。本研究结果显示,OSCC经穿心莲内酯处理后,凋亡细胞明显增多,caspase-9和caspase-3蛋白水平显著上调,结果提示,穿心莲内酯通过上调caspase-9和caspase-3蛋白表达诱导OSCC凋亡。
EMT是指上皮细胞通过特定程序转化为具有间质表型细胞的过程,是肿瘤细胞获得迁移和侵袭能力的重要生物学过程,E-cadherin、N-cadherin和Vimentin在EMT过程中发挥重要调控作用[14]。Ecadherin通过促进细胞间黏附性和极性抑制癌细胞侵袭转移,N-cadherin与E-cadherin相反,N-cadherin通过减弱细胞间的黏附性和极性促进癌细胞侵袭和转移等过程,Vimentin是维持细胞骨架完整性的一种重要中间丝蛋白[15]。TGF-β1是促进癌细胞侵袭转移的重要特征因子[16]。大量研究表明,OSCC细胞侵袭和转移能力强弱与EMT过程有关[17-18]。因此,本研究通过检测OSCC细胞中EMT标记蛋白水平,结果发现,OSCC细胞中E-cadherin蛋白低表达,N-cadherin和Vimentin蛋白高表达,经穿心莲内酯处理后,E-cadherin蛋白水平显著上调,N-cadherin和Vimentin蛋白水平显著下调,结果提示,穿心莲内酯通过调控E-cadherin、N-cadherin和Vimentin蛋白表达水平抑制OSCC细胞迁移和侵袭能力。
为进一步验证穿心莲内酯在OSCC中的作用,利用OSCC细胞皮下注射小鼠,建立移植瘤裸鼠模型,观测穿心莲内酯对裸鼠肿瘤生长的影响。结果显示,经穿心莲内酯灌胃给药治疗后,移植瘤裸鼠肿瘤重量明显降低,免疫组化结果显示,增殖细胞相关抗原Ki67和Vimentin阳性细胞明显减少,caspase-3阳性细胞增多,与前期细胞水平中观测到的结果相符合。结果提示,穿心莲内酯在体内外均能抑制OSCC生长。
综上所述,穿心莲内酯对OSCC生长具有抑制作用,其具体作用机制尚不明确,后续实验计划进一步探讨穿心莲内酯抑制OSCC生长的作用机制,为穿心莲内酯的临床应用提供更加充分的理论基础。