混盐电解液体系的低温性能
2023-01-17张丽娟李海朝何劲作
辛 娟,张丽娟,李海朝,何劲作
(青海民族大学化学化工学院,青海 西宁 810007)
电解液性能受温度影响显著。温度降低,Li+迁移数会降低,黏度增大,与隔膜之间的浸润性变差,会影响到电池的低温性能。商业化锂盐中最常见的是六氟磷酸锂(LiPF6),综合性能较好,但遇水易分解,对温度也很敏感[1];四氟硼酸锂(LiBF4)虽在室温下离子电导率不高,成膜性差,溶剂易嵌入到石墨层中,导致石墨剥离,但低温下的阻抗小,综合性能较好[2];二氟草酸硼酸锂(LiODFB)的成膜性好,但易形成厚的界面膜,导致低温性能变差[3]。单一锂盐可能存在某些缺点,可考虑将不同锂盐搭配使用。广泛使用的商业化溶剂体系中,碳酸乙烯酯(EC)的熔点较高,向其中加入碳酸二甲酯(DMC)、碳酸甲乙酯(EMC)和碳酸二乙酯(DEC)等熔点低的线性碳酸酯类溶剂,可提高低温性能[4];而线性羧酸酯类溶剂凝固点、熔点和黏度低,常被作为碳酸酯类电解液的低温共溶剂,也常直接用作低熔点溶剂[5]。
本文作者将LiBF4、LiODFB作为混合锂盐,用乙酸乙酯(EA)代替先前研究工作中EC+碳酸丙烯酯(PC)+EMC体系[6]中的部分EMC,配制成四元溶剂,以期获得室温及低温(-20℃)时性能更优的电解液体系。
1 实验
1.1 电解液配制
所有电解液的配制均在充满氩气[ω(H2O)<1×10-5%、ω(O2)<1×10-5%]的手套箱中进行。选择 LiBF4(广东产,99%)、LiPF6(广东产,99%)和LiODFB(广东产,99%)为电解质,将 EC(广东产,电池级)、PC(广东产,电池级)、EMC(广东产,电池级)和EA(广东产,电池级)按体积比 1∶1∶1∶2配制12.5ml混合溶液,作为溶剂,加入聚四氟乙烯瓶中,搅拌均匀后,封口,静置24 h。锂盐总浓度均为1.0 mol/L,n(LiBF4)∶n(LiODFB)=x∶(10-x),x取值为 0、3、5、7 和 10 时,分别记为 LiODFB、LiBF4/LiODFB(3 ∶7)、LiBF4/LiODFB(1 ∶1)、LiBF4/LiODFB(7∶3)和 LiBF4;以 LiPF6为锂盐则记为LiPF6。
1.2 电极制备
制备极片前,将正极活性物质LiCoO2(天津产,电池级)、导电剂乙炔黑(Timcal公司,电池级)在120℃下真空(0.8 MPa)干燥12 h;将黏结剂聚偏氟乙烯(PVDF,Arkema公司,电池级)在60℃下干燥12 h。
量取7.5 ml N-甲基吡咯烷酮(NMP,河南产,电池级),与0.2 g PVDF混合在25 ml烧杯中,磁力搅拌2~3 h,形成均匀、透明的胶状溶液;将胶状溶液和1.6 g LiCoO2、0.2 g乙炔黑混合于玛瑙球磨罐(球料比15∶1)中,用MSK-SFM-3型球磨机(深圳产)以1 500 r/min的转速球磨15 min,制成正极浆料。用MSK-AFA-ES200自动涂布机(深圳产)将正极浆料涂覆在16μm厚的铝箔(广州产,>99.5%)上,再放入干燥箱中,在120℃下真空(-0.08 MPa)干燥12 h,自然冷却后,制得LiCoO2正极片,并裁切成直径为12mm的圆片,然后用JK-GYJ-100B实验型辊压机(深圳产)以10 MPa的压强辊压,用NBL 124i型电子天平(厦门产)称量质量。
1.3 扣式电池组装
以金属锂片(深圳产,电池级)为对电极,Celgard 2400膜(美国产)为隔膜,在充满氩气的手套箱中,按正极壳、正极片、电解液、隔膜、锂片、垫片、弹片和负极壳的顺序组装CR2025型LiCoO2/Li半电池,封口后,静置12 h,再进行电化学性能测试。在封口前,不要晃动电池。
1.4 测试方法
低温充放电测试:电池在测试低温性能之前,室温下用CT2001A电池测试系统(武汉产)以0.1C在2.7~4.2 V活化3次,然后置于HE-GD-80C型高低温试验箱(安徽产)中,在-20℃下静置2 h,待电池温度与试验箱环境温度一致后,在0.1C下进行恒流充放电。充放电过程为:恒流充电到4.2 V,转恒压充电10min;恒流放电到2.7 V。
常温电池性能测试:在CT2001A电池测试系统上,将电池以0.1C在2.7~4.2 V活化3次,再对电池的循环寿命、倍率性能等进行测试。测试在25℃下进行,电池标称比容量为140 mAh/g。
循环伏安(CV)和电化学阻抗谱(EIS)测试:用Ivium型电化学工作站(荷兰产)对LiCoO2/Li半电池进行CV和EIS测试。CV测试的扫描速率为0.1mV/s,电位为2.7~4.2 V;EIS测试的频率为0.1~105Hz,交流振幅为5×10-3V。
在手套箱中,将循环前后的扣式电池拆解,取出极片,用EMC反复冲洗,洗净表面残存的电解液和锂盐,充分干燥后,取合适大小的极片,贴于粘有导电胶的样品台上,用SU8010场发射扫描电子显微镜(日本产)观察循环前后极片的形貌。
2 结果与讨论
2.1 半电池的首次充放电曲线
25℃下,不同电解液体系电池的首次充放电曲线见图1。
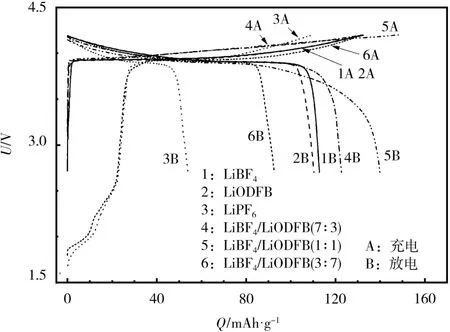
图1 不同电解液LiCoO2/Li电池的首次充放电曲线Fig.1 Initial charge-discharge curves of LiCoO2/Li batteries using different electrolytes
从图1可知,在LiBF4中加入少量LiODFB,锂离子电池的放电比容量有所上升,但当LiODFB的浓度达到0.7mol/L时,放电比容量反而下降。这可能是由于过量LiODFB的加入,导致界面膜进一步生长,使得界面阻抗增大,电池极化加速,Li+嵌脱不平衡,放电容量有所下降。混合锂盐LiBF4/Li-ODFB(7∶3、1∶1)的放电比容量均高于3种纯盐体系,说明混合锂盐电解液体系组装的电池可逆性较好。
2.2 半电池的循环伏安特性
25℃下,不同电解液体系电池第2次循环的CV曲线见图2。

图2 不同电解液LiCoO2/Li电池的CV曲线Fig.2 CV curves of LiCoO2/Libatteries using different electrolytes
从图2可知,室温下,以LiBF4为锂盐电解液制备的电池,电位差最大。随着LiODFB浓度的增加,电位差逐渐减小,原因是在首次充放电过程中,LiODFB会在电极表面氧化分解,形成一层界面保护膜,抑制后续充放电过程中电解液可能会参与成膜的现象。随着LiODFB浓度的增加,氧化峰与还原峰电流绝对值的比值变大,说明在首次循环过程中,LiODFB浓度越高,在电极表面形成的界面膜越厚,导致电池阻抗增加。这表明,LiODFB的加入改善了电池的循环性能。
2.3 半电池的循环性能
LiCoO2/Li半电池在25℃下以1.0C充放电及在-20℃下以0.1C充放电的循环性能见图3。
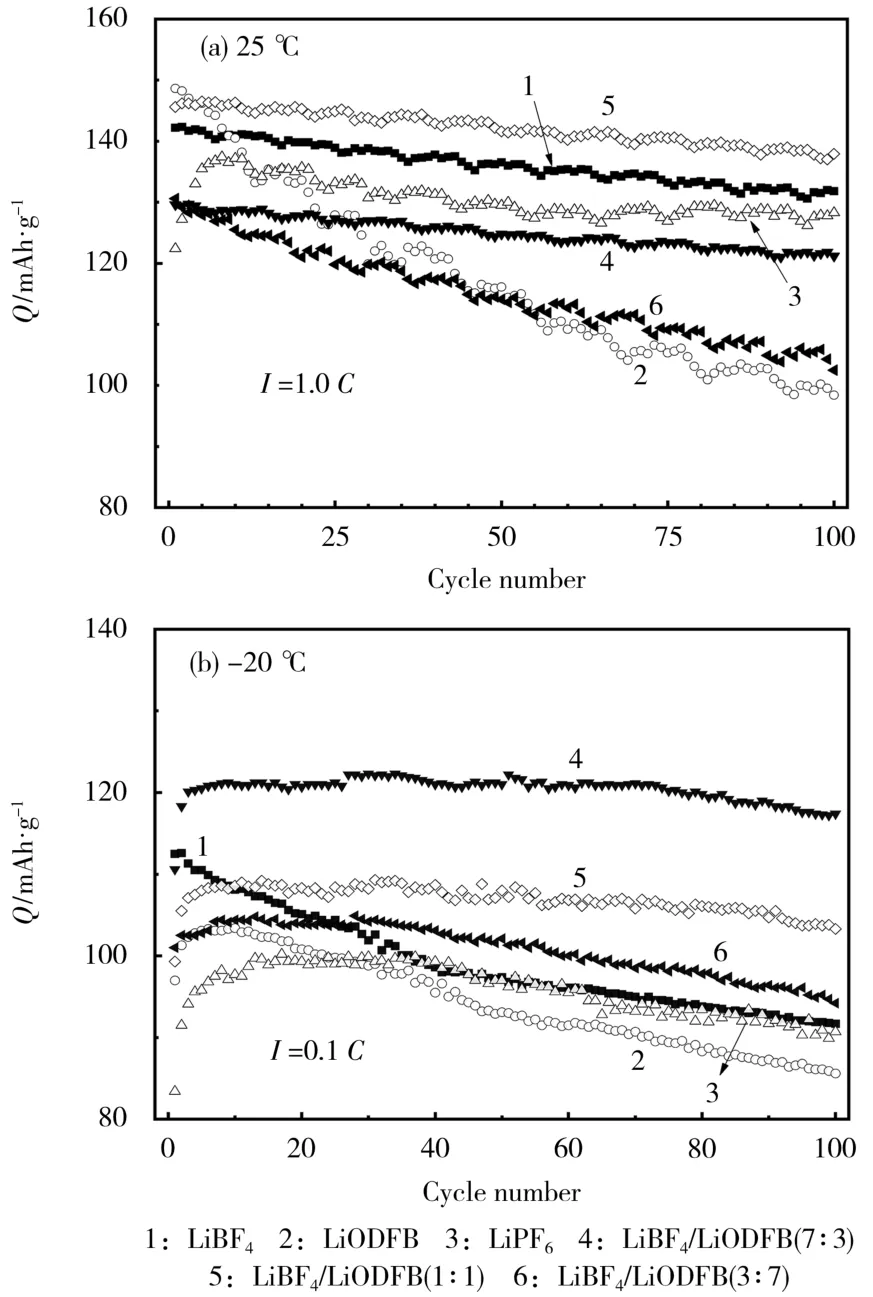
图3 不同温度下不同电解液LiCoO2/Li电池的循环性能Fig.3 Cycle performance of LiCoO2/Libatteries using different electrolytes at different temperatures
从图3可知,在25℃下,以1.0C充放电,随着循环次数的增加,曲线整体呈下降趋势;循环100次后,电解液锂盐为单一LiBF4和单一LiODFB的电池与电解液锂盐为混盐的电池相比,差距不大,且混合锂盐的性能要稍优于单一锂盐,发挥了锂盐之间的协同效应。在-20℃下,以0.1C充放电,随着循环次数的增加,曲线整体也呈下降趋势,但混合锂盐基电解液制备电池的放电比容量高于纯盐基电解液体系制备的电池,说明低温下存在LiODFB的体系循环稳定性更好。单一LiODFB的电池循环100次后,放电比容量下降到低于100mAh/g,衰减明显。在混合锂盐中,LiBF4/LiODFB(7∶3)的循环性能要比其他混合锂盐好,说明过多或者过少的LiODFB,会在电极表面形成过厚或包覆性不好的固体电解质相界面(SEI)膜,导致循环稳定性降低。在低温下,混合锂盐电解液体系的循环性能比商业化LiPF6好,说明在LiCoO2电极表面形成了有效、致密且稳定的SEI膜。
2.4 半电池在常温下的倍率性能
在25℃下,LiCoO2/Li半电池的倍率性能如图4所示,除0.1C下循环3次外,其余电流下均循环10次。
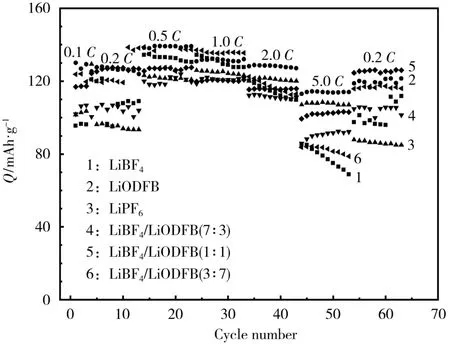
图4 不同电解液LiCoO2/Li电池的倍率性能Fig.4 Rate capability of LiCoO2/Li batteries using different electrolytes
从图4可知,室温下,混合锂盐基电解液组装电池的倍率性能好于纯锂盐基电解液体系,原因是LiODFB的加入,使得电解液电导率增大,加速了电解液中Li+迁移数的提高,有助于提高电池的倍率性能。过量LiODFB会使界面膜阻抗值增大,不利于电池的电化学性能,说明LiBF4/LiODFB(7∶3)和LiBF4/LiODFB(1∶1)基电解液体系倍率性能相差不明显,但均比纯锂盐基和商业化LiPF6基电解液好。
2.5 半电池在低温下的阻抗分析
在-20℃下,使用不同比例混合锂盐基电解液体系组装电池循环后的EIS见图5。

图5 -20℃混合锂盐组装电池的EISFig.5 Electrochemical impedance spectroscopy(EIS)of batteries prepared with mixed lithium salt at-20℃
低温下,溶剂EC会部分凝固,引起电解液黏度增加、离子转移速率降低以及界面膜阻抗(RSEI)、电荷传递阻抗(Rct)增加,导致电池的极化现象加重。
从图5可知,高、中频均出现一个半圆,可看到混合锂盐中,LiBF4/LiODFB(1∶1)的阻抗最小,说明LiODFB过多或者过少,均会出现阻抗过大的问题,原因可能在于形成的界面膜不致密或者过厚。
2.6 半电池循环前后的正极片形貌
半电池在循环前后的SEM图如图6所示。
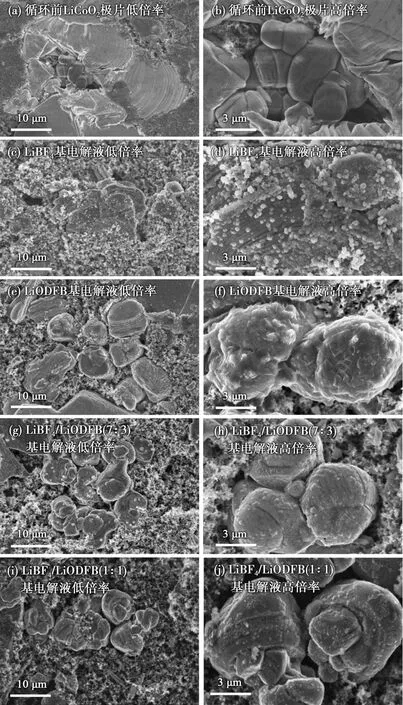
图6 半电池在循环前后的SEM图Fig.6 SEM photographs of half battery before and after cycle
从图6可知,电极表面存在大量微米级的大颗粒物质,周围分布着微小的颗粒。由极片的组成可知,大颗粒物质为LiCO2活性物质,小颗粒是SP。新鲜正极片表面平滑且干净,循环后正极表面小颗粒物质数量增多,LiBF4形成的膜致密性不够、包覆性不好,会有少量正极材料裸露,继续与电解液接触,发生反应。使用LiODFB基电解液的半电池,正极表面形成的界面膜很厚、很致密,导致循环性能和倍率性能降低。使用混合电解液的半电池,当n(LiBF4)∶n(LiODFB)=7∶3时,电极表面形成的正极电解质相界面(CEI)膜更加均匀致密;当n(LiBF4)∶n(LiODFB)=1∶1时,电极表面膜要稍微厚一些。这可能是由于过量LiODFB的加入,会导致膜变厚、阻抗增加,而薄、均匀且致密的界面膜,可以保护电极,并减少电解液的氧化分解。
3 结论
本文作者研究发现,纯锂盐和混合锂盐基电解液在室温下的循环、倍率性能差距不明显,但在-20℃时,LiBF4/Li-ODFB(7∶3)在 0.1C倍率下的首次放电比容量为110.6 mAh/g,循环100次的容量保持率为89.96%,优于LiPF6基电解液的83.4mAh/g和76.16%。低温下,混合锂盐的循环性能更好,说明使用混合锂盐电解液,可实现不同锂盐的优势互补,使混盐电解质体现出一些单一电解质所不具备的优异性能。
