冬虫夏草提取物对肺炎小鼠肺泡上皮细胞的自噬作用及机制
2023-01-16邢双丽赵明娟
邢双丽,赵明娟,金 荣
焦作煤业(集团)有限责任公司中央医院呼吸与危重症医学科二区,焦作 454100
间质性肺病(interstitial lung diseaese, ILD)是一组具有不同病因、临床、影像学和组织学表现的异质性、弥漫性、实质性肺疾病,间质性肺炎(interstitial pneumonia, IP)是ILD最常见病型[1]。其中纤维化尤其是特发性肺纤维化(idiopathic pulmonary fibrosis, IPF)是IP最具侵袭性的形式之一,其特点是慢性进行性纤维化破坏肺结构并造成炎症损伤,导致肺功能不全和呼吸衰竭[2]。作为一种转录依赖的调节机制,哺乳动物雷帕霉素靶蛋白复合物1(mammalian target of rapamycin, mTOR complex 1, mTORC1)/转录因子EB(transcription factor EB,TFEB)通路为自噬的复杂调控提供了新的见解[3]。冬虫夏草提取物(cordyceps sinensis extract,CSE)可延缓大鼠肺纤维化的早期肺泡炎[4],并可通过抗炎和抗氧化作用有效改善急性肺损伤[5],本研究拟通过建立IP小鼠模型,观察CSE的改善作用,并探讨其可能作用机制,为IP的药物治疗提供理论依据。
1 仪器与材料
1.1 仪器
Olympus光学显微镜购自伯辉生物科技有限公司;低温高速离心机购自长沙东旺实验仪器有限公司;多功能酶标仪购自北京华泰和合商贸有限公司;Bio-Rad凝胶成像系统购自上海艾研生物科技有限公司。
1.2 试药
CSE(质量分数≥98%)购自西安利时生物科技有限公司;博来霉素购自北京迈瑞达科技有限公司;Ⅰ型胶原酶和2.5 mg·mL-1胰蛋白酶购自美国Sigma公司;胎牛血清、基础培养液购自美国Gibco公司;Masson染色试剂盒和TUNEL染色试剂盒购自北京雷根生物技术有限公司;肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(Interleukin-6,IL-6)及白细胞介素1β(interleukin 1β,IL-1β)ELISA试剂盒购自武汉艾美捷科技有限公司;α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)、自噬降解底物P62蛋白(autophagy degradation substrate p62 protein,p62)、微管相关蛋白1轻链3(microtubule associated protein 1 light chain 3,LC3)、鼠源单克隆抗体和辣根过氧化物酶标记的山羊抗鼠IgG二抗,均购自美国Abcam公司;mTORC1和磷酸化哺乳动物雷帕霉素靶蛋白复合物1(phosphorylated mammalian rapamycin target protein complex 1,p-mTORC1)和TFEB鼠源单克隆抗体均购自美国CST公司。
1.3 动物
SPF级8周龄雄性C57BL/6小鼠75只,体质量为(30±5) g,由大冢(上海)药物研究开发有限公司提供,许可证号为SYXK(沪)2019-002。
2 方法
2.1 造模、分组及给药
24 ℃恒温恒湿普通饲养,12 h光照与12 h黑暗交替,适应1周后,随机选取15只作为正常组,剩余60只小鼠均用于构建间质性肺炎模型。戊巴比妥钠(2 mg·kg-1)腹腔注射麻醉,单手固定小鼠保持头上尾下竖立状态,充分暴露鼻腔并缓慢滴注博来霉素(2 mg·kg-1,生理盐水溶解)至充分进入肺部,正常组小鼠鼻腔内等量滴注生理盐水。后将60只建模小鼠随机分为4组,模型组、CSE低剂量组、CSE中剂量组及CSE高剂量组,每组各15只,次日给药。CSE(生理盐水溶解)低、中、高剂量组的灌服给药量分别为20、40、80 mg·kg-1·d-1,每日1次,正常组和模型组小鼠均每日等量灌服生理盐水0.5 mL。连续给药28 d。
2.2 标本采集与处理
末次给药结束后,小鼠腹腔内注射戊巴比妥钠(80 mg·kg-1),处死,取肺组织检测肺组织湿干质量比(n=5);磷酸盐缓冲液(phosphate buffered solution,PBS)灌洗收集支气管肺泡灌洗液用于ELISA检测(n=5);另取肺组织分别保存于体积分数为4%多聚甲醛和液氮中,用于组织病理学染色观察及Western blot检测(n=5)。
2.3 检测肺组织湿干质量比
对各组肺组织进行编号,滤纸吸除肺组织表面血液及水分,于电子天平上精确称定质量,即为湿质量;后置于80 ℃的干燥箱中干燥48 h至肺组织质量不再变化,再次称定质量即为干质量。小鼠肺组织湿质量(wet,W)/干质量(dry,D)即W/D比值用于评价肺水肿程度。
2.4 ELISA法检测TNF-α、IL-6和IL-1β的表达量
小鼠处死后完全暴露气管及肺组织,结扎主支气管,并于气管处作切口,插入18 G套管针并固定,冷PBS 0.6 mL缓慢灌洗左肺,30 s后抽出再打入,重复操作,保证液体提取率在90%以上。以2 500 r·min-1低温离心5 min,取上清,保存于-80 ℃,严格按照ELISA试剂盒说明书操作步骤检测各组小鼠肺泡灌洗液中TNF-α、IL-6和IL-1β的表达量。
2.5 HE染色
将固定24 h后的肺组织脱水、透明、浸蜡和包埋,并制成4 μm组织石蜡切片,根据染色试剂盒说明书进行二甲苯脱蜡、梯度乙醇覆水,苏木精染色,伊红染色,脱水,二甲苯透明,中性树胶封片,于光学显微镜下观察并采集图片。
2.6 Masson染色
制备4 μm石蜡切片脱蜡、水化,根据染色试剂盒说明书进行Weigert氏铁苏木素液染核,丽春红染色,磷钼酸处理,苯胺蓝染色,分化,梯度乙醇脱水,透明,中性树胶封片,于光学显微镜下观察观察肺组织纤维化情况并采集图片。
2.7 TUNEL染色
4 μm石蜡切片干燥后,充分脱蜡,水化,细胞通透后加入预冷的TUNEL染液反应,过氧化物酶封闭后与底物二氨基联苯胺混合液反应显色后,200倍光学显微镜下观察,细胞质或细胞核中有棕色颗粒即表示染色阳性,为凋亡细胞,随机选取5个视野。细胞凋亡率=(TUNEL阳性细胞数/细胞总数)×100%。
2.8 小鼠Ⅱ型肺泡上皮细胞的分离及培养
取各组小鼠(n=5)新鲜肺组织,冷PBS清洗至无血迹,于无菌通风厨内分离细胞,剪碎肺组织,剔除血管及白色结缔组织,转入离心管内加适量胰蛋白酶(250 mg·mL-1),于37 ℃消化10 min,过滤得滤渣,转入加有Ⅰ型胶原酶的离心管内,37 ℃继续消化1 h,期间视组织消化情况缓慢摇晃离心管数次以充分消化,最后加入完全培养液终止消化。70 μm细胞筛过滤,收集滤液,以1 500 r·min-1离心5 min,去上清,完全培养液重悬细胞沉淀,以适当密度接种到包被小鼠IgG的培养皿中,于37 ℃、体积分数5% CO2的培养箱内培养1 h,洗脱未黏附细胞并收集,重新接种于包被小鼠IgG的培养皿中继续培养,纯化1~2次。后收集洗脱液并离心,小心弃去上清,利用完全培养基重悬细胞沉淀,以适当密度接种,于37 ℃、体积分数5% CO2的培养箱内继续培养,用于Western blot检测。
2.9 Western blot实验
收集Ⅱ型肺泡上皮细胞并移入离心管,加入预冷的RIPA裂解液,剧烈震荡后离心,以4 000 r·min-1离心10 min,取上清,BCA法测定蛋白质表达水平,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(压缩胶60 V,25 min;分离胶120 V,70 min),转膜(200 mA,120 min),后将PVDF膜于脱脂乳(0.05 g·mL-1)37 ℃摇床内封闭2 h,于稀释后的一抗(1∶1 000)内4 ℃孵育过夜;次日TBST洗膜,换液3~6次后于25 ℃摇床内用稀释后的二抗(1∶8 000)孵育2 h,TBST洗膜,换液3~6次,PVDF膜暗处浸润ECL显影试剂2~3 min,利用化学发光凝胶成像系统拍照记录。用Image J软件分析条带灰度值,以目的蛋白mTORC1、p-mTORC1、TFEB、LC3Ⅱ、LC3Ⅰ、p62、α-SMA与内参GAPDH灰度值比值表示蛋白的相对表达量。
2.10 统计学方法

3 结果
3.1 小鼠肺组织湿干质量比(W/D)
与正常组比较,模型组肺组织W/D值显著升高(P<0.05);与模型组比较,CSE低、中和高剂量组W/D值均显著下降(P<0.05);与CSE低剂量组比较,CSE中、高剂量组W/D值均显著降低(P<0.05);与CSE中剂量组比较,CSE高剂量组W/D值显著降低(P<0.05)。见表1。

表1 小鼠肺组织W/D值
3.2 小鼠肺泡灌洗液中TNF-α、IL-6和IL-1β的表达
ELISA结果显示,模型组肺组织灌洗液中TNF-α、IL-6和IL-1β水平显著高于正常组(P<0.05);与模型组比较,CSE低、中及高剂量组肺组织中TNF-α、IL-6和IL-1β水平均显著降低(P<0.05);与CSE低剂量组比较,CSE中、高剂量组TNF-α、IL-6和IL-1β水平均显著降低(P<0.05);与CSE中剂量组比较,CSE高剂量组TNF-α、IL-6和IL-1β水平显著降低(P<0.05)。见表2。

表2 小鼠肺泡灌洗液中TNF-α、IL-6和IL-1β水平
3.3 小鼠肺组织形态学变化
HE染色结果显示,正常组小鼠肺组织结构清晰,肺泡腔内无炎性细胞渗出,肺泡间隔未见增厚;模型组见有上皮细胞脱落,肺组织结构不完整,肺泡腔内炎性细胞渗出严重,肺泡壁增厚;CSE低、中和高剂量组小鼠间质性肺炎肺组织中,结构逐渐变得完整清晰、肺泡壁逐渐变薄,炎性细胞渗出均明显减少。见图1。
3.4 小鼠肺组织纤维化程度
Masson染色结果显示,正常组肺组织完整、清晰,排列规则,无胶原纤维沉积;模型组小鼠肺组织结构紊乱不规则,胶原纤维蓝色染色较深,纤维化严重;CSE低、中及高剂量组胶原纤维沉积较模型组均减少,蓝色变浅,纤维化减弱,且肺泡结构逐渐变得完整、清晰,见图2。
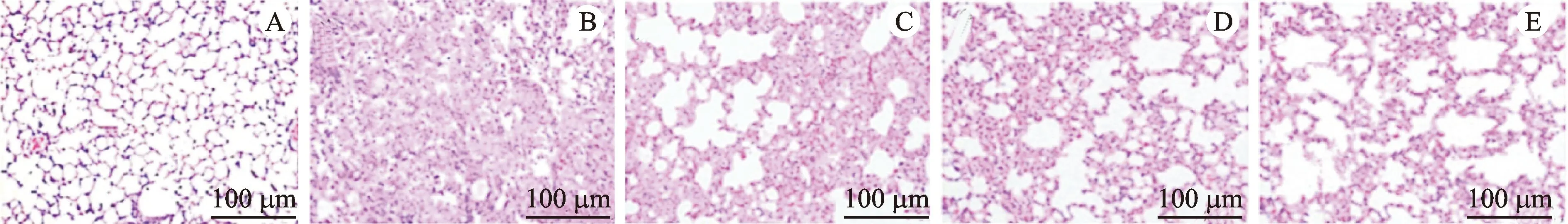
注:A.正常组;B.模型组;C.CSE低剂量组;D.CSE中剂量组;E.CSE高剂量组。

注:A.正常组;B.模型组;C.CSE低剂量组;D.CSE中剂量组;E.CSE高剂量组。
3.5 小鼠肺组织细胞凋亡情况
与正常组比较,模型组小鼠肺组织细胞凋亡率显著增加(P<0.05);与模型组比较,CSE低、中及高剂量组细胞凋亡率显著降低(P<0.05);与CSE低剂量组比较,CSE中和高剂量组细胞凋亡率均显著降低(P<0.05);另CSE高剂量组中的细胞凋亡率显著低于CSE中剂量组(P<0.05)。见表3、图3。

表3 小鼠肺组织细胞凋亡率

注:A.正常组;B.模型组;C.CSE低剂量组;D.CSE中剂量组;E.CSE高剂量组。
3.6 小鼠Ⅱ型肺泡上皮细胞中相关蛋白水平表达
Western blot结果显示,各组mTORC1总蛋白含量未见显著改变,但与正常组比较,模型组Ⅱ型肺泡上皮细胞中p-mTORC1、p62及α-SMA蛋白表达水平显著升高,TFEB、LC3Ⅱ/LC3Ⅰ蛋白表达水平显著降低(P<0.05);与模型组比较,CSE低、中和高剂量组Ⅱ型肺泡上皮细胞中p-mTORC1、p62及α-SMA水平均显著降低,TFEB、LC3Ⅱ/LC3Ⅰ蛋白表达水平显著升高(P<0.05);与CSE低剂量组比较,CSE中、高剂量组p-mTORC1、p62及α-SMA水平均显著降低,TFEB、LC3Ⅱ/LC3Ⅰ蛋白表达水平显著升高(P<0.05);与CSE中剂量组比较,CSE高剂量组p-mTORC1、p62及α-SMA蛋白水平显著降低,TFEB、LC3Ⅱ/LC3Ⅰ蛋白表达水平显著升高(P<0.05)。见表4、图4。
表4 小鼠Ⅱ型肺泡上皮细胞中相关蛋白表达
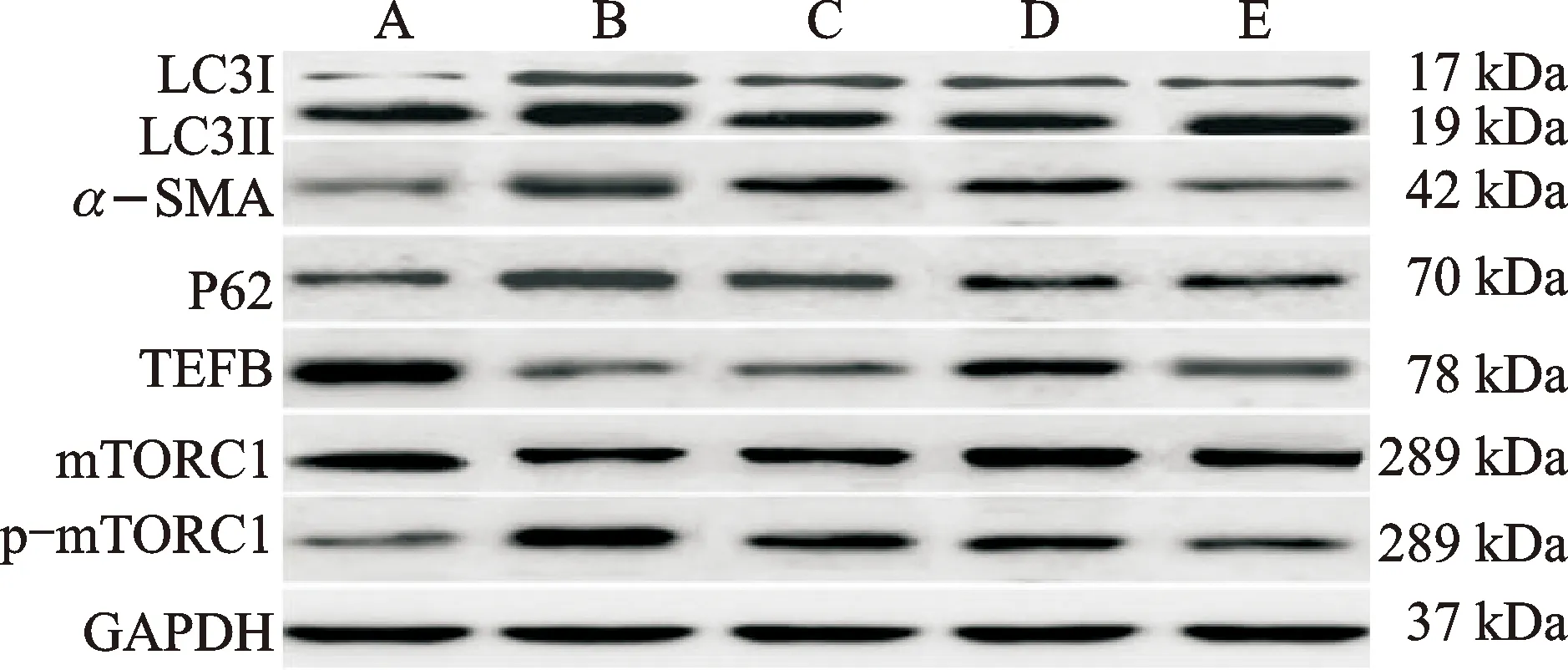
注:A.正常组;B.模型组;C.CSE低剂量组;D.CSE中剂量;E.CSE高剂量组。
4 讨论
IPF的发病机制始于肺泡炎,其特征是肺实质内炎症细胞积累并释放细胞因子,诱导成纤维细胞增殖并迁移到急性肺损伤区域,导致细胞外基质蛋白的分泌增强并沉积,最终引起肺纤维化[6]。越来越多的证据表明,肺泡上皮细胞,特别是Ⅱ型肺泡上皮细胞的功能障碍是纤维化发展的起点[7]。自噬是一种溶酶体介导的分解代谢过程,作为抵抗细胞应激的生存机制,其在调控肺部炎症和影响肺纤维化进程中发挥着重要作用[8-9],可清除肺纤维化时异常沉积的蛋白及受损的细胞器,并下调炎症反应;自噬功能障碍时可加快肺纤维化的发生发展[10-11]。
博莱霉素是目前公认的致肺纤维化药物[12],经一次性鼻腔滴注博莱霉素后,小鼠出现肺脏水肿,并见有肺泡壁增厚、腔内炎性细胞渗出及胶原纤维严重沉积、肺细胞大量凋亡,说明成功建立间质性肺炎模型。有研究表明,IL-6除作为促炎症细胞因子外,还与纤维化反应相关,可通过驱动慢性炎症和激活转化生长因子β途径促进纤维化[13],巨噬细胞来源的IL-1β也可加重纤维化[14]。本研究发现,与正常组比较,模型组中促炎因子TNF-α及IL-6、IL-1β水平均显著升高,肺组织见有严重炎性及纤维化病理损伤,细胞凋亡率高;而经CSE治疗后,炎性反应减轻,肺组织病理损伤及细胞凋亡情况得到显著改善,且效果呈现一定的剂量性依赖,提示CSE对小鼠间质性肺炎具有抗炎、抗纤维化作用。
自噬通常被认为是真核生物发育过程中溶酶体依赖的自我降解途径,与组织纤维化相关[15],其活性的降低被认为是肺纤维化发病机制中的关键过程[16]。LC3和p62蛋白可作为自噬的标志物[17],p62可与泛素化的蛋白质结合并与位于自噬小体内膜上的LC3II蛋白形成复合物,一同被自噬溶酶体降解,当LC3II/LC3I的表达水平降低时,大量p62在细胞中积聚,自噬受阻,从而导致自噬活性降低[18],自噬不足会促进肌成纤维蛋白标记物α-SMA表达,增加细胞外基质的沉积[19]而导致纤维化发展。mTORC1是调控自噬的关键因子,其通路的激活可抑制自噬,另外mTORC1也是TFEB活性的主要调控因子,TFEB的过表达可促进自噬和溶酶体基因的转录,进而提高溶酶体的降解能力[20]。本研究中结果显示,与正常组比较,模型组Ⅱ型肺泡上皮细胞中p-mTORC1、p62、α-SMA蛋白表达水平显著升高,TFEB、LC3Ⅱ/LC3Ⅰ蛋白表达水平显著降低,提示间质性肺炎Ⅱ型肺泡上皮细胞自噬活性不足及纤维化;经干预后,CSE可显著降低p-mTORC1、p62、α-SMA蛋白表达水平,提高TFEB及LC3II/LC3I的表达,提示CSE可能通过抑制mTORC1活性促进TFEB表达,进而提高细胞自噬活性,发挥改善间质性肺炎炎症及纤维化病理症状的潜力。
综上所述,CSE可减轻小鼠间质性肺炎的病理损伤,降低促炎因子表达,改善肺脏纤维化,其机制可能与抑制mTORC1活性、促进TFEB表达、进而诱导肺泡上皮细胞自噬的发生有关,可为中药治疗间质性肺炎提供一定参考依据。
