甘薯无糖组织培养技术的应用
2023-01-16解晓红解红娥王凌云王萌吴宇浩张鸿兴李江辉
解晓红,解红娥,王凌云,王萌,吴宇浩,张鸿兴,李江辉
(山西农业大学 棉花研究所,山西 运城 044000)
甘薯用途多样,营养丰富,被世界卫生组织列为13种最佳蔬菜之首,是现代人追求的功能食品[1-3]。近几年来,甘薯种植面积稳中有升,但由于种植区域引种混乱、长期连作、病虫害综合防治盲目,使得病毒病发生日趋严重,造成减产50%~80%,甚至绝收,甘薯病毒病已成为甘薯产业化发展的制约因素[4-6]。甘薯脱毒健康种苗快繁技术体系的建立[7-9],很好地解决了病毒病困扰问题,但脱毒组培苗在传统微繁殖中,以蔗糖作为组培苗生长碳源进行异养生长,导致脱毒组培苗的光合能力弱,生长质量差[10-11],组培苗经多次继代快繁后,出现黄、枯叶,茎尖生长萎靡、死亡,而后又呈二次多头生长;加之传统组培微生物污染严重,生根质量差,移栽驯化死苗现象严重,移栽成活率低,难以满足生产中优质脱毒健康种苗产业化应用。
无糖培养技术是环境控制技术与组织培养技术的有机结合,是用CO2代替糖作为碳源使组培苗进行自养生长,通过动态调整CO2浓度,人工控制光、温度、湿度,优化生长环境,提高脱毒组培苗的自身光合能力和适应外界环境能力,减少微生物污染率,从而促进植株健壮生长[12-16]。同时无糖培养的组培苗可一次性过渡成苗,提高了培养效率及移栽成活率,缩短了驯化缓苗时间,有效降低组培苗的生产成本[17]。目前国内外学者在微环境控制、CO2影响及装置、成本分析等方面进行了诸多的研究,研究结果已在花卉、中草药、马铃薯、草莓、花椰菜等多种植物中得到成功应用[18]。
本研究探讨无糖培养条件下不同基质及湿度对甘薯组培苗生长状况的影响,旨在为提高甘薯组培苗生长质量、改良甘薯种苗(薯)健康繁育提供技术支撑。
1 材料和方法
1.1 试验材料
晋甘薯9号、晋甘薯3号组培苗由山西农业大学棉花研究所甘薯室提供。
1.2 试验方法
1.2.1 不同基质处理对无糖培养组培苗影响 将试验基质砂子、蛭石装到无糖培养盒中,加入适量的营养液(硝酸铵钙2.0 g/L+KH2PO4170 mg/L),使基质手握成团,指缝不滴水,把剪切成2~3 cm茎段的甘薯组培苗移入培养盒中。为简化程序、节约成本,2种基质均不作灭菌处理,定期喷洒营养液确保盒内湿度在85%以上,每个处理30盒,每盒移植90苗。15 d调查组培苗的移栽成活率、细菌感染率、长势和生根数等。每处理每次随机选取5盒调查,重复3次。


1.2.2 基质湿度处理对无糖培养组培苗影响 以蛭石作为基质,加入营养液(2 g/L硝酸铵钙+170 mg/L KH2PO4)。试验设6个处理,即蛭石∶营养液(g∶mL)A. 660∶880;B. 660∶850;C. 640∶880;D. 640∶850;E. 670∶820;F. 670∶800。每盒移植90苗,用封口膜封闭培养盒。每个处理30盒。15 d调查组培苗的烂根率和长势,以组培苗85%生根为标准统计生根时间,每处理每次随机选取5盒调查,重复3次。

1.2.3 无糖培养与传统培养对比研究 传统培养:将已接种45~55 d的甘薯组培苗剪切成2~3 cm茎段接种在无激素添加的MS培养基上,于光强约1 600 μmol/(m2·s)、光周期12 h/d、温度(28±1)℃条件下进行快繁培养,接种450瓶(每瓶6株,共2 700株)。
无糖培养:将已接种45~55 d的甘薯组培苗剪切成2~3 cm茎段移植到装有蛭石的无糖培养装置中进行微繁殖和生根培养。移栽后放入密闭房间培养架上,前2 d不进行光照;自第3天始开2盏灯,约80 μmol/(m2·s),第8天始开4盏灯,约160 μmol/(m2·s),光 照12 h/d,温 度(28±1)℃。0~5 d脱毒苗处于缓苗期,光合作用较弱,不进行CO2供气;避免培养盒中湿度下降过快,植株发生萎蔫[17]。第5天开始供CO2200~600 mL/min,第10天开始供CO22 000 mL/min。CO2工作时间同光照时间一致,12 h/d。移植30盒(每盒90株,共2 700株)。
30 d后,每处理每次随机选取450株(5盒无糖培养、75瓶传统组培),调查传统组培和无糖培养的污染率,重复3次;同时每重复随机选取20个植株调查株高、根数、根长、单株鲜质量和株干质量等。
1.2.4 组培苗网棚移栽 传统组培苗移栽参照“甘薯脱毒苗圃地直接移栽技术研究”[19]。
无糖培养组培苗外移。无糖培养25 d后,打开上盒盖,在自然条件下进行炼苗过渡,第3天视基质干湿程度适当喷水,4~5 d外移温室。从无糖培养盒中直接拿出组培苗,移栽到温室土壤中,温室土壤湿度13%~14%,环境湿度75%以上。
分3次移栽,传统组培和无糖培养每次各移栽900株,7 d调查不同培养方式甘薯组培苗移栽的成活率。
1.3 数据分析
试验数据采用SPSS 27.0软件进行方差分析。
2 结果与分析
2.1 无糖培养中不同基质对培养效果的影响
结果表明,以透气性好、保水性能佳、污染源少的蛭石为作基质,晋甘薯3号和晋甘薯9号组培苗细菌(霉菌)感染率分别为1.18%和0.96%,成活率99%以上,组培苗叶绿、生长健壮。以砂子作基质,晋甘薯3号和晋甘薯9号的细菌(霉菌)感染率分别为12.74%和10.59%,成活率分别为79.26%和93.04%(表1),可见,以蛭石作为基质无糖培养效果明显优于砂子。此外,同种基质培养下,晋甘薯9号的各指标均优于晋甘薯3号。

表1 基质对无糖培养效果的影响(15 d)Tab.1 Effects of substrate on sugar free culture(15 d)
2.2 蛭石湿度对组培苗生长的影响
基质湿度是影响通气性、微生物活动重要因素之一,对组培苗生长、诱发新根和成活起关键作用[19]。以蛭石为培养基质,硝酸铵钙2.0 g/L+KH2PO4170 mg /L作营养液,研究湿度对试管苗生长和移栽成活率的影响,结果表明,晋甘薯3号和晋甘薯9号均表现为F处理组培苗生长及生根最好,其烂根率分别为6.21%和0.59%,生根天数约为8 d,原因可能是由于湿度比较小维持了基质的通透性,便于组培苗根系的营养吸收和呼吸。A、B、C、D处理由于湿度大,影响了通气性,使组培苗根系呼吸、生长受阻,造成组培苗感染病菌腐烂死亡(表2)。
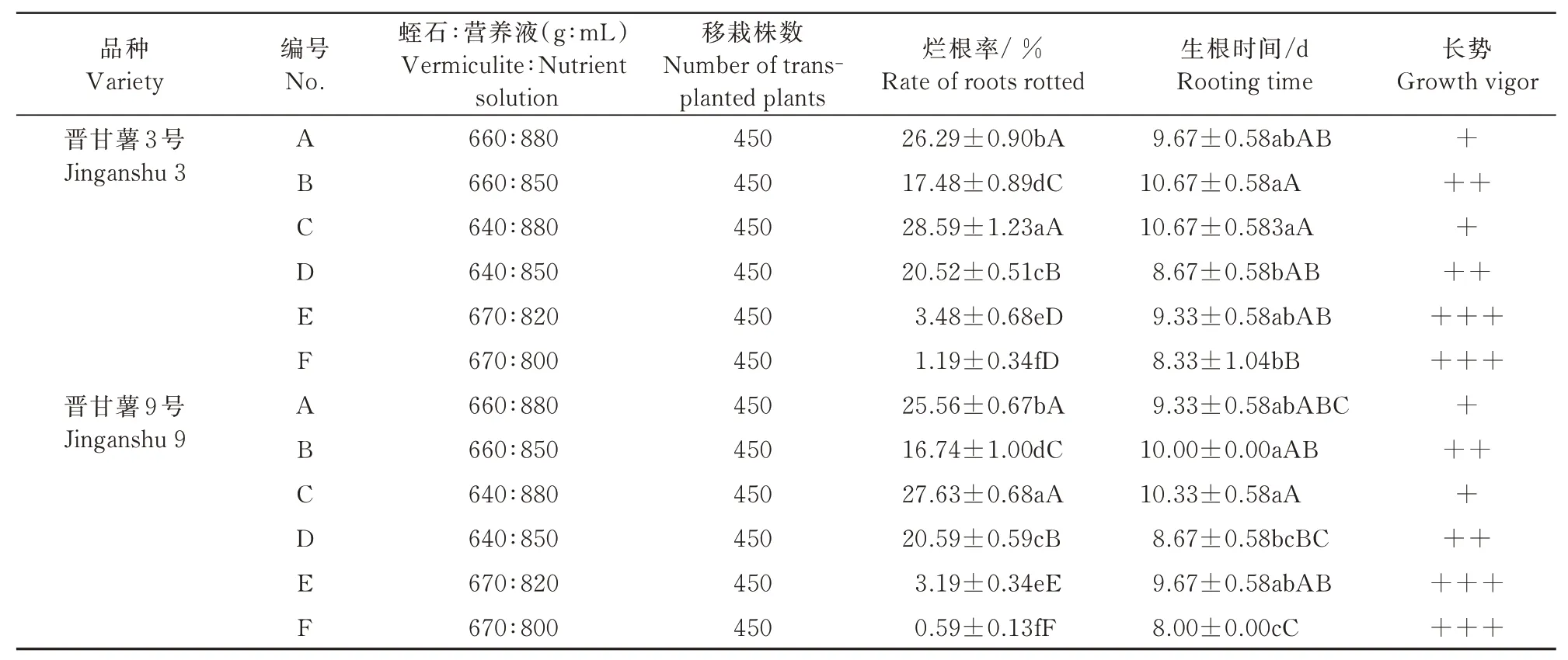
表2 蛭石湿度对试管苗生长的影响Tab.2 Effect of vermiculite humidity on the growth of test tube seedlings
2.3 传统组培和无糖培养对组培苗生长的影响
分别将2个处理的组培苗取出,洗净基部培养基及基质,测定株高、根数、根长、鲜质量、干质量,结果如表3所示,晋甘薯3号、晋甘薯9号无糖培养的株高较传统组培分别高0.477、0.882 cm,差异显著(P<0.05);生根数分别增加2.04、2.32条/株,差异显著(P<0.05);根长差异不显著。单株鲜质量分别平均增加2 613.9、2 654.7 mg,差异显著(P<0.05);单株干质量分别平均增加265.3、258 mg,差异达显著水平(P<0.05);无糖培养污染率分别为1.18%、0.96%,传统组培污染率分别为15.11%、10.22%,差异极显著(P<0.01)。无糖培养条件下,甘薯组培苗通过光合自养合成自身所需的有机物,生长速度快,生长健壮。培养30 d统计组培苗生长情况,无糖培养植株叶片增大,较直立,叶色浓绿,组培苗健壮;传统组培植株叶片细小,有黄叶、枯叶(图1)。

表3 不同培养方式对甘薯组培苗生长的影响(30 d)Tab.3 Effects of different culture modes on growth of sweet potato tissue culture seedlings(30 d)

图1 不同培养方式甘薯组培苗生长对比Fig.1 Comparison of sweet potato tissue culture seedlings under different culture modes
2.4 传统组培和无糖培养对组培苗移栽成活率的影响
温室移栽7 d调查统计结果显示,无糖培养的晋甘薯3号和晋甘薯9号移栽成活率分别为97.74%和98.30%;传统组培二者移栽成活率分别为90.04%和91.15%,差异显著(P<0.05)(表4),可见,无糖培养移栽的组培苗较传统组培的组培苗缓苗时间短,成活率高。可能是因为无糖培养过程中自身合成的光合产物促进了组培苗根系快速生长,生根数量增加,根系粗壮,有韧性;传统组培的组培苗从恒温恒湿的异养环境移栽到网棚后,有些组培苗不能适应自养环境而死亡。
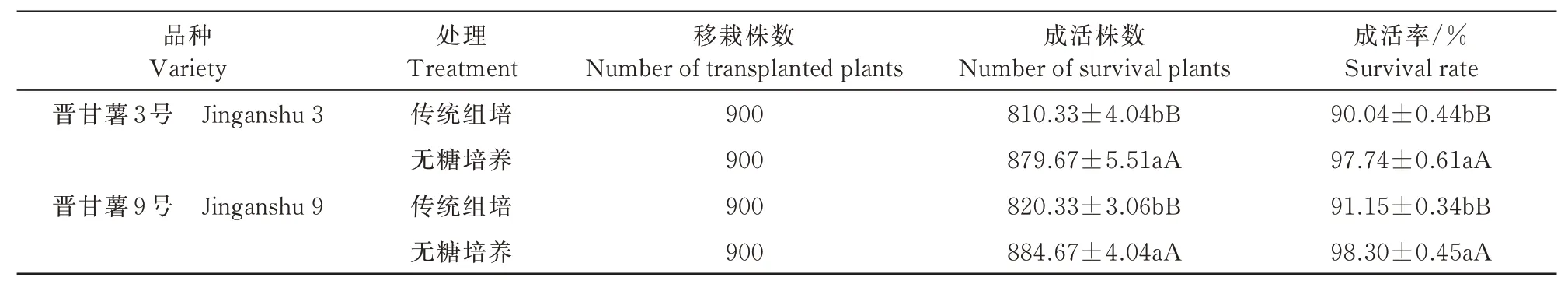
表4 不同培养方式甘薯组培苗移栽成活率的影响(7 d)Tab.4 Effect of different culture modes on transplanting survival rate of sweet potato tissue culture seedlings(7 d)
3 结论与讨论
无糖培养技术是环境控制技术和组织培养技术的结合,很好地解决了传统有糖培养中微生物污染严重、植株生理代谢异常、生长细弱、驯化阶段植株死亡率高等问题。甘薯无糖培养需要强制通入CO2,增加光照强度,促进组培苗进行光合作用生产有机物来维持和促进生长,所以进行无糖培养的组培苗必须具有一定叶面积的外植体[14]。本试验中,采用已接种45~55 d组培苗剪切成2~3 cm茎段,带有2~4个叶片,组培苗能充分进行光合作用,生产的有机物促使组培苗生长加快,叶片增大,叶色浓绿,根系发达,苗木健壮。此外,甘薯无糖培养需要一定基质作为支撑物,基质的通气性和湿度是微生物活动的重要因素之一,对组培苗生长、诱发新根和成活起关键作用。选择透气性好、保水性能佳、污染源少的的蛭石作为支撑物,维持了基质的通透性,可促进组培苗根系营养吸收和呼吸,组培苗生长健壮,可以不经过驯化阶段直接移栽,缩短了培养周期。另外,试验选择硝酸铵钙2 g/L+磷酸二氢钾170 mg/L代替MS作为营养液浇灌,满足了组培苗生长所需营养,简化了程序,节约了生产成本。
作为一种新的培养方法,无糖培养技术已经成功在部分植物中得到广泛应用。屈云慧等[16]研究表明,情人草组培苗在不同基质中无糖培养较传统组培根数增加7~9条,根长增加0.40~1.05 cm,生根率提高10.0%~18.3%。淡明等[20]研究认为,甘蔗无糖培养株高较常规培养高1.03 cm,差异不显著,无糖培养的植株鲜质量比常规培养的多0.73 g,生根数和根长分别为3.60条/株和1.08 cm,与常规培养差异显著。肖玉兰等[21]以非洲菊试管苗为试材,用MS无糖培养基培养,采用2孔透气封口膜,滤膜微孔直径0.5 μm,在光照8 000 lx+CO23 920 mg/m3条件下,植株生根快,健壮,叶片大,干物质含量高。张婕等[22]对黄菖蒲无糖培养研究认为,无糖培养组培苗株高、叶长、叶数、根长和根数等生长指标高于传统组培方式,且增加浓度能大大加快植株生长速度。我们在甘薯上的研究进一步支持了这些结果。随着植物无糖培养技术理论体系的日臻成熟,这一技术将以低成本生产高质量微扦插种苗的优势,应用于植物工厂化、规模化生产中。
本研究获得了无糖培养的适宜基质为蛭石,最佳湿度为蛭石∶营养液(g∶mL)=670∶800,与传统组培比较显著提高了甘薯组培苗生长质量和移栽成活率。研究仅从无糖培养的基质及其湿度对甘薯组培苗生长质量方面进行了初步的探讨研究,对于甘薯无糖培养组培苗最适宜光合速率的最佳CO2浓度、最佳光照强度等问题还需进一步深入探讨。
