急性前体T淋巴细胞白血病缓解后继发急性髓系白血病1例并文献分析
2023-01-16张玉培刘超张然万鼎铭姜中兴谢新生
张玉培,刘超,张然,万鼎铭,姜中兴,谢新生
(郑州大学第一附属医院 血液内科,河南 郑州 450052)
急性前体T淋巴细胞白血病(early T-cell precursor acute lymphoblastic leukemia,ETP-ALL)是2016年世界卫生组织淋巴造血组织肿瘤分类提出的属于T细胞急性淋巴母细胞白血病/淋巴瘤的一种罕见、高危的亚型,ETP细胞起源于造血干细胞,保留了一定的多向分化潜能[1-2]。其定义基于白血病细胞的免疫表型,典型特征为CD7+、CD1a-、CD8-、CD5-(dim<75%),同时伴随1个或多个干细胞或髓系抗原标志(CD117、CD34、HLA-DR、CD13、CD33、CD11b或CD65)[3]。患者接受治疗后继发骨髓增生异常综合征(myelodysplastic syndromes,MDS),后进展为急性髓系白血病(acute myelogenous leukemia,AML),目前未见报道。ETP-ALL和AML肿瘤细胞系别来源不同,2种疾病出现于同一患者极其罕见。现将郑州大学第一附属医院血液内科收治的1例ETP-ALL缓解后继发MDS后进展为AML患者的诊断及治疗过程结合文献复习。报告如下。
1 病例资料
患者,男,14岁,入院前10余天自行触及颌下、左耳后及腹股沟数个肿大淋巴结,最大者约3 cm×3 cm,质硬,边界清楚,活动度可,无触痛,余无不适。血常规:白细胞(white blood cell,WBC)3.4×109L-1,血红蛋白(hemoglobin,Hb)129.0 g·L-1,血小板(platelets transfusion,PLT)197×109L-1。骨髓涂片:原始粒及早幼粒0,原始及幼稚淋巴细胞占40%。骨髓流式细胞学:异常早期T淋巴细胞占有核细胞的34.46%,免疫表型见表1。淋巴结活检病理及免疫组化、正电子发射计算机断层显像CT、骨髓活检、骨髓活检免疫组化结果均支持同一诊断,明确诊断为ETP-ALL。行“VDLP”方案[长春新碱(深圳万乐药业有限公司,国药准字H44021772)1.4 mg·m-2,第1、8、15、22天使用;柔红霉素(瀚辉制药有限公司,国药准字H33020925)40 mg·m-2,第1、8、15、22天使用;培门冬酶(江苏恒瑞医药股份有限公司,国药准字H20090015)2 500 IU·m-2,第9天使用;泼尼松片(天方药业有限公司,国药准字H41020283)1 mg·kg-1,第1~14天使用,第15天开始(第15~28天)减低1/3剂量],1个月后给予“CAT”方案[环磷酰胺(Baxter Oncology GmbH,国药准字HJ20160467)750 mg·m-2,第1、8天使用;阿糖胞苷(Actavis ltaly S.p.A,国药准字HJ20160403)100 mg·m-2,第1~3天、第8~10天使用;巯嘌呤片(浙江浙北药业有限公司,国药准字H33020001)60 mg·m-2·d-1,第1~7天使用]化疗后患者疗效评价部分缓解,后每隔1个月行“大剂量甲氨蝶呤”[(Pafizer Pty Limited,国药准字H20140207)3 g·m-2,第1天使用]化疗4个周期后疗效评价达完全缓解(complete remission,CR);后每隔1个月给予1次巩固强化治疗,共给予4个周期“VDLP(同前)”、3个周期“CAT(同前)”、4个周期依托泊苷(齐鲁制药有限公司,国药准字H20143143,60 mg·m-2,第1~5天使用)联合异环磷酰胺(Baxter Oncology GmbH,国药准字H20140099,1.2 g·m-2,第3~5天使用),疗效评价均为CR,其间给予7次腰椎穿刺联合三联药物鞘内注射[地塞米松(天津金耀药业有限公司,国药准字H12020515)5 mg,甲氨蝶呤(同上)15 mg,阿糖胞苷(同上)50 mg]。预行第18个疗程化疗入院复查骨髓穿刺,骨髓细胞学结果提示原始粒细胞占7.6%。骨髓流式提示异常早期髓系细胞占5.5%。免疫表型见表1。荧光原位杂交检测提示7q-/del(7q);基因突变:WT1阳性,TET2突变。诊断为MDS伴原始细胞增多Ⅰ型,行“地西他滨(正大天晴药业集团股份有限公司,国药准字H20120066)20 mg·m-2·d-1,第1~5天使用”方案化疗1个疗程,1个月后再次行“地西他滨(用量同前)”方案化疗后复查骨穿。骨髓涂片:原始粒细胞占28.8%,原始及幼稚单核细胞占56.0%。提示由MDS进展为AML(M4b),分别给予“地西他滨、伊达比星(瀚辉制药有限公司,国药准字H20050144,12 mg·m-2,第1~3天使用)联合阿糖胞苷(100 mg·m-2,第1~7天使用)”“地西他滨(用量同前)、克拉屈滨(浙江海正药业股份有限公司,国药准字H20052240,5 mg·m-2,第1~5天使用)、高三尖杉酯碱(杭州民生药业有限公司,国药准字H33020007,4 mg,第1~7天使用)联合阿糖胞苷(0.03 g,第1~7天使用)”“地西他滨、高三尖杉酯碱、依托泊苷联合阿糖胞苷(用量同上)”方案化疗。复查骨髓穿刺:异常早期髓系细胞占68.8%,微小残留病变占54.38%;提示疾病未缓解,后行支持治疗,于确诊AML 7个月后因疾病进展而死亡。患者各疾病阶段的临床特征见表1。

表1 患者各疾病阶段的临床特征
2 讨论及文献复习
ALL和AML肿瘤细胞系别来源不同,临床大多单独起病,发生于同一患者罕见,目前认为同一患者出现多种系别的血液系统肿瘤主要有3种形式:第一,同时具有表达淋系和髓系抗原的肿瘤细胞,如双表型急性混合白血病;第二,来源于淋系和髓系独立的2种血液系统肿瘤;第三,治疗后再发肿瘤。其一与治疗相关,发生在烷化剂或放射治疗后5~7 a(常见染色体5q和/或7q异常),或发生在拓扑异构酶Ⅱ抑制剂治疗后2~3 a[4-5];其二是淋系和髓系系别转换,其转换是双向的。目前关于淋系和髓系转换有以下2种假说:(1)在疾病早期同时伴有其他亚克隆,但被优势克隆掩盖,针对显性克隆的化疗可以使亚克隆扩大,并在去分化及转分化作用下进展为具有不同表型的亚克隆[2,6];(2)髓系/淋巴样祖细胞的存在,不同谱系来源于同一克隆祖细胞[2,7]。此外,微环境可能通过调节细胞的基因组可塑性来影响所有已提出的机制,并改变白血病复发时的转归。
本例患者以全身多发淋巴结肿大为首发症状,初诊时血常规正常,骨穿结果原始及幼稚淋巴细胞占40%,排除T淋巴母细胞淋巴瘤,免疫组化示淋系伴髓系表达,髓过氧化物酶阴性,依据欧洲白血病免疫分类组织提出的评分系统和世界卫生组织最新的诊断标准排除急性混合细胞白血病[8]。结合免疫表型明确诊断为ETP-ALL,此种疾病于2009年在儿童病例中首次报道[9],具有分化为髓系的潜能,本病例验证了这一点,与其他亚型相比,ETP-ALL不缓解和复发的风险较非ETP-ALL增高[3]。该患者经化疗后达到CR,提示了ETP-ALL用多药联合强化化疗有一定的疗效,为该病治疗提供了一定的参考依据。异基因造血干细胞移植是治疗 ETP-ALL的有效方法[10],但本例患者达CR后因经济问题拒绝接受异基因造血干细胞移植。本案例为治疗后继发肿瘤,初诊及再发肿瘤间隔29个月,组织化学和免疫分型均有改变,有2个独立克隆的明确证据,不能排除长期使用化疗药物的直接基因毒性作用与免疫功能障碍致使治疗相关肿瘤的发生;但初诊时未行染色体及基因检测,无法与复发时进行对比,即无明确的细胞遗传学证据支持这2种肿瘤之间克隆的相关性,但该例患者CD7+、CD33+在初诊及复发时均可检测到,提示T细胞系和髓系前体细胞均有参与,其可能来源于同一CD7+、CD33+的髓系/淋系祖细胞,也可能是初诊时的髓样克隆在微环境的影响下逐渐扩增,最终演变为AML。本案例确诊AML后多次化疗仍未缓解,后很快因疾病进展死亡,提示淋髓系转换患者预后极差。
急性白血病的系别转换少见且往往发生在儿童,髓系转换为淋系比淋系向髓系转换更加罕见[11]。本文汇总了1997年1月至2022年2月文献报道的淋系白血病转为髓系白血病案例,以“acute myeloid leukemia”联合“acute lymphoblastic leukemia”或“Lineage switch”或“acute leukemia”联合“relapse”或“secondary acute myeloid leukemia”检索了PubMed数据库;以“急性髓系白血病”联合“急性淋巴细胞白血病”检索了中国知网、万方数据库;排除儿童(14岁以下)急性白血病、急性早幼粒细胞白血病、急性混合表型白血病或不明确谱系的病例及同时诊断为ALL和AML者,加上本例共计23例(表2)。对以上23例患者进行统计分析,由于样本量较小且呈偏态分布,本文采用中位数来描述集中趋势。
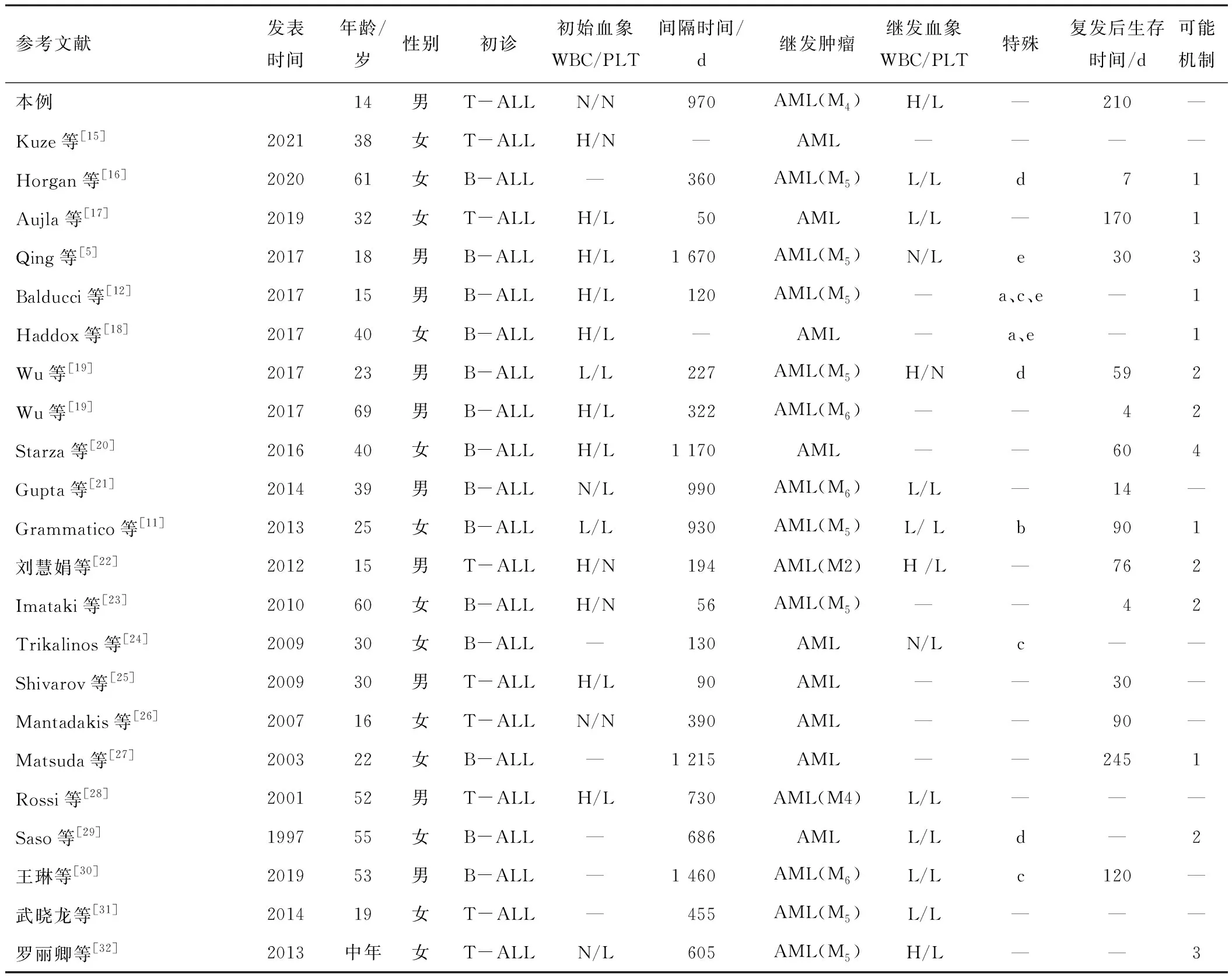
表2 淋系治疗后合并髓系肿瘤病例报道特征
病例特点如下。(1)女13例(56.5%),男10例(43.5%);中位发病年龄32(14~69)岁;T淋巴细胞白血病8例(34.8%),B淋巴细胞白血病15例(65.2%);在继发肿瘤病例中可见,女性多于男性,B淋巴细胞白血病与T淋巴细胞白血病相比,更易发生系别转换。(2)共14例患者髓系肿瘤具有FAB分型记录:其中M42例,M58例,M63例,M21例。主要集中在粒-单核系统,同时也有其余分型的转换趋势,但由于病例数少,需大样本研究来进一步揭示其规律。(3)在可查及初诊时血常规资料的17例病例中,白细胞增高10例,白细胞正常4例,白细胞减少2例,血小板减少12例;在可查及再发肿瘤时血常规资料的14例病例中,白细胞增高4例,白细胞正常2例,白细胞减少8例,血小板减少13例;发现初诊时白细胞以增高为主,继发髓系肿瘤时白细胞以减少为主,不管是初诊还是再发肿瘤中,血小板均以减少为主。(4)在可总结再发肿瘤机制的14例病例中,治疗相关2例,初诊与继发肿瘤间隔时间分别为1 670、605 d,与既往报道的治疗相关中位间隔时间3~4 a[5]不符;系别转换12例,其中初诊与再发肿瘤中位间隔时间为322 d(与儿童报道的中位时间为15 d不一致[2],表明成人与儿童谱系系别机制是否相同仍需进一步探索),通过对比初诊及复发时免疫表型及细胞遗传学,支持髓系/淋巴样祖细胞假说6例,支持原始亚克隆假说1例;以上讨论治疗后再发肿瘤假说在病例中均有可能发生,通过比较两种恶性肿瘤的免疫表型和细胞遗传学/分子改变,可以做出正确的诊断,在白血病诊治过程中也要完善随访及相关骨穿检查,及早发现再发肿瘤。(5)其中发生t(4;11)(q21;q23)遗传学异常3例,发生t(12;17)(p13;q11)遗传学异常1例,在此4例患者中,同时可明确再发肿瘤机制3例,均支持髓系/淋巴样祖细胞假说,提示此2种染色体易位可能是具有髓系/淋巴祖细胞特有的细胞遗传学标志。(6)其中发生MLL/AF4基因重排3例,发生于Blinatumomab治疗后3例;在婴儿白血病相关报道中,在发生MLL基因重排或用CD19靶向免疫治疗的白血病患者中系别转换的发生率偏高[2,12-13]。Wölfl等[14]报道了1例B-ALL婴儿用blinatumomab治疗后转为AML的病例,在停止使用blinatumomab后恢复为B-ALL,提示系别转换可能自发逆转,在成人病例中具有MLL基因重排或用CD19靶向免疫治疗的白血病患者也可发生系别转换,但其相关性需进一步探索。(7)发生于移植之后4例,说明移植之后仍可发生系别转换。(8)在可查及再发髓系肿瘤后生存时间的14例病例中,中位生存时间为60 d,说明发生髓淋系转换患者的生存期短,预后极差。
综上所述,ETP-ALL属于T细胞急性淋巴母细胞白血病/淋巴瘤的高危疾病亚型,具有一定的多向分化潜能,本报道说明其可再发MDS及AML,其转换机制尚不明确,初诊及再发肿瘤时完善的细胞遗传学及分子生物学监测有助于明确其发生机制。
