槲皮素对α-ZOL诱导Caco-2细胞损伤的保护作用研究
2023-01-16李姝荟周鸿媛张宇昊
张 驰 李姝荟 周鸿媛 郭 婷 张宇昊 马 良
(西南大学食品科学学院,重庆 400715)
玉米赤霉烯酮是粮食安全领域重点研究的真菌毒素之一[1-2]。α-玉米赤霉烯醇(α-Zearalenol,α-ZOL)是玉米赤霉烯酮在人畜体内代谢后的主要代谢产物[3-4],主要毒性表现为雌激素作用,且高于母体毒素3~4倍,严重危害动物生产性能和人类健康[5-7]。目前利用食源性天然成分的生物活性干预危害因子毒性已成为研究热点之一[8-12]。
槲皮素(quercetin,Que)是一种广泛存在于蔬菜、水果中的膳食多酚类黄酮化合物[13-14],具有多种生物学活性及很高的药用价值,在营养干预及多种疾病模型的防治中受到广泛关注[15-17]。如前期报道,Que可以提高核转录因子表达、抗氧化酶活性和总抗氧化能力,从而有效调节T-2[18]、黄曲霉毒素B1(aflatoxin B1,AFB1)[19]和赭曲霉毒素A(ochratoxin A,OTA)[20]引起的氧化应激,显示出良好的抗氧化活性。体外模拟研究证明Que对人血清白蛋白上结合的α-ZOL有竞争取代作用[21];因此,本研究利用α-ZOL诱导Caco-2细胞建立氧化损伤模型,从氧化应激、线粒体功能和细胞凋亡等方面研究Que对α-ZOL诱导的细胞毒性损伤的影响和相关机制,以期为利用具有生物活性的天然产物降低真菌诱导的毒性损伤提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 细胞系人结肠腺癌细胞系Caco-2来源于美国模式培养物集存库(American Type Culture Collection,APCC)细胞库。
1.1.2 药物与试剂槲皮素(Que),纯度≥97%,上海阿拉丁生化科技股份有限公司;α-玉米赤霉烯醇(α-ZOL),纯度≥99%,新加坡Pribolab公司;不完全高糖培养基(dulbecco’s modified eagle medium,DMEM),江苏凯基生物技术有限公司;细胞增殖及毒性(Cell Counting Kit-8,CCK-8)检测试剂盒,南京草本源生物科技有限公司;活性氧(reactive oxygen species,ROS)检测试剂盒,上海贝博生物科技有限公司;吖啶橙(acridine orange,AO)染色液,北京索莱宝生物技术有限公司;丙二醛(malondialdehyde,MDA)检测试剂盒、超氧化物歧化酶活性(superoxide dismutase,SOD)检测试剂盒、2,2'-二辛可宁酸(2,2'-bicinchonininc acid,BCA)蛋白浓度测定试剂盒、三磷酸腺苷(adenosine triphosphate,ATP)检测试剂盒、线粒体膜电位检测试剂盒-荧光探针法(5,5',6,6'-Tetrachloro-1,1',3,3'-tetraethyl-imidacarbocyanine iodide,JC-1)、膜联蛋白V-荧光素异硫氰酸酯(annexin V-fluorescein isothiocyanate,Annexin V-FITC)细胞凋亡检测试剂盒,均购于上海碧云天生物技术有限公司;一抗半胱天冬酶-3(cysteinyl aspartate specific proteinase,Caspase-3)、一抗核转录因子E2相关因子2(nuclear factor erythroid-2-related factor-2,Nrf2)、一抗B淋巴细胞瘤-2(b-cell lymphoma-2,Bcl-2)、辣根过氧化生物酶HRP标记羊抗兔二抗,美国Abcam公司。
1.1.3 仪器与设备371型二氧化碳培养箱、ST40R型冷冻离心机,美国赛默飞世尔科技公司;SW-CJ-2F型超净工作台,苏州安泰空气技术有限公司;IX73型荧光显微镜,日本Olympus公司;SYNERGY2型多功能酶标仪,美国伯腾仪器有限公司;BD FACSVerse型流式细胞仪,美国Becton Dickison公司;DYCZ-24DN型垂直电泳槽,北京六一仪器厂。
1.2 试验方法
1.2.1 Caco-2细胞存活率及ROS、MDA和SOD水平的测定a.细胞处理:Caco-2细胞培养12 h后,镜下观察贴壁生长;吸除DMEM培养基,先分别用含有浓度为0、20、40、60 µmol·L-1Que的DMEM培养基预处理24 h,吸除培养基,然后再用含有浓度为0、20、40、60 µmol·L-1α-ZOL的培养基作用24 h。b.培养结束后,按照试剂盒说明书检测各组中细胞存活率及MDA含量和ROS、SOD活力。
1.2.2 Caco-2细胞中ATP和线粒体膜电位的测定ATP水平检测方法:不同药物处理结束后(同1.2.1a),用4℃预冷的磷酸缓冲盐溶液(phosphate buffered saline,PBS)缓慢清洗一次,每孔加入200µL ATP检测裂解液,适当吹打,于4℃、12 000×g条件下离心5 min,取上清,按照试剂盒说明书操作。根据构建的标准曲线计算样品中的ATP浓度。
线粒体膜电位检测方法:不同药物处理结束后,每孔加入1 mL JC-1工作液,在37℃孵箱中培养20 min,用现配的JC-1染色缓冲液(1×)洗涤两次,加入1 mL DMEM培养基,于荧光显微镜下观察。
1.2.3 Caco-2细胞凋亡的观察及检测Hoechst 33342/碘化丙啶(propidium iodide,PI)双染观察细胞死亡情况:不同药物处理结束后(同1.2.1a),每孔加入1 mL细胞染色缓冲液,随后加入5µL Hoechst染色液、5 µL PI染色液并混匀,37℃孵育25 min,结束后用荧光显微镜观察。
AO染色观察细胞核形态变化:不同药物处理结束后(同1.2.1a),每孔加入1 mL用PBS配置好的浓度为10 µg·mL-1的AO染色工作液,轻轻混匀,室温避光染色20 min,结束培养后,于荧光显微镜下观察。
流式细胞术检测细胞凋亡率:不同药物处理结束后,加入200µL胰酶消化细胞,离心收集细胞,用195µL荧光探针异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的磷脂结合蛋白(Annexin V),即Annexin V-FITC重悬细胞,再加入5µL Annexin V-FITC,轻轻混匀,最后加入10µL PI染色液,轻轻混匀。室温下避光孵育15 min后,1 000×g离心5 min,弃上清,用PBS重悬洗涤未结合的染色液,用流式细胞仪进行检测。
1.2.4 蛋白免疫印迹分析接种Caco-2细胞于六孔板中,不同药物处理结束后(同1.2.1a),用PBS洗涤,加入细胞裂解液(radio immunoprecipitation assay,RIPA)于冰上裂解30 min,离心取上清,采用BCA试剂盒进行蛋白定量。随后,取30µg变性蛋白上样,采用凝胶电泳分离蛋白后,将蛋白转印至硝酸纤维素膜(nitrocellulose filter membrane,NC膜),用5%脱脂奶粉封闭2 h后,加入相应一抗(Nrf2,1∶1 000;Bcl-2,1∶1 000;Caspase-3,1∶1 000),4℃封闭过夜,洗涤缓冲液洗3次,加二抗(1∶1 000)封闭液封闭1 h,采用化学发光试剂(enhanced chemiluminescence,ECL)发光法显色。
1.3 统计学分析
采用Microsoft Office Excel 2016进行数据统计,并计算平均值和标准偏差,采用SPSS 22.0统计分析软件分析数据,使用Duncan's多重比较法进行显著性分析,P<0.05表示差异显著。使用Origin 9软件绘图。
2 结果与分析
2.1 Que对α-ZOL诱导Caco-2细胞活力的影响
由图1-A可知,α-ZOL对Caco-2细胞活力具有明显的抑制作用,其半抑制浓度(IC50)为82.94µmol·L-1。当Que浓度低于80µmol·L-1时,随着Que浓度的升高,Caco-2细胞活力均有不同程度的升高,但Que浓度为80µg·mL-1和160µg·mL-1时,会对细胞的增殖出现抑制作用,这可能是因为高剂量的Que可以在离体线粒体和培养的细胞中增强O2-·的生成,降低细胞总抗氧化能力[22]。
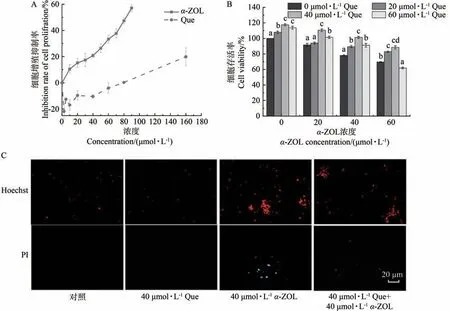
图1 Que对α-ZOL诱导Caco-2细胞损伤的影响Fig.1 Effect of Que on Caco-2 cell injury induced by α-ZOL
Que对α-ZOL诱导Caco-2细胞存活率的影响如图1-B所示,相比20、40、60µmol·L-1α-ZOL单独处理组,经过20、40、60µmol·L-1Que预处理的细胞存活率有所提高,其中40 µmol·L-1Que下的细胞存活率最大。对此组进行Hoechst 33342/PI双染观察,结果如图1-C所示,α-ZOL引起细胞核染色质凝集、浓缩,最终形成凋亡小体,表现出细胞凋亡的典型特征;Que在该过程中起到了保护作用,与40µmol·L-1α-ZOL组相比,40 µmol·L-1Que+40 µmol·L-1α-ZOL组染色细胞数明显减少,凋亡细胞比例减少,细胞凋亡有明显改善。但经高浓度的α-ZOL(60µmol∙L-1)暴露细胞24 h后,60µmol∙L-1Que预处理达不到改善的效果。因此,60 µmol∙L-1α-ZOL和Que不作为后续试验中的给药剂量。
2.2 Que对α-ZOL诱导Caco-2细胞氧化损伤的影响
由图2-A可知,细胞内的ROS荧光强度随α-ZOL浓度的增加而增强,而Que的干预使各α-ZOL浓度诱导的荧光强度明显减弱。由图2-B~D可知,α-ZOL使细胞内的ROS、MDA水平显著升高,SOD活力降低;20、40 µmol·L-1Que的干预使ROS、MDA水平显著低于α-ZOL组,SOD相对活力呈量效关系。由此说明,细胞经α-ZOL处理后发生了较严重的损伤,而Que可通过有效清除自由基和增强细胞自身的抗氧化能力来缓解活性氧对细胞膜脂质氧化损伤的影响,进而减轻α-ZOL诱导的细胞氧化应激损伤。其中,当细胞经过40µmol∙L-1Que预处理,再经40µmol∙L-1α-ZOL暴露24 h时的改善效果最佳。因此,在后续试验中统一采用此浓度模型进行干预。
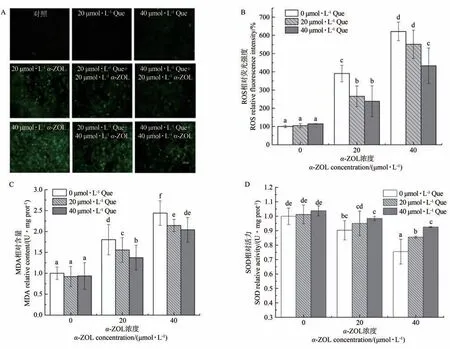
图2 Que对α-ZOL诱导氧化损伤的影响Fig.2 Effect of Que on cell oxidative damage by α-ZOL
2.3 Que对α-ZOL诱导Caco-2细胞线粒体功能的影响
ATP和线粒体膜电位的变化与活性氧自由基的产生有关,当细胞受到毒性物质的刺激发生凋亡或坏死时,由于氧化应激而导致的细胞损伤甚至死亡将伴随两者水平的降低,表明线粒体的功能受损或下降[23-24]。由图3可知,与对照组相比,α-ZOL组ATP相对含量和红绿荧光强度比值显著降低,说明线粒体功能受损;而与α-ZOL组相比,Que的干预可使ATP相对含量提高3个百分点,红绿荧光强度比值提高9%。结果表明,Que可抑制α-ZOL引起的ATP含量和线粒体膜电位降低,使得细胞有足够的能量物质来源以适应α-ZOL对线粒体造成的损害作用,从而维持氧化应激条件下线粒体正常的生理功能。
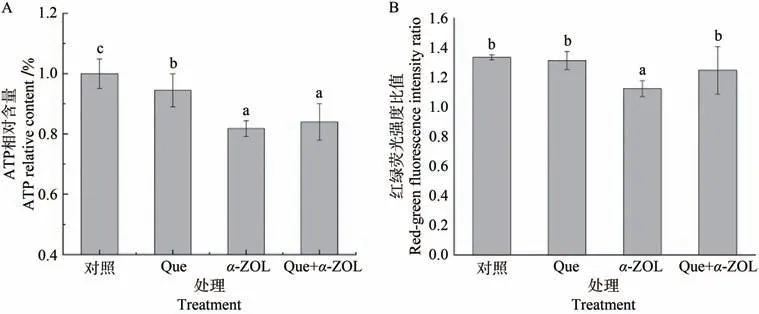
图3 Que对α-ZOL诱导线粒体功能损伤的影响Fig.3 Effect of Que on mitochondrial function injury by α-ZOL
Que组的ATP水平下降可能是因为细胞内ATP与二磷酸腺苷(adenosine diphosphate A,ADP)是动态平衡的关系,ATP/ADP比例适当下降,通常会导致细胞内二氧化碳的积累,从而刺激呼吸作用产生,促进线粒体代谢[25]。
2.4 Que对α-ZOL诱导Caco-2细胞凋亡的影响
由图4-A可知,Que组和对照组的细胞形态正常,并呈现出均匀的浅绿色荧光。α-ZOL使细胞产生了核浓染及碎片化的现象,发出亮绿色荧光(图中箭头所指示),而Que的干预减少了不规则碎片细胞的出现,降低了致密浓染的程度,表明40µmol·L-1Que可减轻α-ZOL引起的细胞核DNA受损程度,从而降低细胞凋亡数。由图4-B可知,相较于对照组,α-ZOL组细胞凋亡率明显著增加,而Que的干预使细胞凋亡率有所降低,表明Que可通过减弱α-ZOL诱导的细胞凋亡来保护细胞。
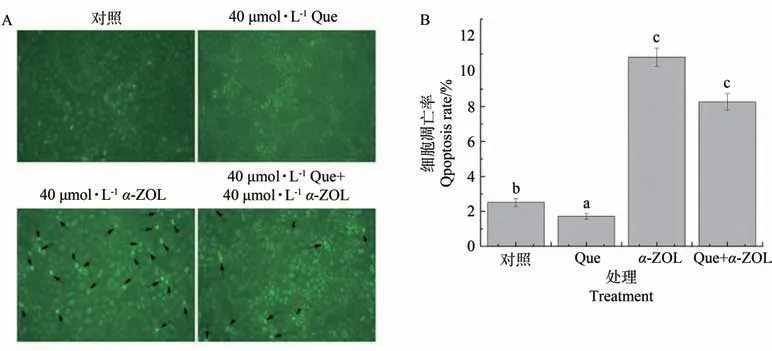
图4 Que对α-ZOL诱导细胞凋亡的影响Fig.4 Effect of Que on cell morphology induced by α-ZOL
2.5 Que对α-ZOL诱导Nrf2、Bcl-2和Caspase-3蛋白表达的影响
采用蛋白免疫印迹(western blotting,WB)分析抗氧化蛋白Nrf2、抗凋亡蛋白Bcl-2以及促凋亡蛋白Caspase-3的表达水平,结果如图5所示,与对照组相比,40µmol·L-1Que组能够上调Nrf2和Bcl-2的表达,下调Caspase-3的表达;与α-ZOL组相比,40µmol·L-1Que+40µmol·L-1α-ZOL能够将Nrf2、Bcl-2和Caspase-3蛋白相对表达水平恢复至正常水平,说明Que+40µmol·L-1α-ZOL能够对抗凋亡基因Bcl-2进行合理的调控,进一步下调Caspase-3活性从而抑制α-ZOL诱导的Caco-2细胞凋亡。
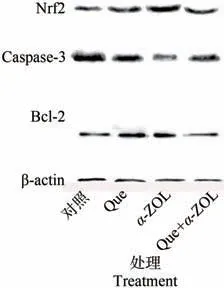
图5 各组Nrf2、Bcl-2和Caspase-3蛋白表达水平Fig.5 Nrf2,Bcl-2 and Caspase-3 protein expression levels in each group
3 讨论
本研究中α-ZOL诱导细胞产生大量ROS,破坏细胞的氧化调节系统,降低胞内抗氧化酶系的活力,致使胞内的氧化与抗氧化之间的平衡被打破,导致细胞发生不可逆的氧化损伤,这与目前报道α-ZOL对多种机体细胞有毒性作用,且产生毒性的机制主要是诱导细胞发生氧化应激[26-27]的研究结果一致。同时,本研究发现α-ZOL诱导的细胞损伤还与其损伤线粒体功能以及诱导细胞凋亡有关,α-ZOL诱导ROS的产生并引发线粒体膜电位降低,抑制ATP合成,导致线粒体功能受损继而启动细胞线粒体途径凋亡级联反应,激活Caspase-3,从而使细胞发生凋亡。研究结果进一步丰富了α-ZOL毒性作用机制。
线粒体内已形成一套有效的抗氧化系统专门用于去除各种类型的ROS或修复生物分子的氧化损伤[28-29],一种可能的保护策略是用抗氧化剂丰富组织线粒体,从而限制线粒体氧化损伤、细胞损伤以及毒性的发生和发展[30]。本研究发现Que处理可缓解α-ZOL对细胞的损伤,究其原因,一方面槲皮素对ROS引起的线粒体损伤具有保护作用,可以提高ATP水平和线粒体膜电位,并且通过Bcl-2蛋白调控线粒体途径来下调Caspase-3表达量,从而使Bcl-2得以表达,减少细胞凋亡;另一方面槲皮素可能提升了内源性抗氧化剂的生成能力从而使其体现出良好的抗氧化能力,通过激活Nrf2信号通路的核转移来提高SOD活力,清除由α-ZOL诱导产生的过多ROS,进而缓解α-ZOL诱导细胞引起的氧化应激,减少细胞凋亡。本研究结果进一步证实了前人关于Que在细胞抗氧化、抗凋亡及保护线粒体方面起重要作用的结论[31]。
4 结论
本研究结果表明,Que干预α-ZOL诱导的Caco-2细胞氧化损伤,明显降低Caco-2细胞ROS水平、MDA含量,提高SOD活力;同时维持线粒体膜电位、ATP含量以减轻线粒体受损程度,有效减轻α-ZOL对Caco-2细胞造成的毒性损伤。为控制α-ZOL危害,进行科学合理的健康膳食干预非常重要。基于本试验研究结果,Que在生物体内的保护作用及机制等可在下一步工作中进行深入探究。
