冻干条件下地衣芽孢杆菌微胶囊的制备工艺优化及在模拟肠胃液中的生存能力
2023-01-16王梓腾杨文革胡永红
程 梦,王梓腾,,杨文革,胡永红
(1. 南京工业大学 药学院,江苏 南京 211800;2. 南京工业大学 食品与轻工学院,江苏 南京 211800)
目前,人们对开发具有潜在健康益处的益生菌剂型有着极大的兴趣。益生菌作为活的微生物,当有效摄入量足够大时,对宿主的健康带来益处[1-3]。迄今为止,获得批准的益生菌有很多,如乳酸杆菌、双歧杆菌和芽孢杆菌等。在芽孢杆菌属(Bacillus)中,已经研究发现地衣芽孢杆菌(B.licheniformis)具有防治肠胃疾病、改善机体生长性能和提高动物健康的作用[4]。益生菌在使用过程中需要保持一定的活力和活性,为了确保益生菌可以有效发挥作用,将益生菌制备成微胶囊是一种有效的方式[5-6]。微胶囊化是封装的一种方式,封装为益生菌抵御不良环境提供了屏障,减少了益生菌在加工、储存和消化过程中不可避免的生物活性损失[7-8],由于低温干燥可以最大限度避免细胞丧失活力、微胶囊结构遭到破坏,所以益生菌的微胶囊化可在冻干条件下进行[9]。
结冷胶是一种多糖微粒,具备良好的耐热和耐酸的能力[10],可作为药物递送和靶向释放的载体[11]。β-环糊精具有外疏水、内亲水特性,常用作包埋材料[12]。以酪朊酸钠作为微胶囊壁材制备的微胶囊结构无裂痕[13]。
针对地衣芽孢杆菌在胃肠液存活率低的问题,本研究选取地衣芽孢杆菌CGMCC 6155作为益生菌,以结冷胶、β-环糊精和酪朊酸钠作为微胶囊壁材,制备冻干地衣芽孢杆菌微胶囊,考察冻干条件下,壁材配比、壁材浓度、反应转速以及地衣芽孢杆菌添加量对冻干地衣芽孢杆菌微胶囊包埋率的影响,得到最佳制备条件,以评估微囊化的地衣芽孢杆菌在胃肠液环境下的生存能力。
1 材料及方法
1.1 供试菌株
地衣芽孢杆菌CGMCC 6155,保藏于笔者所在实验室。
1.2 材料
结冷胶,上海百灵威化学技术有限公司;β-环糊精,北京伊诺凯科技有限公司;酪朊酸钠,南京昊淳生物技术有限公司;LB培养基、胃蛋白酶、胰蛋白酶,艾览化工科技有限公司;琼脂,西格玛奥德里奇贸易有限公司;胆酸钠水合物,萨恩化学技术有限公司。
1.3 菌悬液制备方法
将地衣芽孢杆菌CGMCC 6155的菌株从-80 ℃冰箱中以5%(体积分数)的接种量接入LB培养基中,放在摇床上以180 r/min、37 ℃培养30 h。将活化的菌株在100 mL LB培养基中进一步培养,并在相同条件下孵育30 h,以获得稳定的菌株发酵液。将发酵液在4 ℃下以8 000g离心10 min,弃去上清液,沉淀的细胞用0.9%生理盐水洗涤2次,然后离心。菌株在磷酸盐缓冲液(PBS,pH 7.4)中配制成菌悬液,使有效活菌数为4.0×109CFU/mL。制得的益生菌悬浮液置于4 ℃冰箱冷藏,用于微胶囊的制备。
1.4 微胶囊制备方法
将β-环糊精溶于PBS(pH 7.4)中,放在磁力加热搅拌器上600 r/min、100 ℃搅拌20 min至溶液完全溶解后再加入结冷胶和酪朊酸钠,再搅拌15 min后,115 ℃高压灭菌30 min,得无菌壁材溶液,冷却至25 ℃。将地衣芽孢杆菌CGMCC 6155菌悬液与壁材溶液以体积比1∶ 3混合,使最终的混合溶液的壁材质量分数为16%、有效活菌数为1.0×109CFU/mL。将混合物充分搅拌,400 r/min磁力搅拌混匀30 min,均质机10 000 r/min均质1 min,再将溶液倒入无菌培养皿中,-20 ℃下预冻,过夜。主干燥设定为在-40 ℃下冷冻干燥48 h,然后进行4 h的二次冷冻干燥。冻干相同体积的地衣芽孢杆菌CGMCC 6155菌悬液(有效活菌数为1.0×109CFU/mL)作为对照组,不使用任何微胶囊材料。微胶囊或对照细菌的干燥物在无菌条件下手工研磨,转移到无菌硅胶瓶中,并在4 ℃下储存,直到进行表征分析。
1.5 测定方法
1.5.1 微胶囊包埋率的测定
包埋率(EY)是衡量包埋操作影响活细胞数量的标准。取制备好的微胶囊1 g放入PBS中,使用均质机均质至微胶囊完全解囊释放出菌体,随后对溶液中的活菌数进行梯度稀释涂布,计算每克微胶囊的有效活菌数(CFU/g)。采用LB固体培养基进行活菌计数。等量初始菌悬液中的活菌总数为制备相应质量的微胶囊加入的菌悬液活菌数,记为x1;微胶囊悬液的活菌总数(CFU)为每克微胶囊包埋的活菌数,记为x2;微胶囊总质量记为m;包埋率的计算见式(1)。
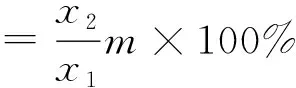
(1)
1.5.2 微胶囊含水率的测定
含水量过高会影响微胶囊的贮藏稳定性。称量m1克微胶囊样品放在烘箱中105 ℃干燥,使微胶囊中的水分挥发至恒质量,记最终的质量为m2克。含水率的计算见式(2)。
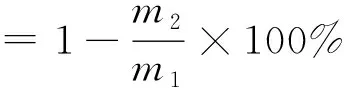
(2)
1.5.3 微胶囊基本形态的测定
使用ULTRA PLUS型扫描电镜 (德国ZEISS公司)考察冷冻干燥法制备的微胶囊形态。使用条件为在真空高压下,以10 keV的增强电压测定微胶囊的形态。分析前,将样品粉末放在铜台上,并喷镀Au涂层。
1.5.4 微胶囊结构变化的测定
在微胶囊的制备过程中,复合壁材之间可能存在相互作用,从而引起最终壁材结构的变化,物化性质也随之改变。为了确定结构的变化,对微胶囊进行红外光谱的测定。本研究使用Cary670型傅里叶变换红外光谱仪 (Agilent公司) 测定微胶囊的结构变化。通过对结冷胶、β-环糊精、酪朊酸钠、结冷胶+β-环糊精+酪朊酸钠制备的微胶囊进行测定分析,比较4种壁材的红外光谱,确定结构变化。傅里叶变换红外光谱仪的分辨率为4 cm-1,波数范围为4 000~400 cm-1。为减少误差,每个样本重复3次。
1.5.5 微胶囊在模拟胃肠液中存活性能的测定
模拟胃液(SGF)和模拟肠液(SIF)是参照Yao等[14]以及Michida等[15]的制备方法并经过一些修改而制备的。SGF的具体配比如下:NaCl 2 g/L、盐酸0.2%(体积分数),去离子水定容。通过向20 mL胃液原液中加入0.064 g胃蛋白酶来制备最终的SGF,并用1 mol/L盐酸将pH调节至3.0。SIF的具体配比如下:胰酶10 g/L、Nacl 8.5 g/L、胆盐5 g/L和胰蛋白酶10 g/L,去离子水定容。用1 mol/L NaOH溶液将pH调节至6.5后,将SGF和SIF溶液通过0.22 μm滤膜过滤并灭菌。
参照Yao等[14]的方法测定游离(对照)和微囊化地衣芽孢杆菌在SGF和SIF中的耐受性。将1 g样品加入9 mL SGF或SIF中混合后,在37 ℃下以100 r/min的转速持续振荡。分别在0、30、60、90、120和180 min后取样1 mL并充分稀释,然后使用均质机均质30 s,确保微胶囊的地衣芽孢杆菌释放完全,再在LB平板上计算地衣芽孢杆菌的存活率。每个样品做3次重复试验,结果取平均值。
1.6 统计分析
使用SPSS 17.0软件(美国SPSS Inc.)进行单向方差分析。均值之间的差异通过Duncan的多范围检验进行检验。所有值均显示为平均值和平均值标准误差。当P值≤0.05,差异被认为是显著的。
2 结果与讨论
2.1 不同壁材配比对微胶囊包埋率的影响
为考察β-环糊精、结冷胶和酪朊酸钠作为复合壁材的包埋效果,以冻干微胶囊的菌株包埋率为指标,设计3因素3水平的正交试验表进行试验,确定3种壁材的最佳配比。每组试验分别做3次平行试验,最终的包埋率取3次试验结果的平均值(以下均做3次平行试验)。
复合壁材配比的正交试验设计及结果分析见表1和表2。由表1~2可以看出,微胶囊的包埋率在56.28%~81.39%范围内,复合壁材配比对微胶囊的包埋率有显著影响。3种壁材对微胶囊包埋率的影响显著性(从大到小)为结冷胶、酪朊酸钠、β-环糊精。复合壁材的最佳配比为结冷胶0.3%、β-环糊精4%、酪朊酸钠2%。使用复合壁材的最佳配比进行重复验证试验,最终微胶囊的包埋率为85.21%。
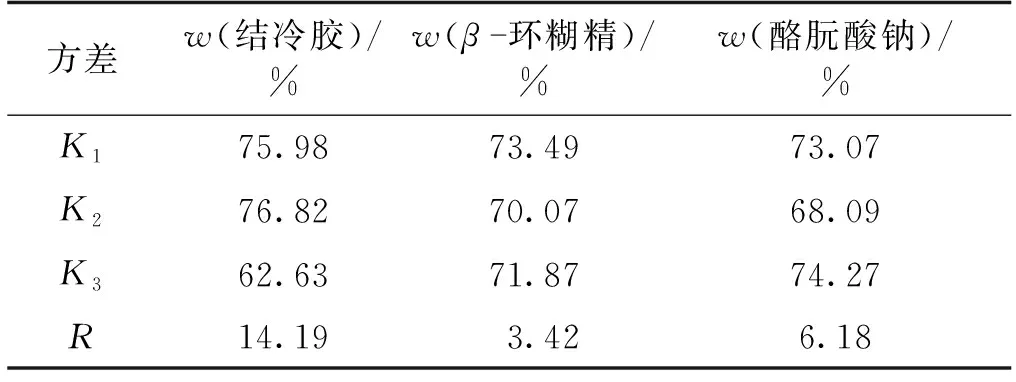
表2 复合壁材配比正交试验结果分析
2.2 壁材用量对微胶囊包埋率的影响
按照确定的复合壁材最佳配比,分别配制最终质量分数为12%、14%、16%、18%、20%和22%的复合壁材溶液,其他条件不变,以冻干后的微胶囊菌体的包埋率为指标,确定复合壁材的最佳质量分数,结果如图1所示。
由图1可知,壁材质量分数显著影响微胶囊的包埋率。当壁材质量分数为12%时,包埋率为55.21%。当壁材质量分数增加到18%时,包埋率升高到86.48%,此时包埋率的值最大。当壁材质量分数继续增加,微胶囊的包埋率随着壁材质量分数的增加而降低。当壁材质量分数为22%,微胶囊的包埋率下降至81.44%,微胶囊互相黏在一起,很难得到单个微胶囊。综上,壁材的适宜质量分数范围为16%~20%。
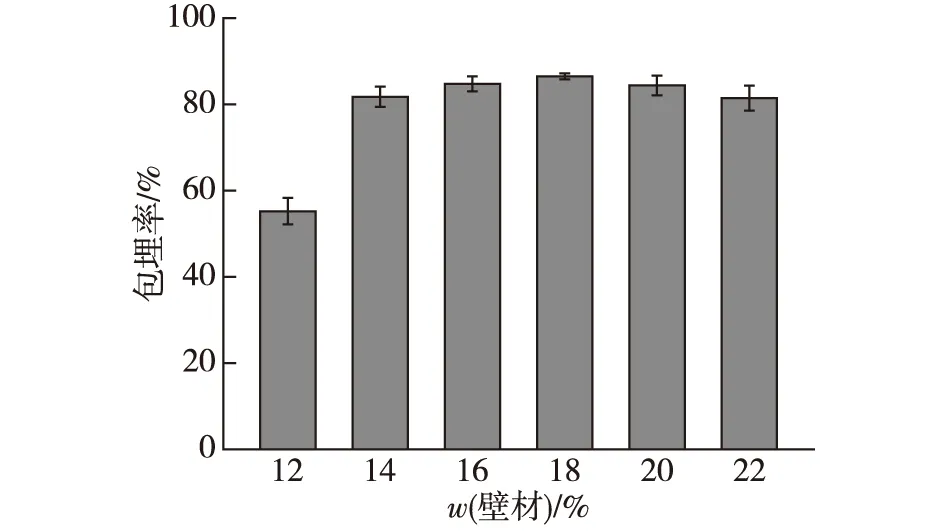
图1 壁材质量分数对微胶囊包埋率的影响Fig.1 Effects of wall material concentration on the embedding rate of microcapsules
2.3 菌添加量对微胶囊包埋率的影响
菌添加量对微胶囊的包埋率有影响,但不影响微胶囊的形状和表面光滑度。使用0.9%生理盐水配制有效活菌数分别为4.0×106、4.0×107、4.0×108、4.0×109、4.0×1010和4.0×1011CFU/mL的菌悬液,按照复合壁材最佳配比,其他条件不变,以冻干微胶囊的菌株包埋率为指标,确定地衣芽孢杆菌CGMCC 6155的最适添加量,结果如图2所示。
由图2可知:菌添加量在4.0×106和4.0×107CFU/mL时,微胶囊的芯材占比小,包埋率较高,分别为82.45%和86.38%;当菌添加量分别为4.0×108、4.0×109、4.0×1010和4.0×1011CFU/mL时,包埋率缓慢增加后迅速降低,且当菌添加量为4.0×1011CFU/mL时,包埋率降至40.44%。由此推测:当菌添加量较少时,壁材富余,能够包裹住芯材,但是从成本角度不够合理,因此不予考虑4.0×106和4.0×107CFU/mL的菌添加量;当菌添加量过多时,壁材的包埋能力达到极限,部分芯材没有被壁材包埋,包埋率也因此降低。综合实验结果及成本考虑,确定适宜菌添加量为4.0×108~4.0×1010CFU/mL。
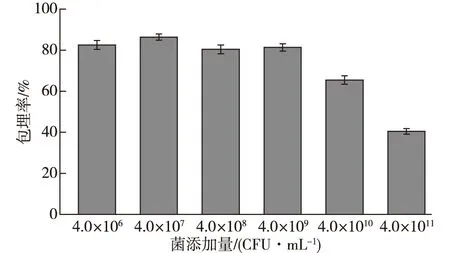
图2 菌添加量对微胶囊包埋率的影响Fig.2 Effects of the amount of bacteria added on the embedding rate of microcapsules
2.4 反应转速对微胶囊包埋率的影响
分别设定反应转速为200、300、400、500、600和700 r/min,按照复合壁材最佳配比,其他条件不变,以冻干微胶囊的菌株包埋率为指标,确定最佳反应转速,结果如图3所示。
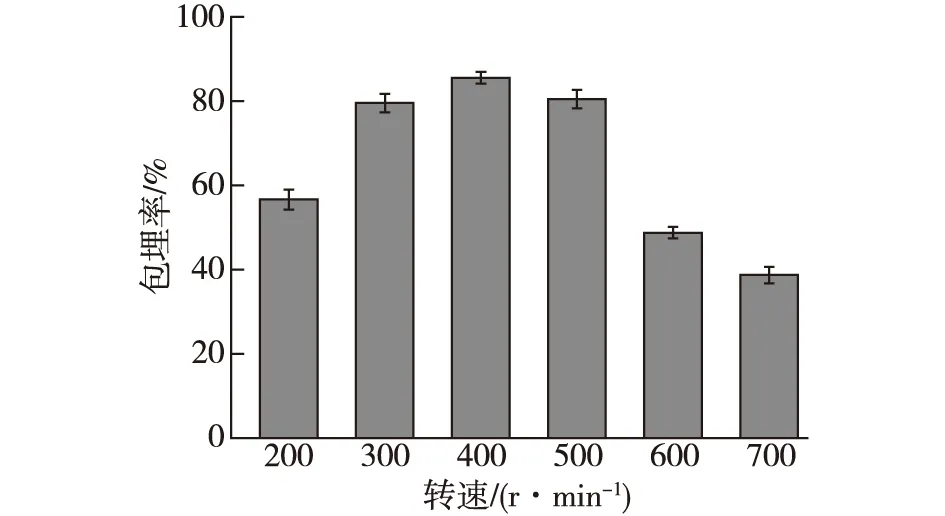
图3 反应转速对微胶囊包埋率的影响Fig.3 Effects of reaction speed on microcapsule embedding rate
由图3可知:当转速为200 r/min时,微胶囊的包埋率为56.62%,随着转速的增加,微胶囊的包埋率也在不断地增大;当转速增加到400 r/min时,微胶囊的包埋率达到最大值,为85.53%;当转速继续增加到700 r/min时,微胶囊的包埋率下降至38.66%,包埋效果差。这可能是因为转速太快,而微胶囊的体积则相对较小,所包含的菌含量也少,因此包埋率低。另外可能因为转速太快,导致混合溶液的泡沫过多,形成的微胶囊量少,包埋率也低。因此,适宜的反应转速为300~500 r/min。
2.5 真空冷冻干燥制备微胶囊的正交试验结果
采用正交试验设计,考察复合壁材溶液的浓度、反应转速以及菌添加量3个因素组合后对冻干微胶囊的菌株包埋率的影响,确定地衣芽孢杆菌CGMCC 6155微胶囊制备工艺的最佳条件。
微胶囊制备工艺的正交试验设计及结果分析见表3和表4。由表3~4可知:真空冷冻干燥法制备芽孢杆菌微胶囊的包埋率为43.45%~91.75%,R值越大,相应因素的影响越显著,3个因素对包埋率的影响显著程度(从高到低)依次为菌添加量、复合壁材质量分数、转速。最佳工艺组合为复合壁材质量分数16%、转速300 r/min、菌添加量109CFU/mL。
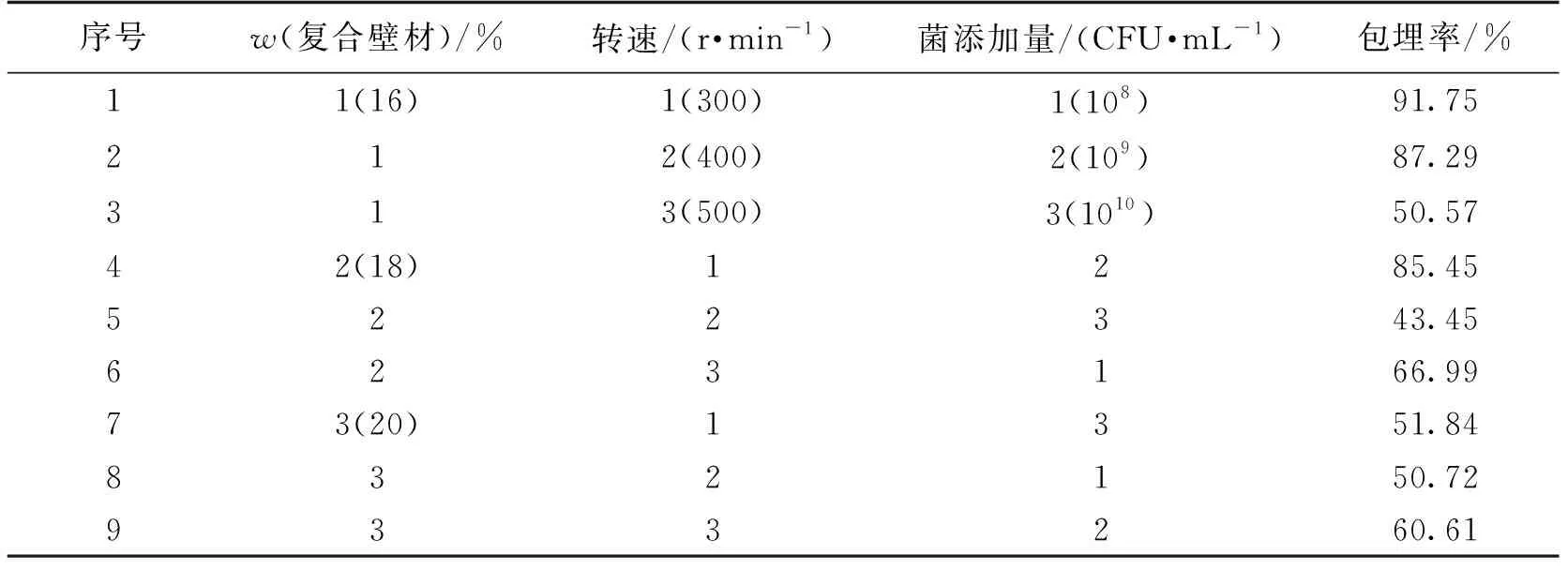
表3 微胶囊制备工艺正交试验设计
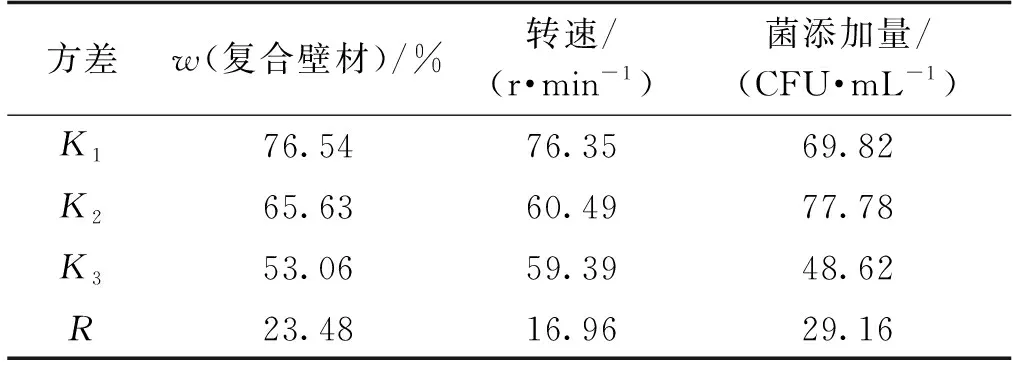
表4 微胶囊制备工艺正交试验结果分析
使用优化后的工艺条件进行重复验证试验,最终微胶囊的包埋率为93.25%。因此,复合壁材质量分数16%(结冷胶0.3%、β-环糊精4%、酪朊酸钠2%)、转速300 r/min、菌添加量109CFU/mL是冷冻干燥法制备芽孢杆菌微胶囊的最佳工艺条件。
2.6 微胶囊的表面结构及含水率
用扫描电镜分析冻干微囊的表面形态特征,结果见图4。由图4可知:微胶囊大部分为球形,表面有褶皱、较粗糙。在用复合壁材(结冷胶+β-环糊精+酪朊酸钠)包封的微胶囊中观察到的微结构变化是由于每种壁材的黏弹性和成膜性能不同。微胶囊的扫描电镜照片上没有显示裂缝或可见断裂,这表明3种类型的微胶囊材料可以对益生菌提供适当的保护。真空干燥后得到的微胶囊颜色为白色,含水率2.48%。Albadran等[16]研究生物微胶囊的含水率后发现,微胶囊的含水率低于10%时,其贮藏稳定性显著提高。综上所述,真空冷冻干燥法得到的微胶囊芯材被很好地保护在壁材中。

图4 地衣芽孢杆菌CGMCC 6155微胶囊的SEM图Fig.4 SEM image of B. licheniformis CGMCC 6155 microcapsules
2.7 微胶囊傅里叶红外光谱分析结果

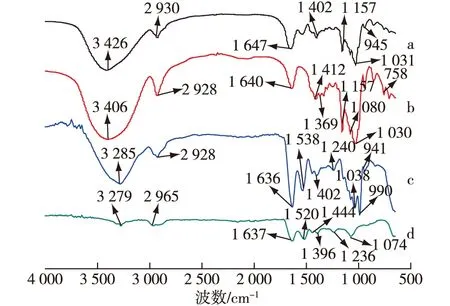
图5 微胶囊(a)、结冷胶(b)、β-环糊精(c)和酪朊酸钠(d)的傅里叶红外光谱Fig.5 Fourier infrared spectra of microcapsules (a),gellan gum (b),β-cyclodextrin (c) and sodium caseinate (d)
2.8 芽孢杆菌微胶囊在模拟人工肠胃液中的生存性能
益生菌进入生物体内的顺序是先进入胃部,再进入肠道发挥作用。但是胃部的环境酸性较强,会导致益生菌受到胃酸的破坏,活力大大下降,进入肠道时,活性指数无法达标。肠道是益生菌发挥作用的主要部位,为了确保益生菌能够最大程度发挥作用,益生菌经过胃部时需要尽可能免受胃酸的破坏,顺利进入肠道并定植。本研究通过人工模拟肠胃液环境,将游离的地衣芽孢杆菌和地衣芽孢杆菌微胶囊处理不同的时间,以最终的活菌数(lg(CFU/g))来考察最佳包埋工艺条件制备的微胶囊对地衣芽孢杆菌的保护效果,结果如图6和图7所示。
2.8.1 在模拟胃液中的生存性能
由图6可知:尽管在暴露期间游离的地衣芽孢杆菌和包封在微胶囊里的芽孢杆菌的有效活菌数均减少,但是微胶囊的壁材能够保证地衣芽孢杆菌在人工模拟胃液中的活性维持在较高的水平。在整个暴露于SGF环境的180 min期间,微胶囊的芽孢杆菌存活数平均为6.87 lg(CFU/g),游离的芽孢杆菌存活数平均为3.73 lg(CFU/g)。在SGF环境中暴露90 min后,只有包封的芽孢杆菌的活菌数达到发挥药效的标准(>106CFU)。因此,当暴露在SGF环境下时,微胶囊壁材(结冷胶+β-环糊精+酪朊酸钠)具备有效保护芽孢杆菌的能力,暴露180 min后,包埋的芽孢杆菌比未包埋的芽孢杆菌高3.14 lg(CFU/g),游离菌与包埋菌之间的差异有统计学意义(P< 0.05)。李洪波等[17]研究发现:以酪蛋白和海藻酸钠为壁材,内源乳化后得到的微胶囊能够显著提高包埋益生菌的生存性能;周莉等[18]以海藻酸钠和乳清分离蛋白包埋两歧双歧杆菌,在模拟胃液中存活率≥70%。这些阳性结果表明,地衣芽孢杆菌微胶囊在SGF的环境下,能有效保护益生菌。
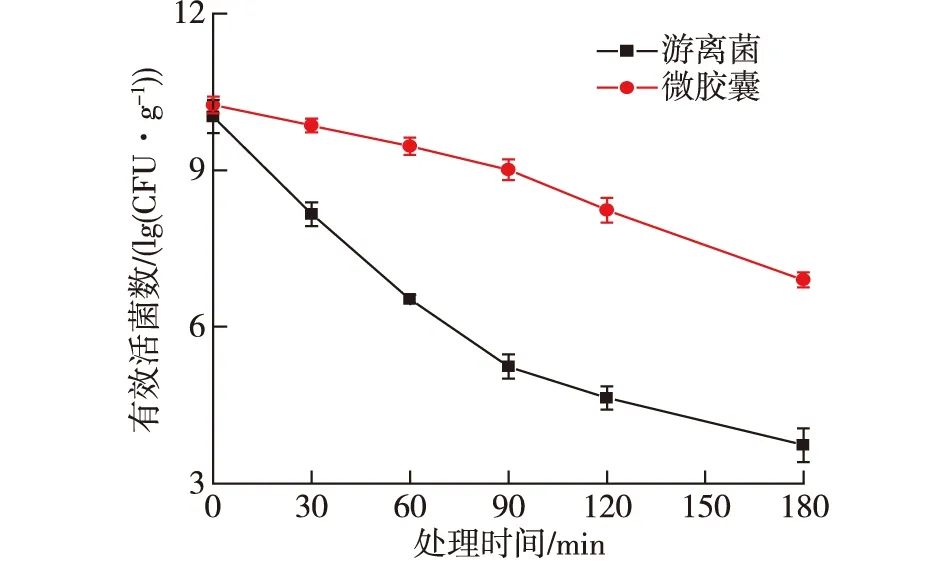
图6 地衣芽孢杆菌CGMCC 6155在SGF中的生存性能Fig.6 Viability of B. licheniformis CGMCC 6155 in SGF
2.8.2 在模拟肠液中的生存性能
由图7可知:暴露180 min后,包埋的芽孢杆菌比未包埋的芽孢杆菌的有效活菌数高2.34 lg(CFU/g)。游离的地衣芽孢杆菌在SIF环境中,随着暴露时间的延长,有效活菌数缓慢下降了1.09 lg(CFU/g)。相反,微胶囊在SIF环境中暴露180 min后,有效活菌数增加了0.11 lg(CFU/g)。由结果可以推测,微胶囊的3种壁材对地衣芽孢杆菌在模拟肠液中的生长有促进作用。Moayyedi等[2]使用乳清分离蛋白+菊粉包埋乳酸杆菌,在冻干条件下制备的微胶囊在肠液中孵育120 min后,相对游离菌存活率明显较高。
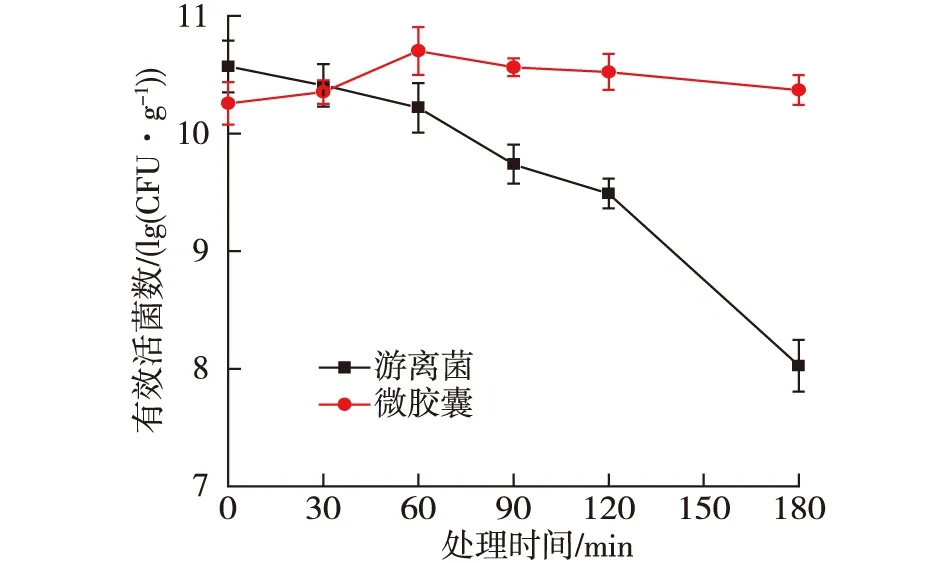
图7 地衣芽孢杆菌CGMCC 6155在SIF 环境中的生存性能Fig.7 Viability of B. licheniformis CGMCC 6155 in SIF
3 结论
在冻干条件下,将益生菌地衣芽孢杆菌CGMCC 6155封装在(结冷胶+β-环糊精+酪朊酸钠)微胶囊中,成功地保护了益生菌免受胃肠液环境的影响。
采用正交试验法得到复合壁材的最佳配比为结冷胶0.3%、β-环糊精4%、酪朊酸钠2%,重复验证试验结果表明微胶囊的包埋率为85.21%。根据壁材用量、反应转速和地衣芽孢杆菌添加量的单因素实验结果进行制备工艺正交试验设计,最终得到最佳制备工艺条件:复合壁材质量分数16%(结冷胶0.3%、β-环糊精4%、酪朊酸钠2%)、转速300 r/min、菌添加量1.0×109CFU/mL。重复验证试验结果表明,通过最佳制备工艺条件得到的微胶囊包埋率为93.25%。
由微胶囊的扫描电镜图像表征可知:混合壁材很好地保护地衣芽孢杆菌CGMCC 6155,混合壁材的结构无破损。微胶囊的含水率为2.48%,贮藏稳定性显著提高。傅里叶变换红外光谱分析证实了由结冷胶、β-环糊精和酪朊酸钠混合制成的复合壁材中形成了氢键。地衣芽孢杆菌微胶囊在模拟胃液暴露180 min后,微胶囊的活菌数平均为6.87 lg(CFU/g),比未包埋的芽孢杆菌高3.14 lg(CFU/g);在模拟肠液环境中暴露180 min后,微胶囊的活菌数平均为10.36 lg(CFU/g),比未包埋的芽孢杆菌高2.34 lg(CFU/g)。本实验为地衣芽孢杆菌微胶囊在胃肠道方面的应用奠定了基础。在今后的研究中,可以进一步考察微胶囊的应用效果,探究其在生物肠道环境中抑制病原菌的作用机制。
