新型冠状病毒快速检测研究进展
2023-01-16王炳熙赵浩东陈金龙
王炳熙,赵浩东,陈金龙
(中国药科大学 药学院,江苏 南京 210009)
新型冠状病毒(SARS-CoV-2)导致的新型冠状病毒肺炎(COVID-19)在2019年12月开始在全球爆发并迅速蔓延,2020年3月11日世界卫生组织(WTO)正式宣布COVID-19疫情已构成全球大流行[1]。截至2021年1月12日,中国确诊患者已累计9万余例,全球确诊已超过8 900万例,死亡人数接近200万,疫情已影响全球220多个国家和地区[1],对全人类的生命健康造成了极大威胁。
SARS-CoV-2与重症急性呼吸综合征冠状病毒(SARS-CoV)及中东呼吸综合征冠状病毒(MERS-CoV)同属β冠状病毒,但SARS-CoV-2更具传染性[2]。SARS-CoV-2在气溶胶、冷冻食物表面仍可存活数小时至数天,因此,可通过呼吸道飞沫、气溶胶、直接或间接接触、粪口传播或者冷链运输等途径,实现物传人、动物传人和人传人,继而在全球范围内广泛传播[3-7]。Guan等[8]研究指出:COVID-19的潜伏期一般为1~14 d,中位潜伏期为3 d,极少数患者的潜伏期最长可达24 d。处于潜伏期的患者通常没有明显的症状,但已具备传染性。COVID-19患者的临床症状主要为发热、咳嗽、乏力、肌痛、腹泻及并发多器官衰竭[9-12]。目前,尚无特效药可用于治疗COVID-19,瑞德西韦、氯喹、羟氯喹、利托那韦/洛匹那韦和干扰素-β等西药已被证实对SARS-CoV-2感染具有一定的疗效[13-14];中医药是我国特有的卫生资源,对COVID-19患者进行早期干预,可有效缓解病情的发展,中西医结合治疗则可达到相辅相成、双管齐下的效果[15]。显然,阻断COVID-19最有潜力的方法是开发疫苗,目前中国的新冠疫苗已上市,并在国内外被推广使用,其安全性和有效性日益得到多国卫生部门和专业人士的认可[16]。此外,值得强调的是,开发准确、快速的COVID-19检测手段在整个疫情防控过程中同样具有重要意义,不仅有利于早发现、早隔离潜在的COVID-19患者,也可用于预后效果的评估。笔者简要介绍SARS-CoV-2的病原学特征,并回顾国内外对COVID-19检测技术的研究与应用进展,以期为COVID-19的早期确诊与防控提供帮助。
1 SARS-CoV-2的病原学特征
SARS-CoV-2是一种有包膜的单股正链RNA病毒,每个SARS-CoV-2粒子直径为60~140 nm,与分别在2002和2012年引起流行病的SARS-CoV和MERS-CoV同属β冠状病毒[2,17]。复旦大学张永振教授及其团队在疫情初期,利用基因测序技术确定了SARS-CoV-2的基因组序列,全长为29 903 bp(GenBank序列号为MN908947)[18]。经基因比对后发现:SARS-CoV-2与SARS-CoV相似度高达79.6%,与MERS-CoV的相似度仅有40%,重要的是,SARS-CoV-2与一种寄生于蝙蝠中的冠状病毒的序列一致性高达96%[19-20]。
与其他冠状病毒相似,SARS-CoV-2主要包括4种结构蛋白,即:刺突蛋白(S)、膜蛋白(M)、包膜蛋白(E)和核衣壳蛋白(N)[21],详见图1。S蛋白与宿主细胞表面的血管紧张素转化酶2(ACE2)结合,以促进膜的融合,其他3种蛋白则在病毒的组装过程中起着关键作用[22]。ACE2在肺部、心脏、肾脏、睾丸、肝脏和脑等器官中分布广泛,其中,肺部是病毒主要的靶器官,因此,COVID-19患者常表现出一些与肺部感染相关的常见症状,例如:发烧、咳嗽、咳痰、疲劳、呼吸急促、喉咙疼痛或头痛。在严重情况下,还会引发肺炎、严重的急性呼吸道综合征、肾衰竭和死亡[9-12]。虽然SARS-CoV-2的致死率不及SARS-CoV,但其对ACE2的结合亲和力明显强于SARS-CoV[23],因此,SARS-CoV-2具有更强的传播性。除了可以根据胸部CT和病毒分离培养的手段确诊COVID-19外,病毒RNA和蛋白质(如S蛋白、N蛋白等)亦可作为对COVID-19检测的靶标[9]。此外,也可以通过患者免疫应答所产生的IgM、IgG等抗体来了解患者的感染史[9]。截至2021年1月12日,国家药品监督管理局共批准用于检测SARS-CoV-2的试剂共54个(表1),主要涉及核酸检测、抗体检测和抗原检测。此外,国内外研究人员为了能更便捷、快速检测SARS-CoV-2,已开发出多种新型生物传感器,但目前这些技术仍处于实验室研究阶段,还未能得到广泛使用。
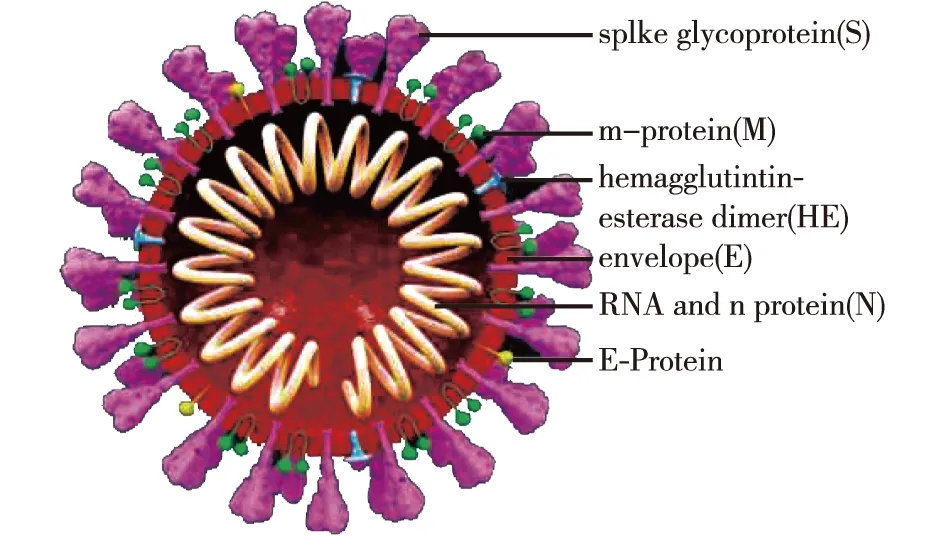
图1 SARS-CoV-2的结构以及COVID-19检测的潜在相关靶向位点[21]Fig.1 The structure of SARS-CoV-2 and related targeting sites that can be used for the COVID-19 detection[21]
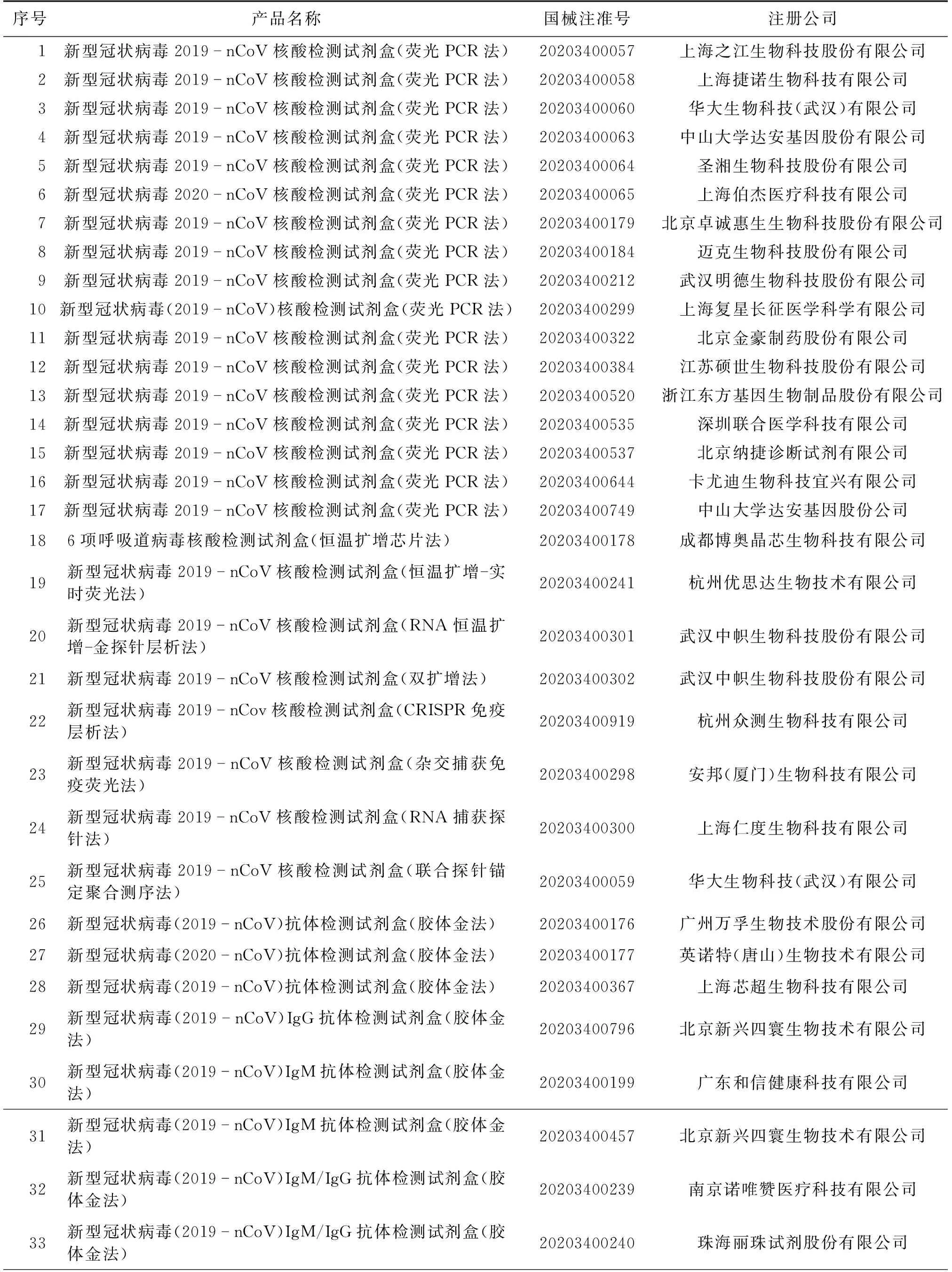
表1 国家药品监督管理局批准的SARS-CoV-2检测试剂注册信息
2 分子生物学检测
2.1 核酸检测
SARS-CoV-2的RNA在患者出现症状前的2~3 d即可被检测到,且根据患者感染的严重程度,可在发病后仍存留25~50 d[24]。因此,以核酸为基础的病毒检测手段在疫情防控中发挥着重要作用,尤其是在无症状患者的确诊和康复患者的出院评判方面。
2.1.1 荧光定量PCR(qRT-PCR)技术
目前qRT-PCR已逐渐成为诊断是否感染SARS-CoV-2的金标准[25]。qRT-PCR是一种基因扩增技术,首先,将目标RNA(在COVID-19检测中为SARS-CoV-2 RNA)逆转录为互补DNA(cDNA),然后设计引物和荧光猝灭探针进行特异性扩增,从而获得有关SARS-CoV-2存在的定量结果[26-27]。该方法具有可靠性好、特异性强、自动化程度高以及能有效解决PCR产物污染问题等特点。目前,由不同制造商开发的17种基于qRT-PCR的COVID-19试剂盒已获得国家药监局的批准,检测靶标涉及ORF1ab、N、E和S等基因[28-29]。Haddar等[30]对用于SARS-CoV-2 RNA检测的几种商业qRT-PCR试剂盒的分析性能进行了评估。研究结果表明:虽然循环数阈(Ct)的差异比较分散,但试剂盒之间的结果相似,符合率达到95%以上,可以满足临床对SARS-CoV-2的常规诊断。
然而,基于qRT-PCR的检测方法同样面临着一些困难,例如:耗时费力的扩增过程、需要特殊的热循环设备以及需要专业的技术人员在特定的实验室内进行操作,这些都限制了该方法在现场筛查和低资源地区的使用[31]。此外,由于SARS-CoV-2 RNA容易变异以及样本采集、保存和运输等多方面因素的干扰,qRT-PCR的检测可能存在较高的假阴性率,检出率仅为30%~50%[32]。因此往往需要重新采集患者的样本,更换采样部位或者收集多个部位的样本进行混样检测或同时检测,从而避免假阴性检测结果的干扰。
2.1.2 等温扩增技术
等温扩增技术是一类在恒温条件下的核酸扩增技术,能有效克服反转录·聚合酶链反应(RT-PCR)所需要的复杂热循环设备方面的不足。笔者主要介绍环介导等温扩增技术(LAMP)、重组酶聚合酶扩增技术(RPA)、恒温扩增芯片和基于CRISPR/Cas酶的检测技术在COVID-19检测中的应用。目前,国家药品监督管理局已批准了5个等温扩增类SARS-CoV-2核酸检测试剂。
2.1.2.1 LAMP
LAMP在2000年由Notomi[33]首次提出,是一种不依赖任何专门的仪器设备,即可实现现场高通量快速检测的技术,其检测成本远低于qRT-PCR,可以在60~65 ℃、15~60 min内实现109~1010倍的恒温核酸扩增。LAMP的最大亮点在于检测结果的可视化。在DNA扩增过程中,大量的焦磷酸从脱氧核糖核酸三磷酸(dNTPs)中被释放出来,与反应液中的Mg2+反应,产生大量的白色焦磷酸镁沉淀,其浑浊程度可作为检测指标,肉眼即能进行判断[34]。Tomita等[35]通过使用一种钙黄绿素荧光复合物,在焦磷酸镁存在的情况下,发出明亮荧光来改善终点检测的效果。此外,扩增过程中溶液的pH也发生了明显变化,因此,也可通过对pH敏感的染料进行可视化检测[36]。通过对76例疑似COVID-19患者的鼻咽拭子样本进行逆转录环介导等温扩增(RT-LAMP)测试,以评估其临床效果,结果表明:该方法的灵敏度与qRT-PCR相当,特异性为97.6%[37]。但开发RT-LAMP技术的挑战在于反应条件(如:时间、温度等)的优化和引物的设计,由于存在病毒引物结合区突变的影响,在设计引物时,需注意避开这些突变位点,以提高检测率[29-38]。成都博奥晶芯生物科技有限公司联合清华大学、四川大学华西医学院将LAMP与微流控芯片技术相结合,设计开发出了一款包括检测SARS-CoV-2在内的“6项呼吸道病毒核酸检测试剂盒”,该试剂盒于2020年3月26日获国家药品监督管理局批准上市,可在1.5 h内对SARS-CoV-2,A、B型流感以及现存的其他病毒进行区分。最近,Lau等[39]在传统的RT-LAMP 4个引物的基础上,再加入2个群体引物,以提高反应效率,以羟基萘酚蓝(HNB)的颜色变化来检测LAMP的扩增产物,该设计将RT-LAMP的反应时间缩短至24 min,检出限仅为1个拷贝数(copy),因此,该技术对低病毒载量感染的检测具有重要意义。
2.1.2.2 RPA
RPA将重组蛋白与DNA聚合酶结合使用,在37~42 ℃恒温范围内,能快速扩增目标DNA或RNA,所需时间少于30 min,且可支持对样品进行多重化的定量分析[40]。RPA试剂以冻干形式保存,便于贮藏和运输,检测过程无需任何仪器,是一种非常有前途,可用于现场诊断的等温核酸检测方法。Amer等[41]已经证明了RPA可被应用于其他冠状病毒的检测,例如牛冠状病毒(BCoV)。目前,已开发出不少基于逆转录重组酶聚合酶常温扩增(RT-RPA)的检测手段,用于快速诊断是否感染SARS-CoV-2。例如Behrmann等[42]在exo探针设计原理的基础上进行改进,提出内部猝灭(exo-IQ)探针原理,消除了exo探针只能用于序列之间2~5 nt内且必须包含2个胸腺嘧啶的限制。所提出的RPA外显子探针是长度至少为46 nt的寡核苷酸,其内部结构由荧光基团和猝灭基团组成,并由一个嘌呤/嘧啶(AP)位点隔开[42]。一旦探针与其靶序列杂交,核酸外切酶Ⅲ(ExoⅢ)的AP核酸内切酶活性就会切割AP位点,从而导致荧光基团和猝灭基团在空间上的分离,使得荧光强度随之增加,荧光强度增加的程度则与RPA产物的量直接相关[42]。该方法的运行时间为15~20 min,对于高病毒浓度的RNA样品,在7 min内即可获得结果,是迄今为止最快速的,基于核酸检测的检测COVID-19的方法之一[42]。
2.1.2.3 基于成簇规律间隔短回文重复序列及其相关蛋白(CRISPR/Cas)系统的检测技术
基于CRISPR/Cas系统的基因检测技术是用于SARS-CoV-2 RNA检测的,另一项先进的分子诊断技术,较为经典的是张锋团队于2017年开发的,基于CRISPR/Cas13a与PRA扩增耦联的SHERLOCK技术[43],该技术已被应用于SARS-CoV-2的检测[44],其原理是:Cas13a在crRNA引导下,识别SARS-CoV-2的S基因和ORF1ab基因后,会被激活出附带的、对非特异性dsRNA酶的切割活性,因此能够切割RNA报告分子,导致荧光基团与猝灭基团分离,并释放出荧光信号[43]。为了能更便捷、直观读取检测结果,该团队将结果呈现形式改进为试纸条式,检测过程无需其他设备,1 h内即可定性判断是否感染病毒[43]。美国食品药品监督管理局(FDA)已对该技术颁布了紧急使用许可。
Chen等[45]研究发现:Cas12酶在crRNA的引导下,与目标序列结合后,同样可被激活出非特异性的切割活性,与Cas13不同的是,Cas12识别的是DNA而不是RNA,因此无需将扩增的DNA产物转录为RNA,该技术被命名为DETECTR。Broughton等[46]重新配置了DETECTR平台,使其适用于SARS-CoV-2的检测,可在40 min内得到检测结果。该团队通过RT-LAMP扩增病毒RNA,然后打开测试管加入CRISPR/Cas12试剂,最后通过将侧流条插入试管中来读取检测结果。然而,将核酸扩增和Cas检测过程分开成2个独立步骤的操作,不仅使测试过程复杂化,还会造成潜在的交叉污染,因此,Chen等[47]将Cas12酶预先置于测试管盖的内壁上,并加入矿物油覆盖RT-LAMP试剂,以防止反应溶液挥发或扩增子扩散,待扩增结束后,通过摇晃的方式使Cas12酶与扩增子反应液充分混合,而不是重新打开测试管添加CRISPR/Cas酶试剂。Ding等[48]则进一步提出了一种多合一双重CRISPR-Cas12a(AIOD-CRISPR)的检测技术,利用2个单独的crRNA生成一对Cas12a-crRNA,该方法的亮点在于:将核酸扩增和对Cas12a酶检测的所需组分全部混合在同一个反应器中,只需在单一温度(37 ℃)中进行孵育(图2)。因此,一个低成本的暖手器也可被用作AIOD-CRISPR分析的孵化器,其检测过程仅为20 min,可检测低至5个copies的病毒N基因RNA[48]。

图2 AIOD-CRISPR分析系统的工作示意[48]Fig.2 Schematic work of the AIOD-CRISPR assay system[48]
该方法已通过测试28个COVID-19临床拭子样本得到验证,与RT-PCR测定的结果相一致。目前,基于CRISPR/Cas系统的核酸检测技术还处于新兴阶段,虽然已开发的方法无法实现定量分析,但其为开发低成本、快速准确的即时诊断方法开辟了未来可能的途径。
2.2 高通量测序(NGS)
NGS又名下一代测序,通过对疑似样本中所有核酸或来自特定靶标的核酸进行测序和分析,从而获得样本中所有病原微生物或其靶标序列[49]。利用该技术可在第一时间获取未知病毒的基因组序列信息,有利于对病毒的鉴定、溯源和诊断,为突发疫情的防控和后续研究提供帮助。在本次疫情初期,除了复旦大学张永振教授联合悉尼大学Edward Holmes教授对患者的支气管肺泡灌洗液(肺分泌物)进行转录组测序,获得了SARS-CoV-2的全基因组序列,并将该测序结果发布于病毒学网站(virological.org),系全球最早公布该病毒序列的团队以外[18];Zhou等[50]、Lu等[51]所在的研究团队也通过宏基因测序和纳米孔靶向测序(NTS)等技术对SARS-CoV-2感染者的全长基因组进行了分析。目前病例确诊方式之一就是:“病毒基因测序,与已知的SARS-CoV-2高度同源”[17]。NGS的优势在于高通量、高灵敏度和高准确性,但其检测成本较高、检测时间较长、需要专业人员对测序结果进行解读,因而不能被广泛应用。针对RT-PCR核酸检测的阴性结果,但临床表型高度疑似的患者,可利用NGS进一步确认[52]。为了提高临床实用性,武汉大学刘天罡教授等组建的联合团队开发出NTS测序平台(MinLON),是目前最小的便捷式测序仪[53]。MinlON可全面覆盖病毒基因组上主要的基因区域,在6~10 h内能同时检测SARS-CoV-2在内的多种常见呼吸道病毒,并监测病毒的突变[53]。
3 免疫学检测
3.1 抗体检测
SARS-CoV-2侵入人体后,人体会产生相应的特异性抗体进行防御[54]。通常情况下,IgM抗体会在机体发生初次免疫应答时产生,而多在症状发作后的3~5 d出现表征,并于2周左右达到峰值。IgM抗体维持时间短、浓度低并且亲和力较低,当其接近消失时,IgG的含量达到高峰。IgG产生时间晚,但维持时间长、浓度和亲和力均显著高于IgM[54-56]。目前将血清抗体的检测作为确诊SARS-CoV-2的依据之一,即将血清SARS-CoV-2特异性IgM和IgG抗体呈阳性;血清SARS-CoV-2特异性IgG抗体由阴性转阳性;恢复期较急性期血清浓度升高至4倍以上作为评判标准[17]。目前,国家药品监督管理局已批准了26个抗体检测试剂盒,检测目标均为IgM/IgG,检测方法主要有酶联免疫吸附测定(ELISA)、胶体金免疫层析法(GIGA)和化学发光免疫分析法(CILA)等。
3.1.1 ELISA
ELISA是一种将抗原-抗体特异性反应和酶对底物高效催化作用相结合的,高敏感性免疫学实验技术[57]。原理是将抗原或抗体结合到某种固相载体表面,与加入的受检样品中的抗原或抗体形成特异性的抗原-抗体复合物,再与之后加入的被酶标记过的抗原或抗体在固相载体上形成三元复合物,最后加入酶,反应底物继而发生显色[58]。利用病毒重组S蛋白、Rp3 N蛋白等作为ELISA包被抗原的方法已被证明具有良好的准确性和选择性[59-60]。通常情况下,ELISA需要通过比色法或分光光度计来进行定性或半定量分析,存在过程繁琐、检测速度慢等方面的不足。近期,Kasetsirikul等[61]提出了一种简单且廉价的,基于比色纸的ELISA检测方法,由于纸基质的高表面体积比,每次仅需几微升的人血清即可完成,将1~2 h的常规ELISA操作时间缩短到30 min以内,可检测到每微升10 ng(0.124 μ/mL)的SARS-CoV-2人源抗体。
3.1.2 GICA
GICA是以胶体金作为示踪标志物,应用于抗原抗体检测的一种免疫标记技术,该方法无需对样品进行特殊处理,仅需一滴血即可在15 min内通过肉眼进行观察,从而获得检测结果[62]。Wang等[63]将胶体金标记的病毒N蛋白和兔IgG抗体固定于结合垫,检测线处同时固定抗人IgM和IgG抗体,质控线处则固定抗兔IgG抗体。10 μL人血清样品从加样处随缓冲液向试纸另一端移动,样品中的待测抗体与结合垫上胶体金标记的N蛋白结合,形成抗原抗体复合物,随后该复合物被检测线上的抗人IgM和IgG抗体捕获而显色[63]。若待测样品中不含待测抗体,则只有质控线处显色,该课题组在上述试剂盒的基础上,将抗IgM和抗IgG抗体分为2条检测线(图3),在一定程度上提升了检测的灵敏度。但由于样本量太小,该方法得到初步结果的灵敏度和特异性可能被高估。
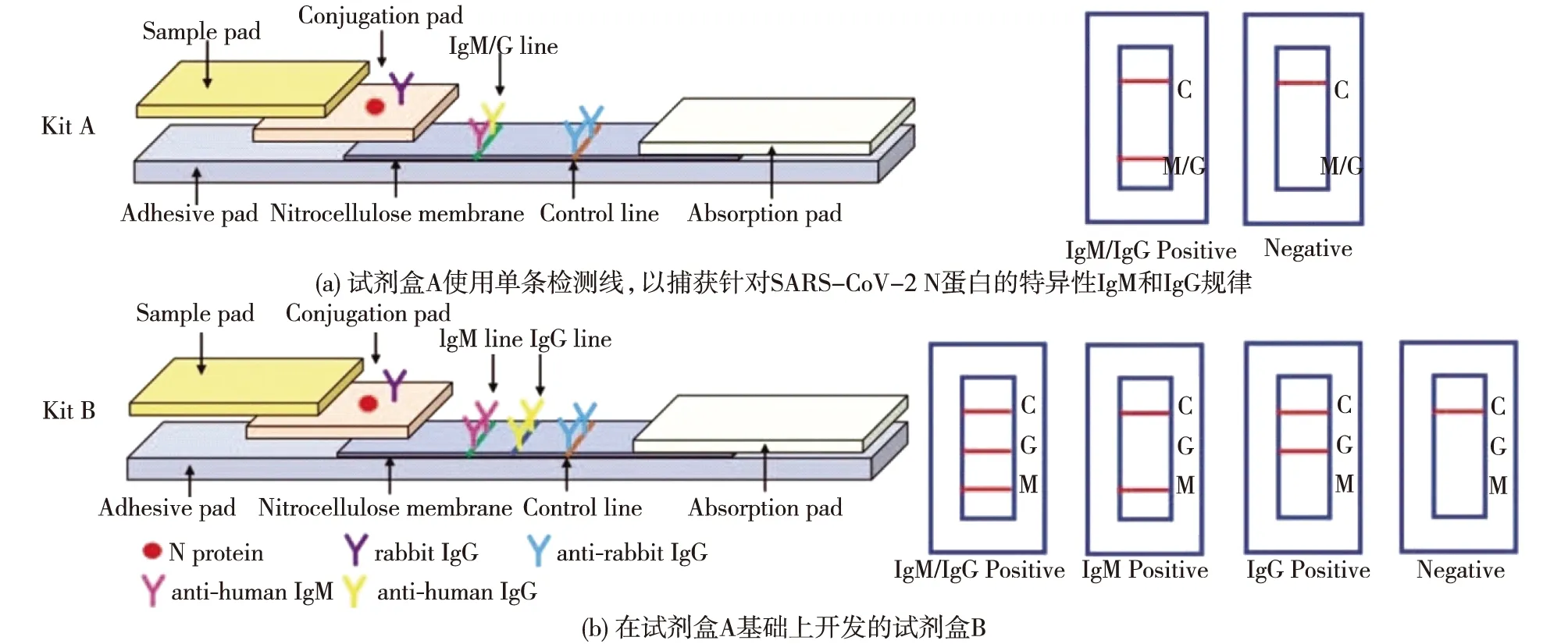
图3 胶体金免疫层析法同时检测IgM/IgG的试剂盒工作示意[63]Fig.3 Schematic work of the detection kit for IgM/IgG by GICA[63]
3.1.3 CILA
CILA是将高灵敏度的化学发光测定技术与高特异性的免疫反应相结合,磁微粒化学发光法则是引入纳米磁微粒作为固定载体,以捕获待测样本中的IgM/IgG抗体[64-65]。这是一种比较先进的免疫检测技术,其自动化程度高,相比ELISA和GICA,CILA具有更高的灵敏度和特异性[66-68],但其需依赖大型仪器设备、成本更高、不适用于大规模的筛查[69]。
与分子生物学检测相比,抗体检测能以较低的成本提供更快的结果,更适合于即时检测。临床评估结果表明:ELISA、GICA和CILA这3种抗体检测手段被应用于COVID-19患者的诊断时,均具有良好的灵敏度和特异性[70-71],但由于SARS-CoV-2进入机体后,需经过一定时间的潜伏期才会产生IgM与IgG抗体,这种滞后性容易导致较差的敏感性,因此,抗体检测并不能替代RT-PCR对COVID-19的早期诊断[71]。此外,抗体检测还存在一些干扰因素,例如:SARS-CoV-2与其他微生物支原体、病毒(尤其是其他冠状病毒)等之间的交叉反应性、用药情况、血液中的非特异性IgM、类风湿因子以及溶血所致的高浓度血红蛋白等[72-75],这些因素均会造成假阳性结果的出现。基于以上原因,抗体检测尚不宜作为判断是否感染COVID-19的唯一依据,其更适合在核酸检测阴性时作为辅助手段,为医生提供重要的免疫学依据或用于评价疫苗的功能和接种效果。
3.2 抗原检测
由于机体产生抗病毒的抗体存在滞后性,抗体检测不能适用于人群筛查和感染初期的诊断,因此,开发用于病毒抗原的检测方法对于遏制疾病大流行具有重要意义。FDA已于美国时间2020年5月11日发布了首个COVID-19抗原检测试剂Sofia 2 SARS Antigen FIA的紧急使用授权(EUA)通知[76]。我国药品监督管理局则于2020年11月3日首次审批通过了2个抗原检测试剂盒,分别为北京金沃夫生物工程科技有限公司开发的新型冠状病毒(2019-nCoV)抗原检测试剂盒(乳胶法)和广州万孚生物技术股份有限公司开发的新型冠状病毒(2019-nCoV)抗原检测试剂盒(胶体金法)[77]。乳胶法的原理是抗体或抗原致敏乳胶微球形成免疫乳胶,与相应的抗原或抗体产生特异性的凝聚反应,以检测响应抗原或抗体的存在[78]。胶体金抗原检测的原理则类似于胶体金抗体检测法,不同之处在于抗原检测是将能够结合待测抗原的抗体分别固定于免疫层析检测试纸条的检测线与结合垫上,其中结合垫上的抗体被胶体金所标记,质控线则固定的是二抗[79]。已有研究人员对国际上已获批的抗原检测试剂盒的测试效果进行了评估[80-81],结果显示:大多数抗原检测试剂盒的效果不如“金标准”qRT-PCR,不建议将其作为是否感染SARS-CoV-2的一线测试试剂,主要原因是抗原检测不能像PCR一样对病毒抗原进行成倍扩增,在病毒载量低的情况下容易出现假阴性结果。而我国刚获批的2种抗原试剂盒的效果还有待更深入的临床评估。
Dai等[82]利用生物信息学和免疫信息学方法,预测了病毒N蛋白的潜在免疫优势区域。基于大多数流感病毒的N蛋白序列与SARS-CoV-2相似性较低,通过直接检测N蛋白可以区分COVID-19和流感病毒感染。此外,考虑到SARS-CoV-2的全长N蛋白可能会与病毒感染患者的血清发生交叉反应[83],选用短的重组蛋白来开发诊断抗体,在保证免疫敏感性的前提下,可以降低交叉反应的发生。Lin等[84]开发了一种微流控集成快速检测分析平台(图4),在15 min内可以同时检测SARS-CoV-2的IgG、IgM和抗原3种生物标志物。该微流控免疫分析平台具有集成且便捷的特点,有望被应用于COVID-19的即时检测。目前,该方法已获得中国医疗器械评估中心(CMDE)的批准和欧洲Conformite Europeenne(CE)的认证[84]。与实际应用中与其他对COVID-19的检测方法相比,抗原检测手段的主要显著性优势在于:无需复杂仪器和专业人员的操作,成本低廉并且可以进行即时检测。一旦研究出有效的抗体,抗原检测容易实现批量生产,因此,抗原检测具有广阔的发展空间和实用价值。
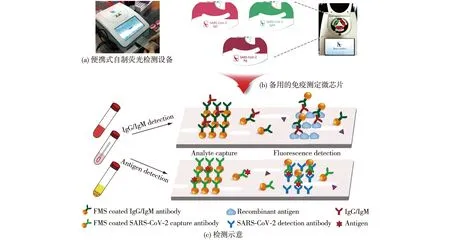
图4 SARS-CoV-2的IgG/IgM/抗原荧光免疫微流控检测平台工作示意[84]Fig.4 Schematic illustration of the microfluidic immunoassays for IgG/IgM/antigen detection of SARS-CoV-2[84]
4 新型生物传感器
4.1 基于局域表面等离子共振(LSPR)的生物传感器
LSPR是一种光现象,当光线的入射光子频率与导电纳米粒子的整体振动频率相匹配时,光谱上会出现一个强共振吸收峰[85]。最近,Moitra等[86]针对SARS-CoV-2的N基因设计了一种特异性巯基修饰的,反义寡核苷酸所覆盖的金纳米颗粒(AuNPs),该AuNPs仅在SARS-CoV-2存在时会发生聚集,并显示出表面等离子共振的变化,核糖酶核酸酶H(RNase H)的添加进一步促进了AuNPs的团聚,在10 min内即可从视觉上观察到沉淀,因此,可由此判断是否感染SARS-CoV-2,其检测限为0.18 ng/mol。
Qiu等[87]将等离子光热效应与LSPR结合,构建了一种双功能等离子生物传感器,互补DNA功能化的二维金纳米岛(AuNIs)。通过核酸杂交对SARS-CoV-2的特定序列进行高灵敏检测。当以等离子共振频率照射时,AuNIs表面产生的等离子热能能提供稳定的热源,以增强SARS-CoV-2与互补DNA的相互作用,从而提高灵敏度和选择性,检测限低至0.22 pmol/L,该生物传感器出色的传感性能允许其在多基因混合物中准确测定出特定的靶标物。
4.2 基于场效应晶体管(FET)的生物传感器
FET的生物传感器因具有免标记、灵敏度高和易于集成等优势,引起了众多研究人员的关注。Seo等[88]开发了一种用抗病毒S蛋白的,具有特异性抗体覆盖的石墨烯FET(图5),当S蛋白与石墨烯表面的抗体结合时,石墨烯FET的电导/电阻可以发生改变,从而能够获得检测结果。该FET设备的检测限因样品而异:磷酸盐缓冲液和临床运输介质中的病毒S蛋白检测质量浓度分别为每毫升1和100 fg时,培养基和鼻咽拭子样本的病毒检测限分别为每毫升1.6×10 PFU和2.42×102copies[88]。该传感平台的优点是样品不需要进行预处理,且具有区分SARS-CoV-2和MERS-CoV抗原的能力。
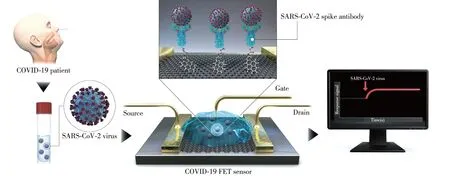
图5 COVID-19 FET传感器操作程序的示意[88]Fig.5 Schematic procedure of COVID-19 FET sensor operation[88]
4.3 基于电化学的生物传感器
电化学生物传感器通过电势、电流、离子浓度、电导率、电容或阻抗的变化程度来反映目标检测物的含量[89]。Fabiani等[90]开发了一种电化学免疫测定法,以磁珠作为固定载体, 碱性磷酸酶作为免疫标记的二抗,使用碳黑纳米材料修饰的丝网印刷电极检测酶促产物1-萘酚,可快速、智能的检测唾液中的病毒S或N蛋白。该方法使用的样品无需进行预处理,S和N蛋白的检测限分别为每毫升19和8 ng,仪器的小型化和便捷性,使其有潜力作为第一个无创且高灵敏进行唾液检测SARS-CoV-2的电化学免疫分析方法[90]。Alafeef等[91]创新性地将金纳米颗粒与石墨烯结合,设计了一种纸基电化学传感芯片。其中,金纳米颗粒用针对病毒N蛋白的特异性硫醇修饰的单链DNA(ssDNA)进行封端,将其沉积于石墨烯导电膜上,以形成传感探针,进一步被固定于基于纸张的电化学平台上,可在5 min内检测样品量低至每毫升6.9 copies,该设备的读数还可通过智能设备实时读取[91]。这一方法的巧妙之处在于设计了4种可同时靶向于病毒N基因的2个独立区域的ssDNA,具有良好的灵敏度和特异性,能够准确地将COVID-19阳性样品与阴性样品或其他冠状病毒样品进行区分,因此,即使病毒的基因组发生突变,该传感器仍具有可行性。
4.4 基于热致液晶(LCs)的生物传感器
某种能形成液晶的固体经加热转变成为既有双折射性,又有流动性的液晶态,被称为LCs[92]。当LC膜或液滴在其界面上吸附一些分子时,会发生取向性的变化,例如:ssDNA和双链DNA(dsDNA),使负载阳离子表面活性剂的LC产生不同的取向,从而导致不同的光学外观变化(如暗色/亮色的变化)[93-94]。基于该原理,开发出了一种可裸眼检测病毒ssRNA的,基于LC的便捷式诊断套件[92]。研究人员在LC表面覆盖了阳离子表面活性剂DTAB和带负电荷的单链探针核酸ssDNAprobe,此时LC呈倾斜或平行取向,且具有亮色的光学外观[92]。当样本中存在SARS-CoV-2时,病毒ssRNA与ssDNAprobe杂交,使ssDNAprobe与DTAB的静电作用减弱,导致DTAB重新覆盖于LC表面,LC可在20 min内完全恢复为垂直取向并呈现暗色[92]。实验结果显示:30 fM的病毒ssRNA即可触发LC的有序变换,使用3个错配的病毒ssRNA进行实验时,该方法的灵敏度降低了7个数量级,说明该方法对病毒ssRNA表现出良好的选择性。此外,研究人员利用偏光显微镜原理设计组装出的便捷式诊断试剂盒,并开发出基于机器学习的自动化判读手机App,为人们在家中就可以实现快速、可靠的诊断COVID-19提供了一条新思路。
5 总结与展望
SARS-CoV-2的迅速蔓延造成了全球范围内的公共卫生危机,给全球经济带来了巨大影响,对COVID-19的快速、准确诊断是疫情防控的关键环节。目前,qRT-PCR作为COVID-19最常用的确诊方法和指标,可靠性良好、但对设备和操作人员的要求较高、过程相对繁琐且假阴性现象频繁出现。特异性抗体检测则可以有效辅助qRT-PCR,但存在滞后性的特点,不适用于对潜伏期患者的诊断。相比之下,抗原检测更适用于即时检测,但因为不能对病毒进行扩增,其灵敏度和准确性容易受限。最近,国内外研究人员开发出的多种新型的生物传感器,其灵敏度、特异性和便捷性等方面因各有优势,在即时检测中具有很大的潜力。笔者认为对SARS-CoV-2的检测技术需要综合考虑以下几个关键因素:
1)准确性和灵敏度。对人群进行准确筛查是疫情防控的首要步骤,而随着时间推移,SARS-CoV-2基因组可能随时发生变异,因此在开发检测方法时,应做好筛选工作,避开突变位点或者设计多个靶点,以提高检测方法的准确性和灵敏度。
2)检测时间。对病毒的快速检测可以提高筛查的效率,能更快确诊感染患者并及时实施隔离和治疗。
3)检测成本和便捷性。降低检测成本有利于在低资源环境下的疫情防控,开发基于智能手机或视觉化的先进传感器则更适合于居家检测。
4)稳定性。不仅要求检测方法具有稳定性,其所需试剂也应具有稳定性,即方便储存和运输。
5)安全性。开发检测技术的本质目的在于助力疫情防控,要防止在检测过程中样品暴露所造成的潜在传染危害。
相信随着科学技术的不断发展,更多新型、精准且快速的检测技术也将会随之出现,人类终将战胜COVID-19疫情。
