帕金森病患者脑小血管病负荷与临床症状的相关性分析
2023-01-15徐玲佳赖春梅
徐玲佳 赖春梅
帕金森病(parkinson’s disease,PD)与脑小血管病都是年龄相关的慢性疾病,在发病机制上有诸多相似,不少研究发现脑小血管病患者中PD发病风险增加,临床症状更重[1],并有可能是PD认知障碍的独立危险因素[2];脑小血管病是一组影响脑内小动脉、小静脉等微小血管的疾病总称,包括脑白质病变、血管间隙扩大、腔隙性梗死、脑微出血和脑萎缩,会引发患者运动、感觉、认知障碍等各种症状,脑小血管病负荷能评价患者的脑小血管病总体患病情况[3]。既往研究表明,脑小血管病与帕金森样症状相关[4],但目前关于PD患者脑小血管病负荷与其临床症状相关性的研究较少,为进一步明确两者相关性,分析PD患者的脑小血管病负荷及其对临床症状的影响。
1 资料与方法
1.1 临床资料 回顾性分析2018年1月至2021年10月本院96例PD患者的临床资料,男、女各48例,年龄46~82岁。纳入标准:①年龄≥18岁;②符合国际运动障碍协会发布的帕金森病临床诊断标准[5]。排除标准:①继发性帕金森综合征、帕金森叠加综合征等或其他神经退行性疾病;②既往有脑卒中病史;③合并恶性肿瘤或其他严重内外科疾病。
1.2 方法 (1)基本特征:收集所有患者的年龄、性别、起病年龄、病程、使用药物情况、吸烟史、饮酒史、高血压、冠心病情况,其中药物使用情况记录为左旋多巴等效剂量(levodopa equivalent dose,LED),计算方法如下:LED=左旋多巴标准片×1+左旋多巴控释片×0.75+(左旋多巴标准片×1+左旋多巴控释片×0.75)×0.33(同时服用恩他卡朋)+盐酸普拉克索片×100+吡贝地尔缓释片×1+金刚烷胺×1+盐酸司来吉兰片×10+雷沙吉兰×100(单位:mg)[6];(2)脑小血管病负荷赋分方法[3]:出现 1个或多个腔隙性脑梗死,记1分;根据Fazekas量表评定方法侧脑室旁白质高信号3分或脑深部白质高信号≥ 2分记1分;血管周围间隙的数量10个以上记1分;存在1个或多个深部脑微出血记1分;评分总分0~3分为低负荷、4分为高负荷;根据患者头颅磁共振检查结果,由2名神经内科医师进行赋分确认。
1.3 观察指标 (1)一般情况:记录患者Hoehn-Yahr(H-Y)分级;(2)运动症状:主要为国际运动障碍协会统一帕金森病评定量表(MDS-UPDRS)[7]中第II部分(日常生活运动症状)和第III部分评分(运动功能检查),其中MDS-UPDRS-III部分又划分为震颤,僵硬,运动迟缓,姿势不稳四部分,对两组患者运动症状进行进一步分析;(3)非运动症状:评定患者MDSUPDRS中的第I部分,及汉密尔顿焦虑量表(HAMA)、汉密尔顿抑郁量表(HAMD)评分[8];(4)认知功能:应用简易智力状态检查(MMSE)对患者进行评估,总分为30分,其中定向力10分,记忆力3分,注意力和计算力5分,回忆能力3分,语言能力9分;总分≤27分为认知功能障碍;痴呆诊断结合患者学历,文盲为≤17分,小学≤20分,中学及以上为≤24分[9]。
1.4 统计学方法 采用SPSS 20.0统计软件。计量资料以(±s)表示,组间比较采用t检验,计数资料以n(%)表示,组间比较采用χ2检验。多因素分析采用Logistic回归分析。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料比较 96例PD患者中,脑小血管病负荷≥4分为PD-高负荷组46例,0~3分为PD-低负荷组50例,两组H-Y分级比较差异有统计学意义(P<0.05),见表1。
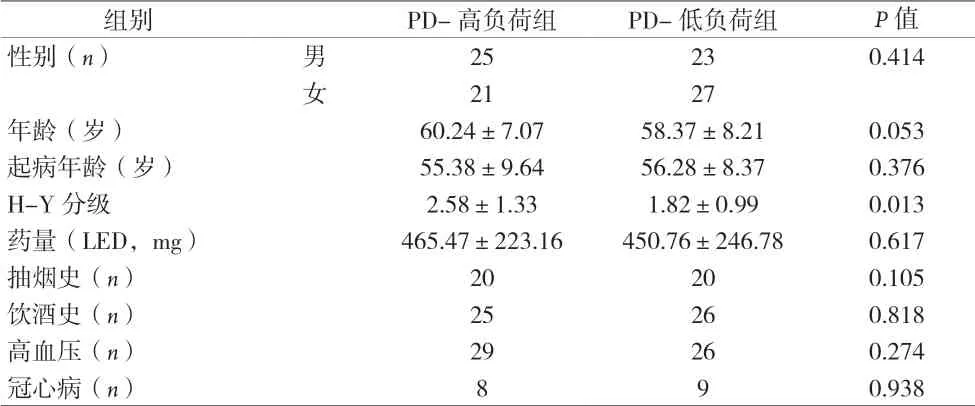
表1 两组患者一般资料比较
2.2 PD患者脑小血管病负荷与临床症状的相关性 PD-高负荷组患者与PD-低负荷组患者相比,MDS-UPDRS-III部分评分分数更高(P<0.05),进一步分析发现,PD-高负荷组患者的姿势不稳分数更高(P<0.05),PD-高负荷组认知功能障碍更多见(P<0.05),尤其在记忆力、注意力和计算力这两方面得分更低(P<0.05),见表2。

表2 两组患者临床症状分析
2.3 PD患者认知障碍与脑小血管病变的多因素分析 脑白质病变是PD患者认知功能障碍的危险因素(P<0.05)。见表3。
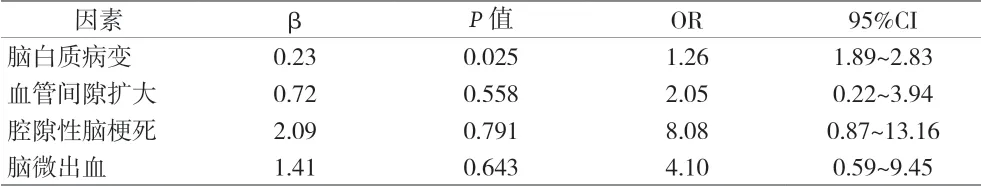
表3 PD患者认知功能障碍的多因素分析
3 讨论
PD是一种常见的神经退行性疾病,其病程发展缓慢,然而,目前尚无早期诊断及治愈方法。黑质纹状体多巴胺能神经元细胞丢失和α突触核蛋白以路易小体及路易神经突起的形式在神经元内广泛聚集是帕金森病的神经病理学标志,此外,PD的发病还与皮质、皮质下及边缘系统等脑内各环路相关,临床特征主要为运动迟缓、静止性震颤、肌张力障碍和姿势步态异常及抑郁、睡眠障碍、认知功能障碍等一系列非运动症状。脑小血管病,以磁共振图像上的脑白质高信号、腔隙性脑梗死、脑微出血、血管周围间隙及脑萎缩为特征,也可导致步态功能障碍、认知障碍等神经精神疾患,而利用脑小血管病负荷,能反映全脑小血管病的总体患病情况,更精确评估全脑小血管损伤情况。目前较多研究表明PD与脑小血管病之间具有相关性,脑小血管病可能是PD的危险因素,而PD也可能加剧脑小血管病变,两者共享多条发病机制。本研究显示,脑小血管病变高负荷的PD患者,H-Y分级更重,UPDRS评分中的III运动评分更高,其中姿势不稳更突出,且认知功能障碍多见,尤其是在记忆力、注意力和计算力方面更突出。
CHEN等[10]研究认为,合并脑小血管病会加重PD患者症状,腔隙性梗死灶与PD患者运动症状相关,位于基底节区的腔隙灶可能通过破坏相关脑网络连接而影响PD患者的步态和姿势功能,基底节腔隙灶的数量与患者的步态障碍具有明显的相关性,促进神经血管健康可能改善PD患者的步态及姿势不稳;KIM等研究发现脑微出血与PD患者的认知功能相关,且PD患者脑微出血患病率高于对照组,尤其在PD步态障碍患者中[11];也有研究发现PD合并抑郁与脑白质疏松症相关,PD病程中,广泛的皮质下白质纤维破坏会影响前额叶系统及边缘系统的各个脑区功能,从而影响PD患者的精神活动和情绪调节功能,导致抑郁[12],与本研究结果具有一致性。
PD患者脑小血管病负荷与其临床症状具有相关性,其机制可能有以下几方面:(1)不同部位的神经连接功能障碍:PD的发病机制主要是黑质纹状体多巴胺系统功能障碍,位于中脑黑质-纹状体通路中的脑小血管病变会破坏患者的皮质、基底节、纹状体功能从而加重PD患者的运动症状,另一方面,位于额叶-纹状体及中脑-边缘系统的病变则可能通过影响皮质下环路及边缘系统而引发或加重PD患者的非运动症状[13]。(2)氧化应激及神经炎症反应:脑小血管病与PD发病机制均与氧化应激及神经炎症相关,脑小血管病的氧化应激加重活性氧生成增加,及线粒体、溶酶体功能障碍,相关自噬反应减弱,都会加重神经炎性反应,导致PD患者病情加重[14]。(3)神经递质功能障碍:脑小血管病的病变基础主要是脑微小血管基底膜僵硬及神经血管单元受损、神经胶质细胞重构,从而引起脑内血流受损,脑血流灌注不足,导致多巴胺、五羟色胺、肾上腺素、乙酰胆碱能等多个神经递质系统功能障碍[12]。(4)内环境紊乱:脑小血管病与多种血管危险因素相关,如糖代谢紊乱、血脂代谢异常、高血压等,其本身可引起一系列慢性炎症反应,增加患者体内白介素、肿瘤坏死因子等多种炎症因子从而破坏患者体内内环境的平衡,加重多巴胺能神经元的破坏[15]。通过对两者共同机制的分析,控制血管危险因素可能有助于控制PD病情的进展,脑小血管病患病情况可成为PD早期诊断及新药探索的靶点:如改善氧化应激,抑制神经炎症,增加脑血流灌注,增强脑神经营养等。
综上所述,PD患者的脑小血管病负荷与其临床症状具有一定相关性,脑白质病变是PD认知障碍的危险因素,脑小血管病负荷情况可能是PD发病机制及诊断、治疗的新靶点。
