S14G-humanin 对氧糖剥夺/复氧神经细胞损伤的保护作用
2023-01-15张晓莹高广生
孙 丽 张晓莹 高广生,3
1 山东第一医科大学附属中心医院重症医学科,济南,250013,中国
2 山东省泰安市中心医院住院准备中心,泰安,271000,中国
3 山东省泰安市中心医院重症医学科,泰安,271000,中国
脑梗死是由于脑血液供应异常导致的严重危及生命的疾病。由于该病具有较高的发病率和死亡率,是导致人类死亡和致残的主要原因,但除了超早期溶栓以外,目前仍然没有有效的方法预防和治疗这种疾病。虽然迅速恢复血液供应可以使神经细胞重新恢复其生理功能,但是再灌注仍然引起了其他的一系列严重问题,如氧化应激、炎症反应、线粒体功能障碍和离子失衡等[1],大大降低了血液恢复的有利作用,导致了更严重的病理状态,且与脑卒中损伤的程度直接相关。因此,抑制缺血再灌注带来的一系列不良后果,对于脑梗死的治疗仍然是至关重要的。
S14G-Humanin(HNG)是Humanin(HN)衍生物,HN 抑制β淀粉样蛋白(amyloid-beta protein,Aβ)诱导的STAT3 低表达,降低caspase-3 的表达,从而抑制Aβ对大鼠的损伤,具有神经保护作用[2]。给予HN 预处理可以降低心律失常发生率,改善心功能,减少心梗面积,以及改善心肌线粒体功能,减轻缺血再灌注诱导的心肌损伤[3]。本课题组前期研究[4]已证实HNG 抑制缺血再灌注造成的神经损伤,具有神经保护作用,其机制可能与激活JAK2-STAT3 通路有关。在这项研究中,我们采用SHSY5Y 细胞氧糖剥夺/复氧(oxygen glucose deprivation/reoxygenation,OGD/R)的方法作为体外缺血/再灌注模型,进一步明确HNG 神经保护作用的分子机制。
1 材料和方法
1.1 实验材料与仪器
1.1.1 细胞与试剂
SH-SY5Y 细胞,购于美国ATCC 公司(Type Culture Collection(ATCC;Manassas,VA,USA);[甘氨酸14]-人蛋白G 抗体(S14G-Humanin),购自美国Sigma 公司;FITC Annexin V 凋亡检测试剂盒,购自美国BD Biosciences 公司;JAK 抑制剂FLLL32(S7259)、PI3K 抑制剂LY294002(S1105)及AKT 抑制剂MK-2206 2HCl(S1078),均购自美国Selleck 公司;SOD 活性检测试剂盒,购自南京凯基生物科技发展有限公司;CCK-8 细胞增值及毒性检测试剂盒,购自上海Beyotime 公司;丙二醛(malondialdehyde,MDA)检测试剂盒(S0131),购自上海碧云天生物技术有限公司;羊抗蛋白酪氨酸激酶JAK2 抗体、兔抗磷酸化信号转导与转录活化因子3 抗体(S727)、兔抗细胞色素C 抗体、辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗鼠IgG,均购自美国Abcam 公司;兔抗磷酸化信号转导与转录活化因子3 抗体(Tyr705),购自美国Cell Signaling Technology 公司;兔抗BCL2-相关X 蛋白抗体(N-20)、beta-Actin 内参抗体,购自美国Santa Cruz 公司;半胱氨酸天冬酶3(Caspase 3),购自武汉Proteintech 公司。
1.1.2 仪器
流式细胞仪,美国Becton Dickinson 公司;Mini-PROTEAN Tetra System,美国Bio-Rad 公司;Mini Trans-Blot Cell,美国Bio-Rad Laboratories 公司;Synergy HT酶标仪,美国BioTek Instruments 公司;二氧化碳细胞培养箱、三气培养箱,美国Thermo Fisher 公司。
1.2 实验方法
1.2.1 细胞培养
将SH-SY5Y 细胞培养于DMEM 培养液中,培养液含10%胎牛血清、100 U·mL-1青霉素和链霉素。细胞在5%二氧化碳培养箱中37℃常规细胞培养方法孵育,每两天换液一次。
1.2.2 氧糖剥夺模型制备及干预
当细胞爬满70%~80% 培养皿时,对细胞进行OGD/R 实验,并给予HNG 干预治疗。OGD/R 详细步骤:将细胞弃去培养液,更换为无血清无糖Earles 平衡盐溶液,其组成为(NaCl 143.0 mmol·L-1,KCl 5.4 mmol·L-1,CaCl21.8 mmol·L-1,MgSO41.0 mmol·L-1,NaH2PO41.0 mmol·L-1,HEPES 2.4 mmol·L-1,pH 7.4),立 即移至三气培养箱中,培养箱中持续充入缺氧混合气体,维持培养箱内0.5%氧浓度,在剥夺葡萄糖和血清的培养液中培养16 h。然后将细胞保持在常氧条件下(复氧)正常培养液中继续培养9 h。FLLL32、LY294002和MK-2206 2HCl 分别是STAT3、磷脂酰肌醇3 激酶(phosphatidylinositol 3-kinase,PI3K)和丝氨酸/苏氨酸蛋白激酶(serine-threonine kinase,AKT)抑制剂。这些抑制剂被添加到细胞实验中干预治疗。
1.2.3 细胞活性检测
SH-SY5Y 细胞活性测定采用CCK-8 细胞计数试剂盒,所有操作均按试剂盒说明书进行。用Synergy HT 酶标仪在450 nm 测定吸光度。
1.2.4 细胞凋亡率分析
用FITC Annexin V 凋亡检测试剂盒检测SH-SY5Y细胞的凋亡率,所有操作均按试剂盒说明书进行。细胞凋亡的程度应用双激光流式细胞仪和ModFit LT 软件分析。
1.2.5 免疫印迹分析(Western Blot)
选择生长状态良好的细胞,氧糖剥脱及药物干预后提取总蛋白,倒掉培养基,PBS 冲洗,加入RIPA裂解液及蛋白酶抑制剂PMSF 混合液,冰上静置2~ 10 min,刮板刮取细胞,4 ℃离心机离心:12 000 r,15 min,取上清至新EP 管,BCA 方法测总蛋白浓度,按照20 μg 蛋白上样量计算上样体积。10% SDS 聚丙烯酰胺凝胶分离,转移到PVDF 膜。然后用一抗标记蛋白JAK2(稀释浓度1∶1 000)、phospho(p)-STAT3(Y705)(稀释浓 度1∶1 000)、p-STAT3(S727)(稀释浓度1∶500),4℃于摇床上孵育过夜。洗膜后,加入5%脱脂奶粉封闭液稀释(稀释浓度1∶2 000)的二抗,置于37℃恒温箱中,脱色摇床上孵育1 h。洗膜后每条膜加入适量的发光底物试剂,以浸润膜条为宜,尽快行化学发光,图像分析。
1.3 统计学方法
所有数值均为重复三遍实验数据。所有的数值以均数±标准差表示。应用SPSS Statistics Version 26统计学软件分析,两均数比较采用t检验,多均数比较采用方差分析one-way ANOVA。P<0.05 表示统计学差异具有显著性。
2 结果
2.1 OGD/R 导致SH-SY5Y 细胞存活率降低,凋亡率增加
细胞活性检测表明OGD/R 导致SH-SY5Y 细胞存活率显著降低,与对照组相比差异有统计学意义(P<0.01,Fig.1A)。OGD/R 也导致SH-SY5Y 细胞凋亡率显著增加,与对照组相比差异有统计学意义(P<0.01,Fig.1B~D)。
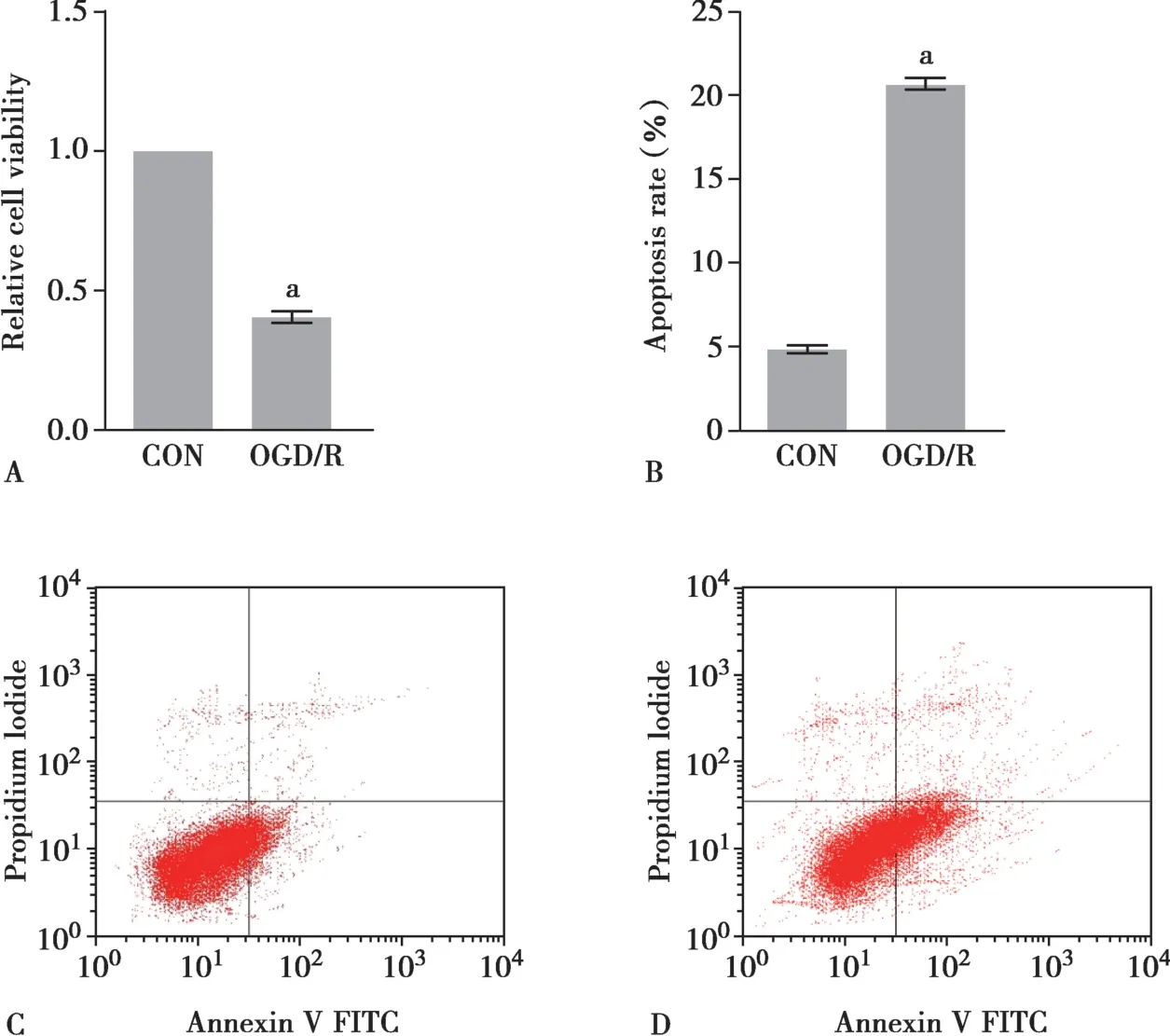
Fig.1 Results of SH-SY5Y cell viability and apoptosis rate following OGD/R treatments
2.2 HNG 神经保护和抗凋亡作用
给予不同剂量的HNG(0.1~10 μg·L-1)干预,可不同程度上抑制OGD/R 引起的细胞活性降低。给予0.1、1、5、10 μg·L-1HNG 干预的SH-SY5Y 细胞与未行HNG 干预的OGD/R 细胞相比,细胞存活率更高,差异有统计学意义(P<0.01,Fig.2A),其中1 μg·L-1HNG 干预组细胞存活率最高。给予0.1、1、5、10 μg·L-1HNG干预的细胞凋亡明显减少(P<0.01,Fig.2B~H)。与不应用HNG 组相比,1 μg·L-1HNG 使细胞凋亡率下降最明显。这些数据表明HNG 增加OGD/R 处理神经细胞的存活率,降低细胞凋亡率,具有神经保护和抗凋亡作用。
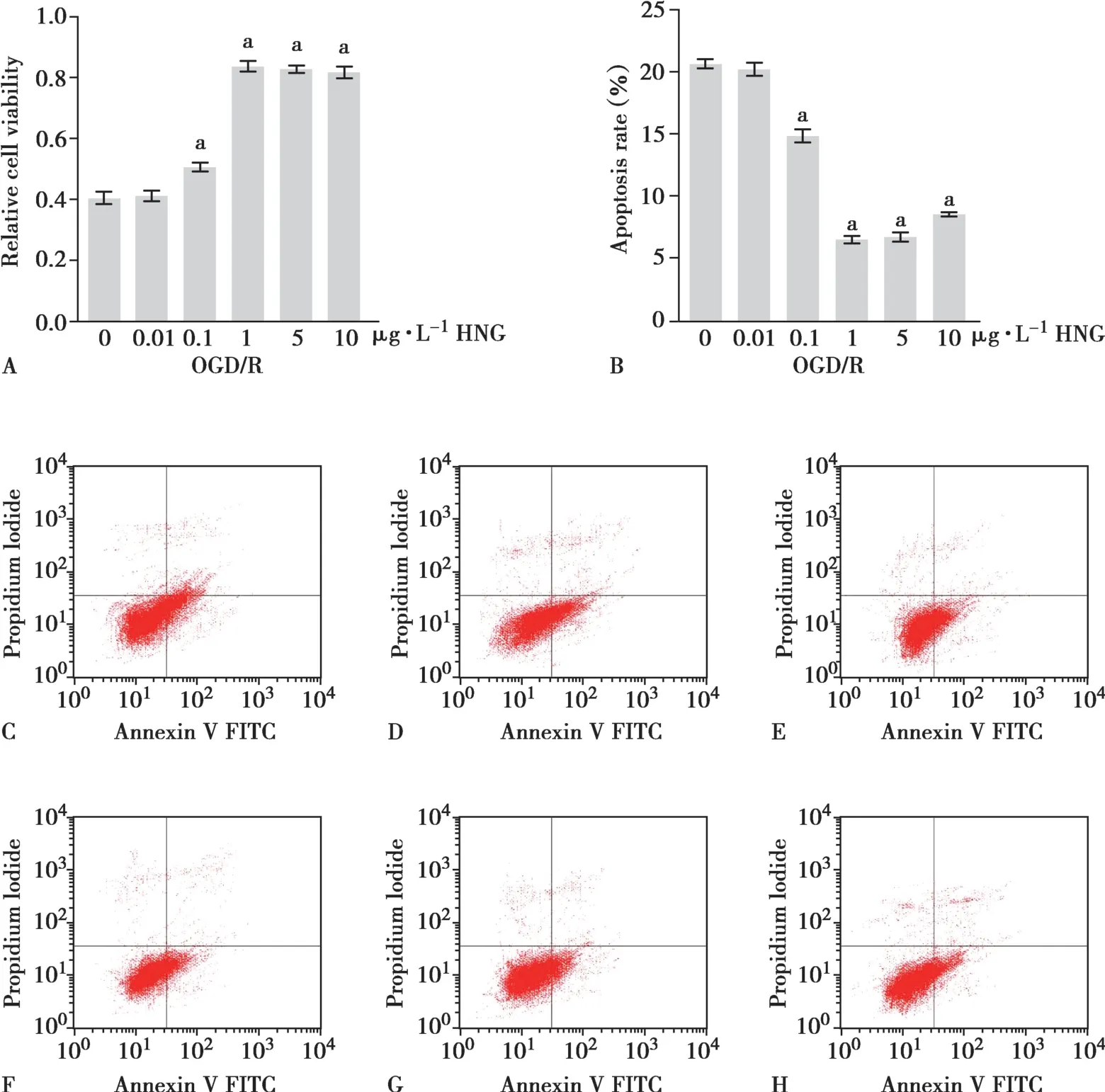
Fig.2 Results of cell viability and apoptosis rate following OGD/R treatments,while adding doses of HNG(0.01~10 μg·L-1)to the SH-SY5Y cells
2.3 HNG 激活OGD/R 抑制的JAK2/STAT3 信号通路
研究检测了OGD/R 处理后SH-SY5Y 细胞JAK2和p-STAT3 蛋白表达水平。如Fig.3 所示,与正常对照组比较,OGD/R 处理后明显降低了JAK2 蛋白表达(P<0.01,Fig.3B),降低了p-STAT3(Y705)蛋白表达(P<0.01,Fig.3C),但未明显降低p-STAT3(S727)蛋白表达(P>0.05,Fig.3D)。给予0.1 μg·L-1HNG 干预的细胞表达JAK2(P<0.01,Fig.3B)和p-STAT3(Y705)(P<0.01,Fig.3B)蛋白增加。给予1 和5 μg·L-1HNG干预的细胞JAK2(P<0.01,Fig.3B)、p-STAT3(Y705)(P<0.01,Fig.3C)和p-STAT3(S727)(P<0.01,Fig.3D)蛋白表达增加更显著。而给予10 μg·L-1的HNG 干预也提高了细胞JAK2(P<0.01,Fig.3B)蛋白表达,但是未能提高p-STAT3(Y705)(P>0.05,Fig.3C)和p-STAT3(S727)(P>0.05,Fig.3D)蛋白表达。

Fig.3 Protein expression levels of JAK2,p-STAT3(Y705)and p-STAT3(S727)were detected using Western Blot following the OGD/R treatments,while adding doses of HNG(0.01~10 μg·L-1)to the SH-SY5Y cells
2.4 JAK2/STAT3 信号介导HNG 神经保护作用
为确定是否JAK2/STAT3 信号介导了HNG 对OGD/R 处理后细胞的神经保护功能,我们应用了该通路的特异性抑制剂(FLLL32),与HNG 一起加入培养液中。细胞活性检测表明,1 μg·L-1HNG 增加了因OGD/R 损害的细胞存活率(P<0.01,Fig.4A),而 1 μg·L-1HNG 和5 μmol·L-1FLLL 32 联合应用却无法增加因OGD/R 损害的细胞存活率(P>0.05,Fig.4A)。给予1 μg·L-1HNG 干预能有效抑制OGD/R 模型处理后导致的细胞凋亡率增加(P<0.01,Fig.4B),但是联合给予5 μmol·L-1FLLL 32 则抵消了HNG 的应用对细胞凋亡的抑制作用(P>0.05,Fig.4B)。免疫印迹分析检测数据表明,OGD/R 处理可以减少JAK2、p-STAT3(Y705)、p-STAT3(S727)蛋白表达(P<0.01,Fig.4D,E,F),但给予1 μg·L-1HNG 干预可以抑制OGD/R 处理后所诱发的JAK2、p-STAT3(Y705)、p-STAT3(S727)蛋白表达量的减少(P<0.01,Fig.4D、E、F)。但这种抑制作用在联合给予1 μg·L-1HNG 和5 μmol·L-1FLLL 32干预细胞中没有观察到。以上这些数据表明HNG 通过激活JAK2/STAT3 信号通路有效抑制OGD/R 诱导的细胞凋亡。
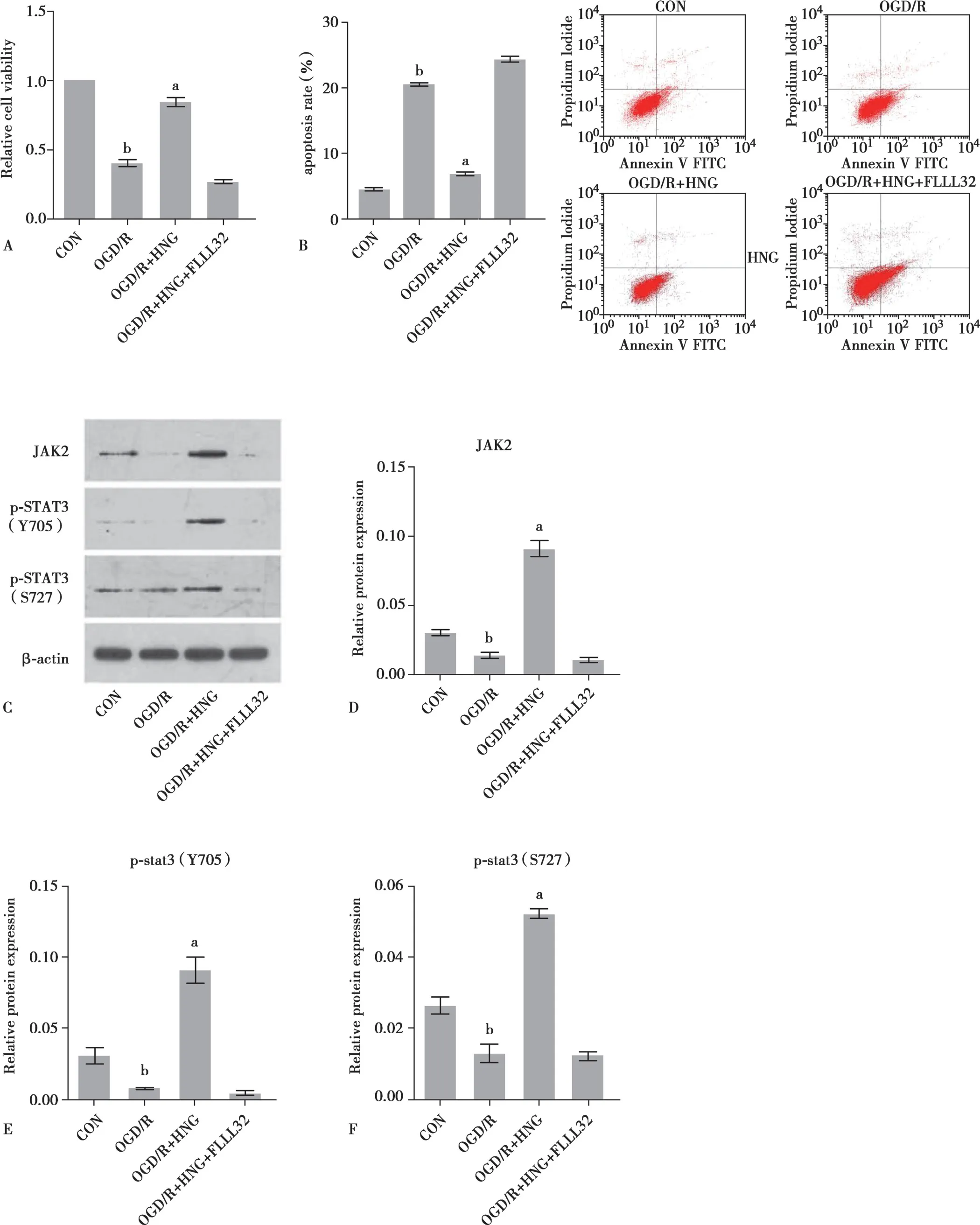
Fig.4 Results of cell viability,apoptosis rate and protein expression following OGD/R treatments,while adding 1 μg·L-1 HNG alone or 1 μg·L-1 HNG and 5 μmol·L-1 FLLL32 in combination to the SH-SY5Y cells
3 讨论
脑梗死以其发病率、致残率、病死率、复发率均高的特点给家庭和社会带来沉重的负担,且近年来有年轻化的趋势[5]。脑梗死发生后,缺血缺氧会造成神经细胞坏死、变性,从而导致神经功能损伤,及早恢复缺血区的血液供应是治疗缺血性脑卒中的关键。目前临床上用于脑梗死的有效治疗方法以溶栓为主,溶栓治疗是指静脉注射组织纤溶酶原激活剂[6],溶解新鲜血栓,使缺血脑组织恢复血液灌注,但由于治疗时间窗狭窄,恢复血流灌注后可能带来再灌注损伤及脑保护治疗的滞后,进一步加重脑功能障碍和神经细胞的损伤[7],这一病理生理变化就是脑缺血再灌注损伤。脑缺血再灌注损伤最基本的病理生理学特征是神经元死亡[8],同时,脑缺血再灌注损伤直接影响缺血性脑血管病的预后转归,如何有效地减轻缺血再灌注所造成的神经损伤一直是脑缺血临床治疗的首要问题。目前脑缺血再灌注损伤的机制尚未完全清楚。因此,深入研究脑缺血再灌注损伤的病理生理学机制,寻找有效的治疗药物,抑制缺血再灌注损伤造成的神经细胞死亡,对于改善缺血再灌注损伤的预后具有重要的理论意义和应用价值。
凋亡是缺血再灌注损伤神经细胞死亡的重要方式[9],细胞凋亡与坏死的区别仍然主要依靠形态学标准,细胞坏死是偏离正常的生理机能,开始于ATP 的耗竭和细胞膜通透性损伤,然后出现核固缩和细胞器结构完整性的破坏,产生的细胞内碎片的释放伴随着炎症反应。与之相反,细胞凋亡是有序的基因表达和蛋白质活性的改变,从染色质浓缩和核仁解体开始,然后死亡的细胞被分裂形成所谓的凋亡小体,细胞碎片被附近的固有细胞吞噬,通常不产生急性炎症反应。细胞正常的生长发育是由于凋亡诱导因素和抑制凋亡因素的神经元存活信号转导通路相互平衡、共同作用的结果,若某些因素影响神经元存活信号,则触发了促凋亡级联反应,引起细胞的程序化死亡,甚至发生细胞凋亡。SH-SY5Y 细胞广泛用来研究与细胞凋亡相关的细胞信号转导通路,从而揭示神经退行性疾病、缺血性脑卒中的发病机制。
本研究通过建立体外OGD/R 诱导SH-SY5Y 细胞凋亡模型模拟体内脑缺血再灌注损伤,发现OGD/R 处理后SH-SY5Y 细胞凋亡率显著增加,细胞活性减少。神经元是中枢神经系统的核心组成部分,是形成神经功能的基础,神经元死亡,尤其是海马和大脑皮质部位的神经元,是脑梗死高致残率和高死亡率的主要原因。因此,治疗急性脑缺血再灌注损伤的重要策略是抑制神经元的死亡。
HN 是2001 年由日本学者Hashimoto 在阿尔茨海默病(Alzheimer’s disease,AD)患者大脑枕叶皮层未受损脑区发现的[10]。HN 存在于许多组织,包括睾丸、结肠、下丘脑、心脏、肝脏、骨骼肌、肾脏和血管壁[11]。最初研究显示HN 及其衍生物能有效抑制多种AD 相关致病因子(如FAD 基因突变、APP 抗体、Aβ等)诱发的神经细胞和非神经细胞的死亡,改善AD 小鼠的学习及记忆能力,被认为是未来用于治疗AD 最有希望的药物[12]。近几年研究发现HN 有着更广泛的作用,已有大量报道HN 在病理和生理状态下都有抗凋亡作用,如缺血引起的各种类型的细胞死亡[13],氧化低密度脂蛋白相关的血管内皮细胞死亡[14],以及精子发生中睾丸间质细胞死亡[15],然而,随着年龄增长,HN 的生理血浆水平明显降低,这可能导致HN 在老年性疾病的抗凋亡过程中作用有限,如脑梗死。HNG 是人工合成物,第14 位的Ser 被Gly 取代后形成的HN 衍生物,具有1 000 倍的HN 生物活性,是HN 的重要衍生物[16],本课题组既往研究证实HNG 对缺血再灌注大鼠海马CA1 区神经元有保护作用[17],但目前还不清楚HNG 是否能够保护OGD/R 后神经元死亡。在本研究中,我们首先提供证据表明HNG 是OGD/R 后细胞凋亡的有效抑制剂,1 μg·L-1HNG 可使氧糖剥夺诱导的神经细胞凋亡率下降60%。这表明HNG 可能通过预防神经元凋亡减轻脑卒中损害,是一种很有临床应用前景的药物。
JAK2、STAT3 蛋白参与发育过程,支持和修复成熟期神经细胞损伤,在中枢神经系统内广泛表达,包括海马、齿状回、红核、小脑及皮层等。在正常成人脑中,JAK2-STAT3 通路通常是不激活的,脑缺血性损伤后具有神经保护作用的神经营养因子和细胞因子通过激活JAK2-STAT3 通路诱导保护性基因表达促进神经细胞存活。本研究应用JAK2/STAT3 抑制剂证实JAK2/STAT3 通路在HNG 抑制OGD/R 神经损伤中起重要作用。本研究观察到暴露于OGD/R 的神经元JAK2 和p-STAT3 表达水平降低,提示JAK2/STAT3 信号通路减弱。而给予HNG 干预后,HNG 通过提高信号蛋白或磷酸化蛋白的水平激活JAK2/STAT3 信号,从而起到神经保护的作用。研究表明,HN 作用于GP130/IL6ST受体复合物后,AKT 和STAT3 磷酸化水平增加[18]。活化的AKT 和STAT3参与HN 在多种老年疾病中细胞保护和神经保护机制[19]。本研究给予JAK2/STAT3 信号抑制剂FLLL32 则抵消了HNG 对细胞凋亡的抑制作用,进一步证实HNG 通过激活JAK2/STAT3 信号通路实现其神经保护作用。
总之,本研究证实HNG 通过激活JAK2/STAT3 信号通路抑制OGD/R 诱导的细胞凋亡,具有神经保护作用,为HNG 用于脑梗死的治疗提供了理论基础。
