基于网络药理学和实验验证探讨黄芪散治疗阿尔茨海默病的作用机制
2023-01-14张运辉杨梦琳周小青伍大华
张运辉,杨梦琳*,周小青,伍大华,3,刘 霞,李 祥
1重庆三峡医药高等专科学校,重庆 404120;2湖南中医药大学,长沙 410208;3湖南省中医药研究院附属医院,长沙 410006
阿尔茨海默病(Alzheimer′s disease,AD)是一种以进行性认知功能障碍和精神行为损害为主要表现的中枢神经变性病。随着人口老龄化的进程加快,我国AD的发病率逐年升高,严重威胁中老年人的健康,给社会、家庭造成了沉重的负担。目前美国FDA批准上市的抗AD药物主要是N-甲基-D-天门冬氨酸(N-methyl-D-aspartate,NMDA)受体阻滞剂和乙酰胆碱酯酶(acetylcholinesterase,AchE)抑制剂,虽可适度改善患者的症状,但仍不能根治、逆转AD的发展。中药复方具有多成分、多靶点、多途径的协同作用特点,在改善AD患者认知功能、提高日常生活能力与生活质量方面具有显著的疗效,且毒副作用小,长期服用不易耐药[1]。
有学者将AD称为脑内的3型“糖尿病”并指出AD的核心可能是由于脑胰岛素和胰岛素样生长因子信号传导通路障碍所引起的[2]。研究证实,糖尿病是AD的一个非常重要的高危因素,糖尿病患者并发AD的风险也非常高,且有不少AD患者同时合并糖尿病[3],这极大增加了患者的痛苦,并给临床治疗带来更大的难度。黄芪散源自《圣济总录》,是治疗消渴病的经典方,由葛根、黄芪、桑白皮组成。研究发现[4],黄芪散可降低糖尿病小鼠的空腹血糖、糖耐量,并降低肾上腺素引起的高血糖。实验证明黄芪散可改善5×FAD小鼠的学习记忆、空间认知功能障碍和AD样病理[5]。中药复方具有多成分-多靶点-多途径的协同作用特点,很难从整体到细胞再到分子水平进行系统全面地阐释。网络药理学是结合计算机技术、系统生物学及生物信息学的新兴学科,可整体系统地分析“药物-靶点-通路-疾病”之间的相互关系,能从分子层面和整体的角度阐明中药复方的药效物质基础和作用机制[6],从而为中药复方有效成分的筛选和作用机制的研究提供技术支撑,且与中医治病整体原则及中药复方多成分、多靶点、多通路径协同作用特点高度契合。
黄芪散有效成分众多,作用靶点丰富,但黄芪散治疗AD的有效成分及作用机制尚不明确。因此,本研究采用网络药理学的方法,对黄芪散的有效成分、靶点、信号通路进行预测及分析,并借助细胞试验加以验证,试图在分子水平探究黄芪散治疗AD的作用机制,以期为深入开展黄芪散基础实验研究以及临床合理应用提供参考。
1 材料与方法
1.1 黄芪散有效成分及靶点的筛选
从TCMSP 数据库(http ://lsp.nwu.edu.cn/tcmsp.php)筛选黄芪散(葛根、黄芪、桑白皮)中各味中药的化学成分,根据口服生物利用度(oral bioavailability,OB)和类药性(drug likeness,DL)筛选出符合条件的候选活性成分及其对应靶点,将OB≥30%及DL≥0.18设为筛选条件,并根据文献检索补充黄芪散中有明确治疗AD药理活性的有效成分,将检索所得各个主要成分于TCMSP数据库、ETCM数据库中筛选相关靶点。采用Uniprot数据库(http://www.uniprot.org/)将获得的黄芪散有效成分对应的靶蛋白名转换为标准基因靶点名称。
1.2 AD疾病相关基因检索
以“阿尔茨海默病”的英文“Alzheimer′s disease”为关键词在DisGeNET数据库(http://www.disgenet.org/)和GeneCards数据库(https://genealacart.genecards.org/)中筛选AD相关的基因,在DisGeNET数据库中以得分>0.1作为筛选条件选择相关基因,在GeneCards数据库则选择相关性分数(relevance score≥30)的基因,并对检索到的靶点进行处理,之后将两个数据库合并去重从而获得最终AD的相关靶点。
1.3 PPI网络构建
将黄芪散的有效成分与AD作用靶点上传OmicShare平台(https://www.omicshare.com/)进行配对,得到疾病靶点与有效成分交集的靶点,再将这些交集靶点导入到STRING数据库,选择物种为“Homo sapiens”进行操作,最小相互作用阀值设为“medium confidence=0.4”,得到PPI网络。
1.4 关键靶点的筛选
将候选作用靶点PPI文件中的node1、node2、combined score上传至Cytoscape 3.7.1软件进行PPI网络的可视化处理,并使用工具中的 Network Analysis进行网络拓扑分析,主要根据结果中的degree值的大小筛选,获得关键靶点。
1.5 GO和KEGG分析
用R语言软件及Bioconductor插件,导入Venn图共同靶点,使用cluster Profiler等处理数据,取P<0.05标准,以涉及的靶点数目多少进行排序,选择排名前20的进行可视化展示,运行R语言得到GO和KEGG富集分析的气泡图。
1.6 网络构建
将黄芪散有效成分、对应靶点导入Cytoscape 3.7.1构建黄芪散有效成分-靶点网络。
1.7 体外验证实验
1.7.1 细胞与试剂
大鼠肾上腺髓质嗜铬细胞瘤细胞株PC12细胞(长沙赢润生物技术有限公司,批号2015032007);Aβ25-35(美国Sigma公司,批号053M4804V);多奈哌齐(卫材药业有限公司,批号 190804);ELISA测定试剂盒(武汉塞培生物科技有限公司,批号20190213);ROS试剂盒(碧云天生物,批号041720200803);PINK1抗体、parkin 抗体、p62抗体、脑源性神经生长因子(BDNF)抗体、辣根过氧化物酶(HRP)标记的山羊抗鼠免疫球蛋白G(Ig G)、HRP标记的山羊抗兔Ig G(美国Proteintech公司,批号分别为00047643、00091761、00098963、00047316、SA00001-1、SA00001-2);LC3Ⅱ/Ⅰ抗体(美国Cell Signaling Technology公司,批号11);NLRP3抗体(Abclonal,批号3561487002);DMEM细胞培养液(默飞世尔生物化学制品有限公司,批号SH3002201);10%新生小牛血清(Hyclone Lab,批号220118612)。黄芪散购自湖南中医药大学第一附属医院,取1剂,置于圆底烧瓶中,混匀,加入10倍量水,浸泡30 min,煎煮30 min,收集药液,用4~6层纱布过滤,收集滤液,倒入容器。剩余药渣再加入8倍量水,煎煮2次,每次各20 min,过滤,收集滤液。合并3次滤液,浓缩至生药含量质量浓度为1.0 g/mL的黄芪散水煎剂,冷冻干燥成冻干粉,保存备用。
1.7.2 MTT法检测细胞存活率
采用对数生长期的PC12细胞进行试验,分为4组。对照组(加入不含FBS、PBS的DMEM培养基孵育48 h)、模型组(加入终浓度为20 μmol/L的Aβ25-35[7]孵育48 h)、多奈哌齐组(20 μmol/L Aβ25-35+15 μmol/L盐酸多奈哌齐)及黄芪散治疗组(细胞模型+黄芪散处理组)。黄芪散组分别加入10、20、40、80、160、320 mg/L黄芪散继续培养48 h,采用MTT法用酶标仪在570 nm波长处检测每个孔PC12细胞的吸光度值,计算细胞活率。
1.7.3 用显微镜观察各组的细胞形态学和突起长度
取对数生长期的PC12细胞培养24 h后在培养基中加入终浓度为20 μmol/L的Aβ25-35,显微镜下观察处理后各组PC12细胞形态和统计细胞突起的长度。
1.7.4 透射电镜观察PC12细胞自噬小体
PC12细胞以1×106接种于6孔板中,按照“1.7.2”项分组方法处理24 h后,弃掉培养液,PBS浸洗细胞3次,用0.25%胰酶消化后收集细胞悬于PBS中,1 000 r/min离心5 min,弃去上清液,加入3%透射电镜专用戊二醛于4 ℃过夜避光固定PC12细胞4 h,透射电子显微镜观察、照相。
1.7.5 ELISA检测PC12细胞上清液IL-1β、IL-18和TNF-α含量
PC12细胞以1×107接种于96孔板中,100 μL/孔,当80%融合时,分别给予各组处理因素,每组3个复孔。按实验要求处理完成后,收集上清液留作待测标本。采用ELISA测定进行检测,按照ELISA测定试剂盒的说明进行操作。
1.7.6 黄芪散对Aβ25-35诱导的PC12细胞ROS含量的影响
PC12细胞按照“1.7.2”项方法经药物作用48 h后,3 000 r/min在4 ℃条件下离心10 min 后,取上清,按照试剂盒操作测定ROS含量。
1.7.7 Western blot法检测相关蛋白表达
PC12 细胞按照“1.7.2”项方法经药物处理48 h后,提取各组细胞总蛋白,SDS-PAGE电泳,将蛋白质转移到PVDF膜上,用含5%脱脂奶粉的1×TBST封闭。分别加入PINK1、parkin、p62、LC3Ⅱ/Ⅰ、NLRP3、BDNF一抗4 ℃孵育过夜,TBST洗涤膜后加HRP标记的二抗,避光室温孵育1~2 h,采用ECL法检测目的条带,胶片曝光,显影,以β-actin为内参,分析结果。
1.7.8 统计学处理

2 结果
2.1 黄芪散有效成分的筛选和靶点预测
从TCMSP中以OB≥30%,DL≥0.18为条件,对黄芪散的有效成分进行筛选,结合文献查阅结果[8-10],补充纳入有较好治疗AD药理活性成分的黄芪甲苷(astragaloside Ⅳ)、葛根素(puerarin)、白藜芦醇(resveratrol)。最终筛选出44个有效成分(见表1)。其中黄芪12个,葛根5个,桑白皮32个,重复成分5个。

表1 黄芪散有效成分Table 1 Effective ingredients of Huangqisan

续表1(Continued Tab.1)
2.2 “有效成分-靶点”网络构建
利用Perl软件整理数据,导入Cytoscape 3.7.1软件,构建黄芪散及AD的有效成分-靶点网络图(见图1)。利用Cyto Hubb插件得出排名前4位的核心有效成分为槲皮素、葛根素、黄芪甲苷和白藜芦醇。
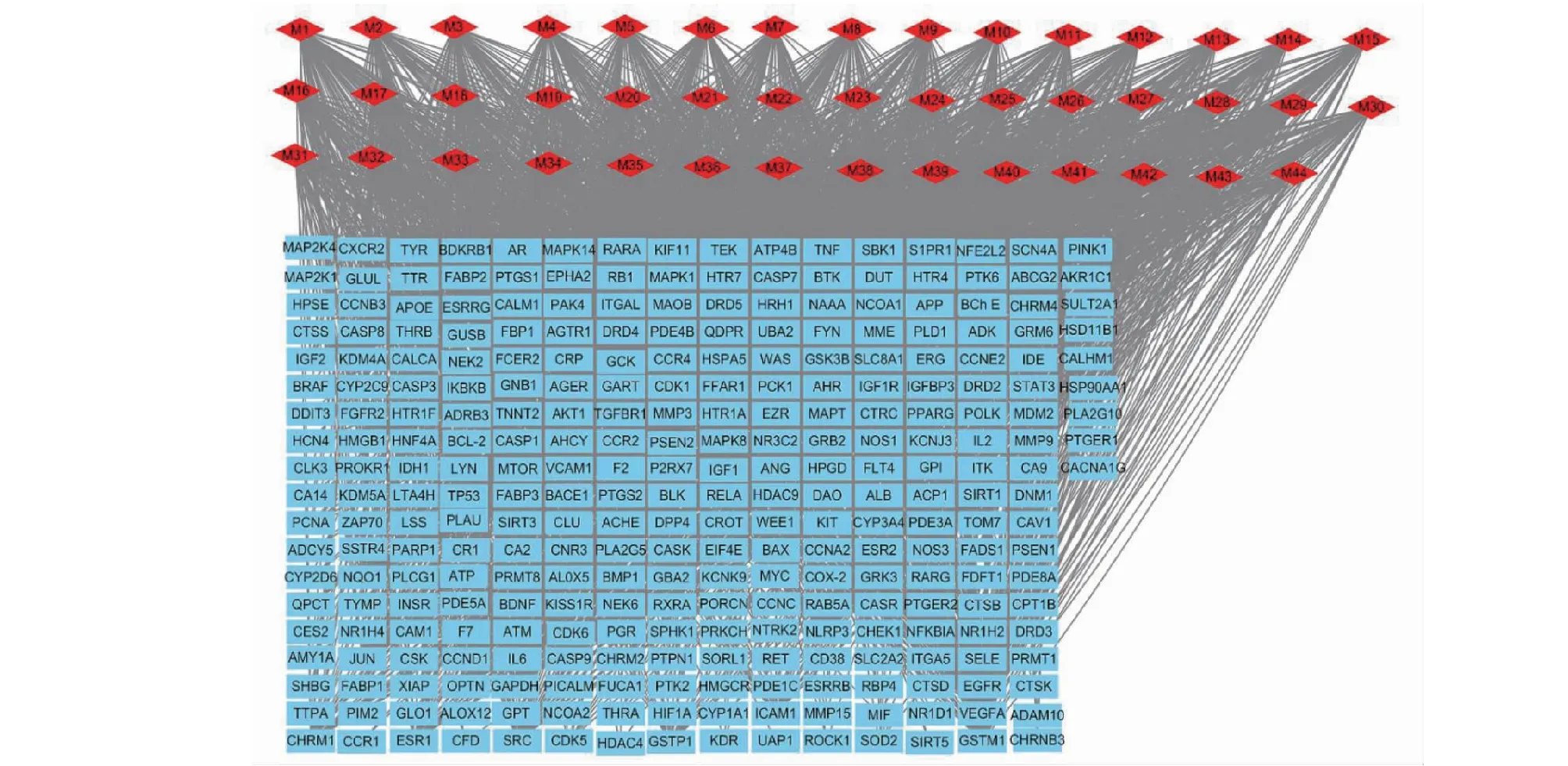
图1 黄芪散有效成分-靶点网络Fig.1 Effective ingredients of Huangqisan-target network注:红色菱形表示黄芪散的有效成分;蓝色长方形:靶基因。Note:Red diamond:Huangqisan compound;Blue rectangle:Target gene.
2.3 AD相关基因
在DisGeNET和GeneCards数据库AD的靶基因,共得到2 894个基因。
2.4 PPI网络构建图
将黄芪散-AD交集靶点导入String网站,获得PPI图(见图2),其中节点数102、边数1 124、平均节点度8.46、平均局部聚类系数0.588;网络节点代表蛋白质,连线代表蛋白质之间的相互作用。邻接节点个数越多,成为关键基因的概率越大。其中排名前10的基因为PINK1、NLRP3、BDNF、INSR、MTOR、OPTN、APP、CASP3、SOD2、GSK3B。
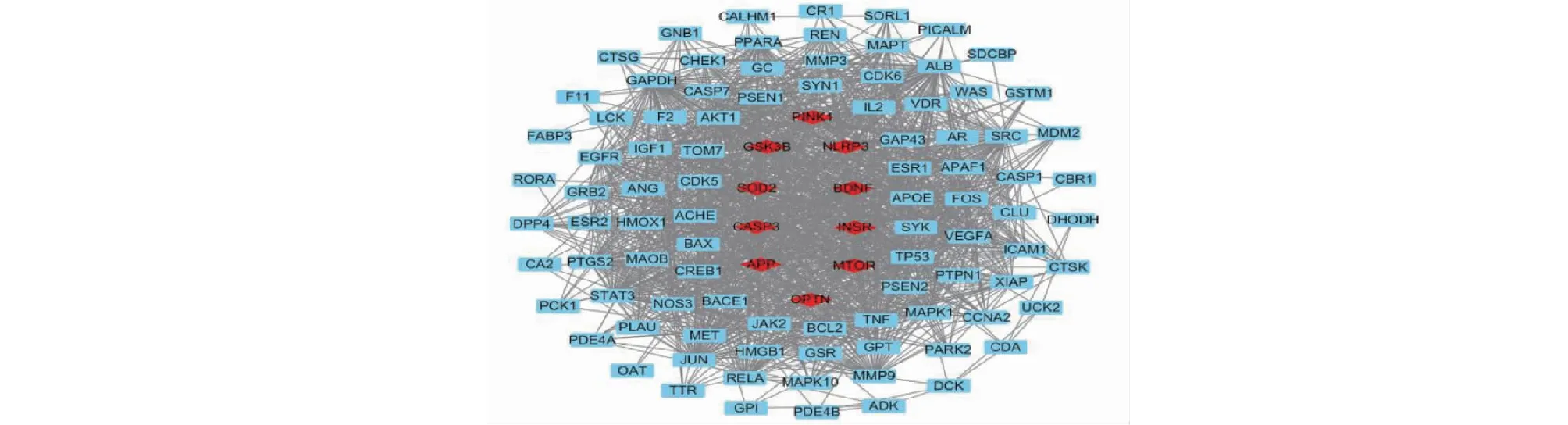
图2 靶蛋白PPI网络图Fig.2 PPI network diagram of target protein
2.5 GO和KEGG结果
GO富集分析包括细胞成分、分子功能和生物过程3部分。将GO富集排名前20位制成气泡图(见图3),富集的GO功能主要包括自噬、炎症反应、对突触可塑性的调节、对胰岛素的反应、神经元凋亡过程、氧化应激反应等。行KEGG通路富集分析制成气泡图(见图4)。富集的KEGG通路主要包括线粒体自噬信号通路、胰岛素抵抗、自噬、胰岛素信号通路、阿尔茨海默病等。

图3 GO功能富集分析Fig.3 GO function enrichment analysis
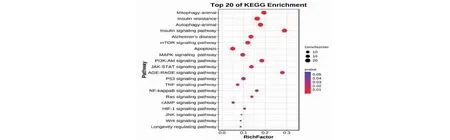
图4 KEGG通路分析Fig.4 KEGG pathway analysis
2.6 黄芪散对Aβ25-35诱导的PC12细胞存活率的影响
与空白组比较,模型组PC12细胞活率明显降低(P<0.01);与模型组比较,黄芪散组作用后,细胞活率显著升高(P<0.05,P<0.01)。黄芪散各给药组(10~80 mg/L)与模型组比较,细胞存活率均明显升高。结果显示黄芪散在80 mg/L具有统计学差异,且之后随着浓度的升高其存活率增加幅度不明显,因此后续研究中采用黄芪散80 mg/L进行给药(见表2)。
表2 黄芪散对Aβ25-35损伤 PC12细胞活率的影响Table 2 Effects of Huangqisan on the viability of PC12 cells injured by
2.7 各组PC12细胞形态学和突起长度的改变
与对照组相比,模型组的细胞数量显著减少,且模型组细胞的突起明显缩短甚至消失,外缘形状变成钝圆形,提示AD细胞模型构建成功。与模型组比较,黄芪散组、多哌奈齐组的细胞细胞数量明显增加,形状为不规则多边形,与对照组的细胞形态相似(见图5)。与模型组比较,黄芪散组、多哌奈齐组的PC12细胞突起长度明显增加(P<0.05,P<0.01)(见表3)。
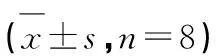
表3 各组PC12细胞突起生长的比较Table 3 Comparison of synaptic growth of PC12 cells in each group

图5 各组PC12细胞的形态(×800)Fig.5 The morphology of PC12 cells in each group (×800)注:A:对照组;B:模型组;C:多奈哌齐组;D:黄芪散组,下同。Note:A:Control group;B:Model group;C:Donepezil group;D:Huangqisan group,the same below.
2.8 黄芪散对Aβ25-35诱导的PC12细胞自噬小体的影响
对照组PC12细胞内可明显观察到完整形态线粒体,同时整体细胞形态完整。与对照组比较,模型组细胞经Aβ25-35损伤后没有出现典型的自噬小体,并且线粒体呈现空腔化改变,细胞整体形态发生变化。与模型组比较,黄芪散组、多哌奈齐组的PC12细胞自噬小体显著增加,同时可观察到较多被自噬小体包裹的受损线粒体,提示黄芪散可显著激活PC12细胞的自噬(见图6)。

图6 透射电镜检测各组细胞自噬小体(×30 000)Fig.6 Transmission electron microscope for observing autophagosomes in all groups(×30 000)
2.9 各组PC12细胞上清液IL-1β、IL-18和TNF-α水平
与对照组比较,模型组PC12细胞IL-1β、IL-18和TNF-α水平均明显增高(P<0.01);与模型组比较,黄芪散组、多哌奈齐组PC12细胞的IL-1β、IL-18和TNF-α水平显著减低(P<0.05,P<0.01),提示黄芪散对PC12细胞的炎症反应具有明显的抑制作用(见表4)。
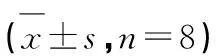
表4 各组PC12细胞IL-1β、IL-18和TNF-α水平的比较Table 4 Comparison of the levels of IL-1β,IL-18 and TNF-α in the supernatant of PC12 cells in each
2.10 黄芪散对Aβ25-35诱导的PC12细胞ROS含量的影响
与对照组相比,模型组PC12细胞ROS含量明显升高(P<0.01);与模型组比较,黄芪散组、多哌奈齐组的PC12细胞ROS含量显著降低(P<0.05,P<0.01)(见表5)。
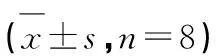
表5 黄芪散对ROS含量的影响Table 5 Effect of Huangqisan on contents of
2.11 黄芪散对Aβ25-35诱导的PC12细胞中自噬相关蛋白及NLRP3、BDNF蛋白表达的影响
与对照组比较,模型组细胞PINK1、parkin、BDNF蛋白表达显著降低,p62、LC3Ⅱ/Ⅰ、NLRP3蛋白表达明显升高(P<0.01)。与模型组比较,黄芪散组、多哌奈齐组的PINK1、parkin、LC3Ⅱ/Ⅰ、BDNF蛋白表达显著升高,p62、NLRP3蛋白表达明显降低(P<0.05,P<0.01)(见图7)。

图7 黄芪散对Aβ25-35诱导PC12细胞自噬相关蛋白及NLRP3、BDNF蛋白表达的影响Fig.7 Effect of Huangqisan on the proteins expression of autophagy-related proteins and NLRP3,BDNF in Aβ25-35-induced PC12 cells
3 讨论与结论
AD因其具有和1、2型糖尿病相似的发病机制,即主要体现在脑胰岛素缺乏和胰岛素抵抗,已被学术界称为“3型糖尿病”。糖尿病属于中医学的消渴,以气阴两虚、燥热内盛为主,发展至后期则气阴两伤,阴阳俱虚,变证百出。因此,益气、养阴、清热是治疗消渴病的基本法则。黄芪散是治疗消渴的经典方,方中葛根生津止渴升脾中清阳,输津液以溉五脏而滋阴清热;黄芪有补气健脾,取其气复津还,云行而雨施之意;桑白皮甘寒泻火,滋阴润燥,且其甘寒之性以制黄芪稍热之性;三药配伍,共奏益气健脾,养阴清热,生津止渴之效,三消并治,从而起到标本兼顾之效。
有效成分-作用靶点网络显示黄芪散治疗AD具有多成分、多靶点的特点,结果显示槲皮素、葛根素、黄芪甲苷和白藜芦醇是其关键有效成分。研究证实槲皮素可通过经典的雌激素受体通路及MAPK途径增加Bcl-2/Bax表达比值及下降Caspase-3蛋白表达,从而减弱凋亡发生[11]。研究证明葛根素可有效减缓AD模型大鼠嗅球内tau蛋白磷酸化水平的增加,其作用机制可能与其降低GSK-3β活性水平有关[12]。研究证明基于MEK5 /ERK5信号通路对AD大鼠小胶质细胞的活性具有抑制作用,可拮抗AD大鼠神经细胞的凋亡[13]。研究发现[14],白藜芦醇可能通过促使海马小胶质细胞M2型极化进而减轻炎性损伤改善AD小鼠的认知功能障碍。
将有效成分和AD共同靶点相映射,得到药物-疾病共同作用靶点102个。黄芪散关键靶点居前三位的是PINK1、NLRP3、BDNF。PINK1是PINK1/parkin信号通路的主要成员,研究发现[15],激活PINK1-Parkin介导的线粒体自噬而影响AD病理,改善AD模型小鼠的认知和记忆障碍功能。研究表明[16],NLRP3炎症小体可能通过调节炎症反应在AD发生发展中扮演十分重要的角色,NLRP3炎症小体激活的两个关键标志物IL-1β和IL-18在AD患者脑内处于高水平状态。BDNF作为一个重要的神经细胞营养因子,在突触可塑性、神经发生和神经细胞存活中发挥关键作用[17]。
GO富集分析显示黄芪散治疗AD的基因功能主要体现在自噬、炎症反应、对突触可塑性的调节、对胰岛素的反应、神经元凋亡过程、氧化应激反应等过程。在本研究筛选出的信号通路中,与黄芪散有效靶点的关联度最高的是线粒体自噬信号通路,其次是胰岛素抵抗。在本研究中,结合 AD的发病机制,筛选出预测结果中的线粒体自噬、炎症反应、突触可塑性的调控机制为黄芪散对AD干预的可能机制开展体外细胞实验。PINK1/parkin信号通路是调控线粒体自噬的关键通路,其作用方式为通过泛素化parkin以激活自噬[18]。PINK1为线粒体受损的主要探测器,当线粒体受损时,PINK1在线粒体外膜磷酸化parkin将其从细胞质内募集至受损线粒体,进而磷酸化胞浆中的E3泛素蛋白连接酶parkin诱导其从细胞质内向受损的线粒体外膜上募集,活化的parkin将泛素连接到底物蛋白上形成泛素链,与p62等结合以募集胞质中的自噬标志物LC3,形成具有双层膜结构的自噬小体[19]。自噬小体最后通过融合溶酶体将受损的线粒体完全降解,完成线粒体自噬的过程。LC3-Ⅱ的转化的程度越高,自噬小体数量就越多,自噬水平可以通过LC3-Ⅱ/LC3-Ⅰ判断[20]。p62能直接与LC3蛋白特定区域结合,并最终被自噬溶酶体选择性降解,自噬发生时p62蛋白在自噬小体内被降解[21],因此p62蛋白的降解也是反映自噬水平的标志之一。研究显示[22],线粒体自噬受损可能会引起Aβ和tau蛋白的积累,加剧氧化损伤,导致突触功能障碍和认知障碍。因此,线粒体自噬对AD具有十分重要的作用。研究证实通过激活PINK1/parkin通路促进线粒体自噬可改善AD模型小鼠的认知功能障碍、增强线粒体的功能、起到神经元保护的作用[23]。本研究结果表明黄芪散能增加自噬小体数量,促进自噬小体包裹受损线粒体,升高LC3Ⅱ/Ⅰ比值,上调PINK1、parkin蛋白表达,下调p62蛋白表达,提示黄芪散可能通过激活PINK1/parkin 通路促进线粒体自噬水平。研究表明[24],ROS是促进NLRP3小体活化及其下游IL-1β、IL-18和TNF-α等炎症分子的表达的关键信号。实验证实通过激活PINK1/parkin通路促进线粒体自噬可降低ROS水平,抑制NLRP3炎症小体活性,减少下游的IL-1β、IL-18等炎症因子水平,在AD中发挥保护作用[25]。本研究结果表明黄芪散能显著降低ROS水平,抑制NLRP3炎症小体活性,并降低炎症因子IL-1β、IL-18和TNF-α水平,可能与黄芪散激活PINK1/parkin通路促进线粒体自噬水平有关。神经元是神经系统的结构单元,神经系统中神经元之间通过突触紧密联系。神经元中的神经突向外生长是神经退行性和神经保护的标志[26]。神经突起生长是神经元发育,突触形成和神经再生的重要前提。所以促进神经突起的生长和神经细胞损伤后的修复在中枢神经系统疾病中的治疗显得尤为重要。BDNF作为一个重要的神经细胞营养因子,在突触可塑性、神经发生和神经细胞存活中发挥关键作用[17]。研究证明激活PINK1/parkin通路促进线粒体自噬可改善3xTg-AD小鼠学习记忆认知障碍和突触、树突棘结构及功能损伤[27]。在我们的研究中,发现黄芪散可升高Aβ25-35诱导的PC12细胞的存活率、增加细胞突起长度、提高BDNF蛋白表达,可能与黄芪散激活PINK1/parkin通路促进线粒体自噬有关。
综上,本研究运用网络药理学和实验验证的方法分析了黄芪散治疗AD的作用机制,得出的结论是:黄芪散可能是通过激活PINK1/parkin通路促进线粒体自噬清除ROS进而抑制NLRP3炎症小体的活化和改善突触可塑性而发挥治疗AD作用。从分子、细胞水平进行阐述,为深入开展黄芪散基础实验研究以及临床合理应用提了供参考。
