地锦草提取物通过miR-106-5p/TLR4信号通路改善非酒精性脂肪性肝炎
2023-01-14刘明靓陈叶梓刘朝奇周永芹袁成福何毓敏
刘明靓,陈叶梓,张 磊,刘朝奇,周永芹,袁成福,何毓敏*
1三峡大学医学院;2三峡大学肿瘤微环境与免疫治疗湖北省重点实验室,宜昌 443002
非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,NASH)是非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)发生发展的一个阶段的病理变化,其特征为肝脏脂质代谢紊乱介导的炎症、内质网应激(endoplasmic reticulum stress,ER)、线粒体功能障碍和纤维化,被认为是临床病变发展的关键环节,与肝硬化及肝癌的发展密切有关[1]。在NASH进展中机体的“肠-肝轴”调节功能紊乱介导的炎症反应具有重要作用[2,3]。肠道屏障受损导致代谢性内毒素通过“肠-肝轴”转运至肝脏,引起肝脏炎症反应。其中,miRNA在肝脏炎症反应的发生发展中发挥着重要调控作用[4]。非编码微小RNA(microRNA,miRNA)是一类不编码蛋白质的核苷酸序列,但可通过靶向目的基因mRNA的3′UTR,抑制基因的表达。miRNA几乎参与所有生理病理过程,miRNA可以通过靶向炎症相关基因,如miR-106低表达而活化MAPK信号通路,介导妊娠期高血压小鼠肝脏氧化应激损伤和炎性浸润[5]。通过荧光素酶报告基因分析发现miR-106a对Th17转录因子Ror和活化T细胞(Nfat)核因子5的靶位特异性调节[6]。这些结果提示miR-106的低表达可介导相关的炎性因子表达产生炎症反应。
地锦草(EuphorbiahumifusaWilld.)系大戟科大戟属植物。常用于治疗细菌性痢疾、肠胃炎、咳血、便血等病症。现代药理学证明,地锦草中含有多种有效成分,如多酚类、黄酮类、生物碱和三萜类化合物等具有抗炎[7]、抗氧化、降血脂、降血糖和降压、抑菌等多种作用[8-10]。因此本实验在动物水平使用短期高脂饮食(high fat diet,HFD)联合葡聚糖硫酸钠盐(dextran sulfate sodium,DSS)喂养建立NASH小鼠动物模型(HFD+DSS),DSS是一种可对小鼠肠道屏障造成损伤,常用于诱导结肠炎动物模型[11],在此模型上研究地锦草提取物干预NASH及其可能机制,为防治NASH提供新的思路。
1 材料与方法
1.1 动物
40只SPF级6~8周龄健康的C57BL/6小鼠(雌、雄小鼠各半,体重18~20 g),动物生产许可证号((SCXK)(鄂)2017-0012),购自于三峡大学实验动物中心。在恒温(20±2) ℃以及湿度(50±2)%的环境条件下喂养。所有动物实验已由动物伦理委员会的批准,审批号为42010200005879。
1.2 药物及试剂
地锦草(购买于湖北省宜昌市中医医院),由天然产物研究与利用湖北省重点实验室(三峡大学)汪鋆植教授进行鉴定,药材基源鉴定合格;高脂饲料参照课题组前期方法制备[12];葡聚糖硫酸钠(DSS)(上海翊圣生物科技公司,货号:60316ES76);甘油三酯测定(GPO-PAP法)试剂盒,丙氨酸氨基转移酶测定试剂盒(丙氨酸底物法)(中生北控生物科技股份有限公司);TLR4抗体(Santa Cruz公司,货号:SC-293072);IL-1β抗体(Abcam公司,货号:ab9722);β-actin抗体(Cell Signaling公司,货号:4970L);实时荧光定量PCR(qRT-PCR)引物(生工生物工程股份有限公司);高效cDNA链合成试剂盒(南京Vazyme生物科技有限公司,货号:R312-01);通用型高灵敏度染料法定量PCR检测试剂盒(南京Vazyme生物科技有限公司,货号:Q311-02)。
1.3 主要仪器
电泳仪(美国Bio-Rad伯乐公司);实时荧光定量PCR仪(Applied Biosystems公司);ChemiScope化学发光凝胶成像显影设备(上海勤翔科学仪器有限公司);TS100显微镜(日本Nikon尼康公司)。
1.4 实验方法
1.4.1 地锦草提取物的制备
传统中草药一般用煎煮法,所以水提法通常采用热水浸出法,利用“相似相溶”的原理进行提取,能够比较完整地保留成分[10]。将总重量为200 g的地锦草进行粉碎,加入相当于药物8倍量的蒸馏水并浸泡30 min,加热至沸腾,再继续煮20 min,过滤;将获得的药渣按照上面方法再重复2次,提取滤液。然后将3次的滤液合并在一起进行浓缩,浓缩完后将其冻干成粉末状,最后获得50.5 g提取物。地锦草药物的提取率为25.3%,每克提取物相当于4.0 g的生药量[13]。应用HPLC指纹图谱分析地锦草提取物,获得多个峰。根据文献[7]提示没食子酸具有抗炎及调节miRNA作用,且地锦草提取物中有丰富没食子酸,因此选取没食子酸作为参照品。通过标准品对照法对特征性峰进行指认,确定地锦草提取物含量最高的特征性成分为没食子酸。
1.4.2 动物分组、造模及给药
SPF级别C57BL/6小鼠雌雄对半随机分为4组,每组10只,分别为正常对照组(control,Con),利用HFD和DSS建立的小鼠NASH模型组(model,Mod),地锦草提取物低剂量给药组(EHW-L,2.5 g/kg),地锦草提取物高剂量给药组(EHW-H,7.5 g/kg)[14]。在总共为期14 d的试验周期内,对NC组喂食普通无添加饲料。模型组和药物组均给予高脂饲料2周。在该时期对正常对照组和模型组进行无菌生理盐水灌胃,而有关药物组根据相应剂量进行地锦草提取液灌胃给药。从第8 d开始,模型组和药物组均将正常饮水换为浓度为2%的DSS饮水,持续饮用DSS水7 d。
1.4.3 小鼠血清生化标志物检测
留取小鼠眼球血,并分离出上清开展后续生化指标检测。使用相应的试剂盒检测血清中甘油三酯(triglyceride,TG)和谷丙转氨酶(alanine aminotransferase,ALT)含量,根据反应产物的吸光度大小计算出目标底物的含量。
1.4.4 小鼠肝脏组织H&E染色
新鲜肝脏组织用低温磷酸盐缓冲液冲洗干净,切取肝大叶中长度和厚度均适中的一部分放入包埋夹内,用4%多聚甲醛固定24 h,后常规脱水处理,石蜡包埋,切成5 μm厚的切片。然后将切片进行苏木精伊红染色(hematoxylin-eosin staining),普通光学显微镜下观察肝组织形态情况。
1.4.5 实时荧光定量逆转录聚合酶链反应
取小鼠部分肝组织约30~50 mg,利用Trizol试剂提取总RNA。测量RNA样品的浓度和纯度。根据第一链合成cDNA合成试剂盒来合成其cDNA用于RT-PCR扩增。其中 miR-106-5p GGTGGTTCACAAAGCCCATACCAGTGCAGGGTCCGAGGT-为茎环引物,通过逆转录获取cDNA,U6作为内参,经qPCR反应扩增目的基因。相应的所有引物序列如表1所示。qPCR反应条件为:两步法变性95 ℃ 20 s、退火60 ℃ 30 s,40个循环。溶解曲线检测从60 ℃到95 ℃,每0.5 ℃读取1次,若为单峰时说明引物特异性良好。利用软件qPCRsoft (RealTime PCR Application)分析,计算2-△△CT分析相关基因的表达量。引物序列见表1。
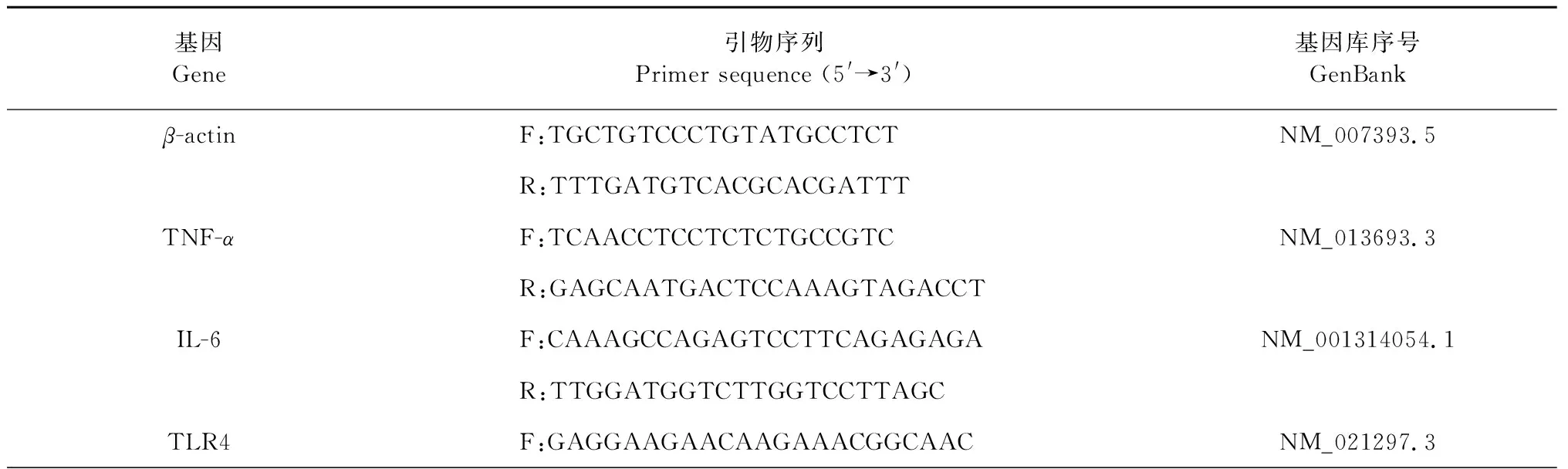
表1 引物序列Table 1 Primer sequences
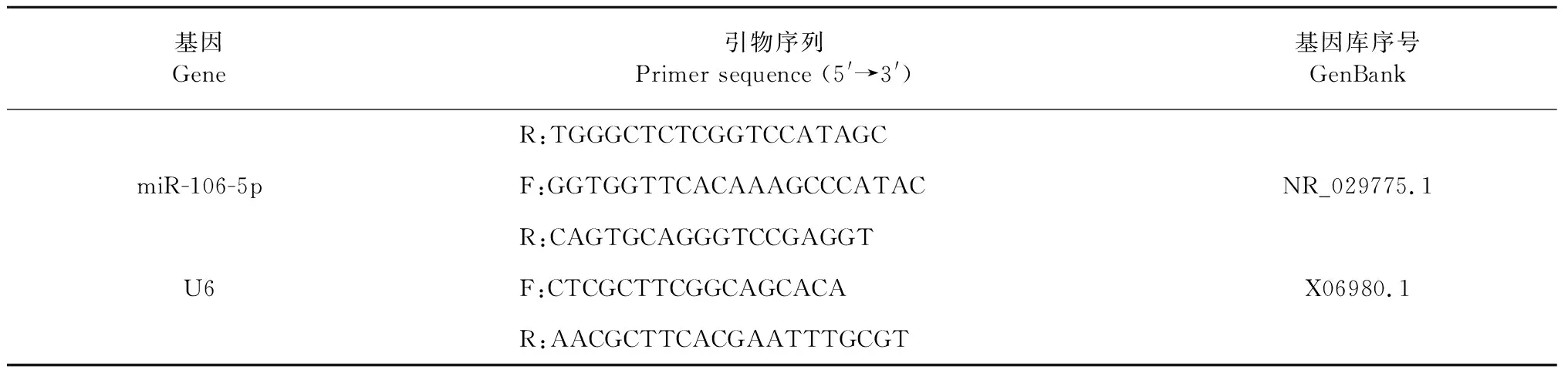
续表1(Continued Tab.1)
1.4.6 Western blot
冷冻的肝脏组织在冰冷RIPA 蛋白裂解液中均质化。4 ℃条件下静置30 min,12 000 r/10 min后取上清液用于蛋白印迹分析。将提取的总蛋白经BCA试剂盒测定浓度,每个蛋白样品上样量为30 μg。加入loading buffer,100 ℃水浴10 min变性。等量的样品经SDS-PAGE凝胶电泳分离,采用湿法转膜法将蛋白条带转移至聚偏二氟乙烯PVDF膜上。使用丽春红染料检验蛋白是否转移至膜上。后续用5%脱脂牛奶于脱色摇床封闭90 min、4 ℃一抗孵育过夜、室温孵育二抗。试验期间每敷完抗体后需用TBST洗膜。最后在膜上均匀覆盖显影液,进行化学发光成像观察蛋白条带。用Image J软件分析目的蛋白的相对表达含量。
1.4.7 miRNA预测
TargetScan(网址:http://www.targetscan.org/vert_71/)预测以TLR4为靶基因的miRNA。哺乳动物中的miRNA通过结合转录本序列的3′UTR区,从而发挥转录后调控作用。而TargetScan是一个专门分析哺乳动物miRNA靶基因的软件,并且根据已有的分析结果整理成了数据库。本实验查找TLR4相关miRNA,然后与棕榈酸诱导肝细胞损伤细胞模型的miRNA芯片数据进行交集,获得靶向TLR4的miR-106-5p。
1.4.8 数据统计分析

2 结果
2.1 地锦草提取物改善NASH病理损伤
2.1.1 地锦草提取物显著改善NASH的脂质代谢
通过给予小鼠葡聚糖硫酸钠DSS-高脂饮食从而在短期内迅速建立NASH动物模型并收集小鼠血清,采用肝功能生化试剂盒检测小鼠血清中谷丙转氨酶(ALT)与甘油三酯(TG)的含量变化。统计分析结果显示,与正常对照组相比,模型组血清中的ALT与TG含量均显著上升,且差异均具有统计学意义(P<0.05)。表明模型组小鼠肝脏功能具有一定的损害。然而药物组通过低剂量和高剂量地锦草提取物干预后,与模型组比较,给药组小鼠血清中的TG和ALT的含量均有所下降(P<0.05)(见图1)。

图1 地锦草提取物对HFD+DSS致NASH脂质代谢的影响Fig.1 Effects of E.humifusa extract on lipid metabolism of HFD+DSS induced 注:与正常组比较,#P<0.05;与模型组比较,*P<0.05,下同。Note:Compared with Con,#P<0.05;Compared with Mod,*P<0.05,the same below.
2.1.2 地锦草提取物改善小鼠肝脏组织病理损伤
肝脏活检是检验非酒精性脂肪性肝炎的金标准,利用苏木精伊红染色检测HFD和DSS对小鼠肝脏组织形态的影响。H&E染色结果显示正常对照组的肝切片中肝小叶结构完整,汇管区边界清晰,肝细胞呈放射状分布于中央静脉周围,肝窦清晰可见。图中黑色方框所指为脂质变性和炎性浸润。模型组小鼠肝细胞肿胀变大,肝索结构混乱无规则,出现脂肪空泡的数量多。此外还可以观察到炎性细胞聚集成片并伴有明显的炎性浸润,肝小叶内伴有炎症细胞浸润(达到NASH诊断标准)。而在通过地锦草提取物处理后,镜下观察可见肝细胞形态逐渐清晰,排列更为紧密,脂肪空泡显著减少、气球样变和炎性细胞浸润严重程度下降。总之,药物组肝细胞与模型组相比形态有所恢复,脂肪变性和炎性程度也同样降低。并且在高剂量的药物组中肝索结构愈发清晰有序(见图2)。提示地锦草提取物对小鼠肝组织脂质沉积和炎症反应有一定的改善作用。
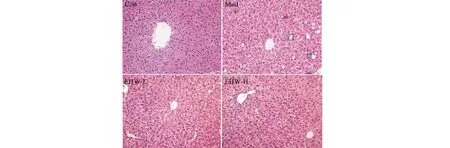
图2 地锦草提取物对HFD+DSS致NASH的肝组织病理学的影响(H&E染色,×400)Fig.2 Effects of E.humifusa on liver histopathology of HFD+DSS induced NASH (H&E staining,×400)
2.2 地锦草提取物调节miR-106-5p/TLR4信号通路的表达
2.2.1 小鼠肝组织中miR-106-5p和TLR4的表达情况
有文献报道称非酒精性脂肪性肝病与肝脏代谢的彻底重编程有关。表观遗传机制,特别是与microRNA表达和活性失调相关的机制,在与NAFLD相关的代谢紊乱及向着疾病更严重阶段的进展中起重要作用[15]。结合课题前期获取的棕榈酸处理的肝细胞miRNA芯片数据库。在本研究中为了探索NASH中靶向调节TLR4的miRNA,使用生物信息学软件Targetscan预测。将前期芯片数据库同预测结果进行交集,筛选到在细胞模型中明显低表达的miR-106-5p确定为本文的研究对象。miR-106-5p与TLR4的3′-UTR区结合如图3A所示。基于TLR4和miR-106-5p在肝炎中的作用,推测TLR4和miR-106-5p具有相关性。为了进一步验证该假设,随后通过检测小鼠肝组织中miR-106-5p及TLR4的表达情况。根据实时荧光定量PCR和蛋白印迹试验结果可看出,在高脂饮食和DSS双重诱导下小鼠肝组织中miR-106-5P表达受到抑制,而TLR4 mRNA和蛋白的表达含量均增加,差异有统计学意义(P<0.05)(见图3B~3D),这一现象提示在脂肪性肝炎发病发展中,肝组织内miR-106-5p和TLR4可能具有调控关系。进一步分析药物对miR-106-5p和TLR4的影响,结果发现与模型组比较,地锦草提取物低、高剂量组miR-106-5p的表达明显上升,而miR-106-5p靶向的基因TLR4无论是转录水平还是翻译水平的表达均明显下降(见图3B~3D),差异有统计学意义(P<0.05)(见图3D)。根据以上在各个实验组中检测到的TLR4表达水平的变化趋势,提示地锦草提取物可能具有调节miR-106-5p/TLR4活性的作用。
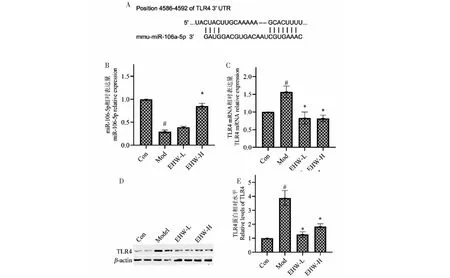
图3 地锦草提取物调节miR-106-5p/TLR4表达Fig.3 The extract of E.humifusa regulated the expression of
2.2.2 小鼠肝脏组织中炎症因子的表达情况
IL-1β、TNF-α被认为是NASH进展的主要细胞因子。同时TNF-α和IL-6,IL-1β也是作为TLR4信号通路的下游。与正常对照组比较,模型组小鼠肝组织中IL-6和TNF-α炎性因子的表达水平明显上升(见图4A~4C)。此外Western blot结果显示,模型组中IL-1β蛋白表达水平增加(P<0.05)。但通过不同剂量的地锦草提取物进行治疗后,给药组中炎性因子IL-6 和TNF-αmRNA表达水平显著下降,IL-1β蛋白表达水平也明显降低(P<0.05)(见图4A~4D)。以上结果提示了作为通路下游的炎性因子TNF-α和IL-6、IL-1β与miR-106-5p可能在NASH发生发展过程中有一定的作用,地锦草提取物可能通过调节miR-106-5p/TLR4信号通路改善NASH。

图4 地锦草提取物调节TLR4信号通路Fig.4 The extract of E.humifusa regulated TLR4 signaling
3 讨论与结论
高脂饮食诱导的NAFLD动物模型被广泛应用,但单纯的饮食诱导需数月才能显示出明显的肝脏炎症表型,则较长的建模周期对药物筛选有诸多限制因素。在高脂饮食基础上加入葡聚糖硫酸钠(DSS)可通过肠道炎症会加剧高脂饮食诱导的NASH小鼠模型[16]。Kwon等[17]发现接受DSS处理的小鼠表现出肠道屏障功能相关蛋白的表达降低和血浆LPS水平升高,表明在DSS诱导下的肠道屏障功能障碍。同时这些小鼠也表现出肝脏脂肪堆积和炎症表型,促进NASH的发生发展[18-20]。课题组前期实验[13]也发现应用HFD和DSS喂养小鼠,高脂饮食诱发的脂质沉积和葡聚糖硫酸钠导致的肠道屏障受损,可在短时间内发展为非酒精性脂肪性肝炎。总之,使用此方法可在短期内完全建立NASH体内模型,适合于有关药物的筛选工作及机制研究[21,22]。
有研究报道在急性肺损伤(ALI)小鼠模型中,LPS刺激的巨噬细胞的肺组织中miR-106a 的表达显著降低。miR-106a可通过靶向TLR4表达来抑制NF-κB活化及其下游的炎性因子的产生[23]。高糖(25 mmol/L)可诱导人脐静脉内皮细胞(HUVECs)中HMGB1的表达增加及 miR-106的表达降低,介导HUVEC 凋亡和炎症因子的表达。总之,这些数据共同表明 miR-106表达降低可活化炎症反应信号通路[24]。我们的研究结果也证明在NASH小鼠模型中,肝脏组织的miR-106a低表达以及TLR4高表达,从而介导NASH发生发展。给予地锦草提取物后,结果ALT、TG的水平降低;肝组织中TNF-α的mRNA水平降低,病理损伤程度减轻。同时发现在模型组的肝组织miR-106-5p低表达,miR-106-5p靶向的TLR4表达上调,继而观察到TLR4信号通路下游的TNF-α、IL-1β和IL-6在肝组织中明显增高。药物干预后可导致miR-106-5p的表达升高,抑制TLR4信号通路。
综上所述,地锦草提取物可以改善高脂和葡聚糖硫酸钠饮食诱导的非酒精性脂肪性肝炎,其改善非酒精性脂肪性肝炎的作用机理可能是通过调节miR-106-5p的表达,来抑制靶向的TLR4信号通路所介导的炎症反应,从而改善炎症性肝损伤,为NASH治疗药物的开发提供实验依据。
