粉防己根的化学成分及抗肝纤维化活性研究
2023-01-14许进业许凤清孔垂皓赵宏苏王仁中吴德玲
许进业,许凤清,2,孔垂皓,赵宏苏,2,王仁中,2*,吴德玲,2*
1安徽中医药大学药学院;2中药研究与开发安徽省重点实验室,合肥 230012
粉防己(StephaniatetrandraS.Moore)为防己科千金藤属植物,主要分布于江西、安徽南部、浙江、福建等地区[1]。以其干燥的根入药,具有祛风止痛、利水消肿的功效,用于风湿痹痛、水肿脚气、小便不利和湿疹疮毒。前期研究表明,粉防己主要含有生物碱类成分[2,3],其生物碱的类型包括双苄基异喹啉类、原小檗碱类、阿朴菲类、原阿朴菲类和菲类等多种结构类型。现代药理研究表明粉防己和粉防己碱在抗肿瘤、抗炎镇痛、抗肝纤维化、保护心血管系统、抗菌、抗高血压等方面具有显著生物活性[4-10]。为了进一步研究粉防己中的其他活性成分,本研究对粉防己根的化学成分进行系统研究,并探究所得化合物对TGF-β1诱导的肝星状细胞LX-2增殖的影响,研究结果将阐明粉防己抗肝纤维的药效物质,同时也为抗肝纤维化药物的研发提供参考。
1 材料与方法
1.1 仪器与试剂
Bruker ARX-400 NMR核磁共振波谱仪(德国Bruker公司);SEP LC52半制备高效液相色谱仪(北京赛普瑞思科技有限公司);API-4500质谱仪(美国ABI公司);SpectraMAX酶标仪(Molecular Devices);Cell Counting Kit-8检测试剂盒(Dojindo公司);TGF-β1(Peprotech公司);DMEM培养基(Gibco公司);C18色谱柱(CAPCELL PAK-MGⅡ,250×10 mm,5 μm)、硅胶填料(100~200目,青岛海洋化工厂);Sephadex LH-20(50 μm,瑞典Ge公司);反相材料RP-C18(50 μm,德国Merck公司);乙腈为色谱级,其他试剂均为分析纯,水为超纯水。
1.2 实验材料
粉防己的根来源于江西省九江市,经中国医学科学院药物研究所马林教授鉴定为防己科千金藤属植物粉防己StephaniatetrandraS.Moore的干燥根。人肝星状细胞(LX-2)由安徽中医药大学药物研究所提供。
1.3 实验方法
1.3.1 提取与分离
粉防己的根98.0 kg,经粉碎处理,用95%乙醇回流提取三次,提取液在减压条件下,浓缩得到8.0 kg粗提物。利用1% HCl稀酸溶液充分溶解粗提物,并用浓氨水调节溶液的pH至2~3,过滤,滤液再用浓氨水调节pH至9~10,依次用氯仿、乙酸乙酯各萃取三次,减压回收溶剂,得到氯仿部位(2.1 kg)和乙酸乙酯部位(36.0 g)。
氯仿部位(2.1 kg)利用硅胶柱色谱进行分离,流动相采用石油醚-丙酮体系(1∶0→25∶1)和三氯甲烷-甲醇体系(30∶1→0∶1)进行梯度洗脱,通过TLC检识、合并,共得到7个洗脱流份Fr.C1~Fr.C7。Fr.C5(36.0 g)经Sephadex LH-20凝胶柱色谱,利用二氯甲烷-甲醇(1∶1)洗脱,得到四个流分Fr.C5.1~ Fr.C5.4。Fr.C5.4(12.6 g)经ODS柱色谱,利用乙腈-0.01%氨水(5∶95→1∶0)进行梯度洗脱,得到Fr.C5.4.1~Fr.C5.4.5。Fr.C5.4.1(50.5 mg)应用半制备HPLC进行纯化,乙腈-0.01%氨水(10∶90)为流动相,得到化合物1(5.7 mg)。 Fr.C5.4.2(67.5 mg)用半制备HPLC进行纯化,乙腈-0.01%氨水(8∶92)为流动相,得到化合物2(6.1 mg)。Fr.C5.4.2(35.9 mg)通过Sephadex LH-20凝胶柱色谱,以甲醇为洗脱剂进行分离,得到化合物3(5.6 mg)和4(5.5 mg)。Fr.C5.4.3(108.9 mg)通过半制备HPLC纯化,以乙腈-0.01%氨水(27∶73)为流动相,得到化合物5(8.0 mg)。Fr.C5.4.4(23.9 mg)通过Sephadex LH-20凝胶柱色谱,以甲醇为洗脱剂进行分离,再利用半制备HPLC进行纯化,以乙腈-0.01%氨水(31∶69)为流动相,得到化合物6(5.4 mg)。Fr.C5.4.5(34.5 mg)通过Sephadex LH-20凝胶柱色谱,以甲醇为洗脱剂进行分离,再利用半制备HPLC进一步纯化,乙腈-0.01%氨水(14∶86)为流动相,得到化合物7(4.7 mg)。Fr.C5.4.4析出晶体,得到化合物8(8.0 mg)。
乙酸乙酯部位(36.0 g)经硅胶柱色谱分离,流动相采用石油醚-丙酮体系(1∶0→25∶1),三氯甲烷-甲醇体系(30∶1→0∶1)进行梯度洗脱,通过TLC检识、合并,共得到5个流分Fr.EA1~ Fr.EA5。流分Fr.EA1(12.0 g)通过Sephadex LH-20凝胶柱色谱,利用二氯甲烷-甲醇(1∶1)洗脱,得到4个流份Fr.EA1.1~ Fr.EA1.4。Fr.EA1.1(700.0 mg)经ODS柱色谱,乙腈-0.1%甲酸水(5∶95→1∶0)梯度洗脱得Fr.EA1.1.1~Fr.EA1.1.4。Fr.EA1.1.1(17.3 mg)再利用半制备HPLC进一步纯化,乙腈-0.1%甲酸水(16∶84)为流动相,得到化合物9(8.0 mg)。Fr.EA1.1.2(35.6 mg)通过Sephadex LH-20凝胶柱色谱,以甲醇为洗脱剂进行分离,得到化合物10(9.0 mg)。Fr.EA1.1.3(50.9 mg)经 ODS柱色谱,乙腈-0.1%甲酸水(5∶95→100∶0)梯度洗脱,再利用半制备HPLC进一步纯化,乙腈-0.1%甲酸水(12∶88)为流动相得到化合物11(10.0 mg)和12(9.0 mg)。Fr.EA1.1.4(77.8 mg)利用半制备HPLC进一步纯化,乙腈-0.1%甲酸水(25∶75)为流动相,得到化合物13(20.0 mg)。
1.3.2 活性评价
LX-2细胞株用含10%胎牛血清和1%双抗(100 U/mL青霉素、100 mg/mL链霉素)的DMEM培养液在37 ℃,5% CO2培养箱中培养,以5×104/mL细胞密度均匀接种至96孔板,每孔加入100 μL细胞悬液。将实验分为三组:(A)空白组、(B)正常对照组、(C)TGF-β1+待测化合物(10 μmol/L)组,C组用TGF-β1(10 ng/mL)预处理,B组同时用PBS相同剂量处理。随后C组加入待测化合物(化合物用DMSO溶解,测试浓度为10 μmol/L),B组同时加入相同剂量DMSO,每组3个复孔,37 ℃,5% CO2,恒温培养48 h。向每孔加入10 μL CCK-8溶液,将培养板在培养箱内37 ℃,5% CO2培养40 min。用酶标仪测定其在450 nm处的OD值并按如下公式计算被测化合物对LX-2细胞的抑制率。
抑制率=
[(OD对照-OD试验)/(OD对照-OD空白)]×100%
2 结果与分析
2.1 结构鉴定
化合物1无色针状结晶(甲醇);改良碘化铋钾显色剂呈砖红色,提示其为生物碱类化合物;ESI-MS:m/z342.0 [M]+;1H NMR(400 MHz,CD3OD)δ:6.96(1H,d,J= 8.4 Hz,H-11),6.87(1H,s,H-4),6.72(1H,s,H-1),6.70(1H,d,J= 7.8 Hz,H-12),4.82(1H,d,J= 16.1 Hz,H-8),4.71(1H,dd,J= 9.9,5.9 Hz,H-13a),4.64(1H,J= 16.1 Hz,H-8),3.87(3H,s,3-OCH3),3.85(3H,s,10-OCH3),3.82(1H,m,H-6),3.59(1H,m,H-6),3.41(1H,dd,J= 18.5,5.7 Hz,H-13),3.15(1H,dd,J= 18.4,10.0 Hz,H-13),2.27(3H,s,NCH3),2.25(2H,m,H-5);13C NMR(100 MHz,CD3OD)δ:114.3(C-1),147.3(C-2),149.9(C-3),113.1(C-4,11),24.1(C-5),53.8(C-6),60.8(C-8),144.5(C-9),147.5(C-10),119.8(C-12),34.6(C-13),120.4(C-4a),114.3(C-8a),123.0(C-12a),67.1(C-13a),125.4(C-13b),56.7(3-OCH3),56.5(10-OCH3),50.9(NCH3)。以上数据与文献[11]报道基本一致,故鉴定为cyclanoline。
化合物2白色无定形粉末(甲醇);改良碘化铋钾显色剂呈砖红色,提示其为生物碱类化合物;ESI-MS:m/z308.1 [M+Na]+;1H NMR(400 MHz,CD3OD)δ:7.06(2H,d,J= 8.2 Hz,H-2′,H-6′),6.74(2H,d,J= 8.2 Hz,H-3′,H-5′),6.68(1H,s,H-5),6.63(1H,s,H-8),4.00(1H,dd,J= 9.4,4.0 Hz,H-1),3.82(3H,s,6-OCH3),3.17(1H,m,H-3a),3.10(1H,m,H-3b),2.83(1H,m,H-α),2.78(1H,m,H-α),2.74(1H,m,H-4a),2.70(1H,m,H-4b);13C NMR(100 MHz,CD3OD)δ:58.0(C-1),42.2(C-3),29.6(C-4),116.5(C-5),147.8(C-6),145.7(C-7),113.0(C-8),131.4(C-1′),131.3(C-2′,6′),114.1(C-3′,5′),157.2(C-4′),126.9(C-4a),130.5(C-8a),56.4(6-OCH3),41.4(C-α)。以上数据与文献[12]报道基本一致,故鉴定为coclaurine。
化合物3白色无定形粉末(甲醇);改良碘化铋钾显色剂呈砖红色,提示其为生物碱类化合物;ESI-MS:m/z246.0 [M+H]+;1H NMR(400 MHz,CD3OD)δ:9.45(1H,s,CHO),7.01(1H,d,J= 4.0 Hz ,H-3),6.91(2H,d,J= 8.4 Hz,H-2″,H-6″),6.66(2H,d,J= 8.4 Hz,H-3″,H-5″),6.20(1H,J= 4.0 Hz,H-4),4.48(2H,t,J= 7.2 Hz,H-1′),4.27(2H,s,H-6),2.91(2H,t,J= 7.3 Hz,H-2′);13C NMR(100 MHz,CD3OD)δ:133.3(C-2),126.4(C-3),111.2(C-4),144.9(C-5),56.4(C-6),49.6(C-1′),37.8(C-2′),131.0(C-1″),130.6(C-2″,C-6″),116.3(C-3″,C-5″),157.2(C-4″),180.9(-CHO)。以上数据与文献[13]报道基本一致,故鉴定为5-hydroxymethyl-1-[2-(4- hydroxyphenyl)-ethyl]-1H-pyrrole-2-carbaldehyde。
化合物4白色无定形粉末(甲醇);改良碘化铋钾显色剂呈砖红色,提示其为生物碱类化合物;ESI-MS:m/z194.0 [M+H]+;1H NMR(400 MHz,CD3OD)δ:6.62(1H,s,H-8),6.61(1H,s,H-5),3.98(1H,q,J= 6.8 Hz,H-1),3.80(3H,s,6-OCH3),3.21(1H,m,H-3a),2.94(1H,m,H-3b),2.83(1H,m,H-4a),2.68(1H,m,H-4b),1.41(3H,d,J= 6.8 Hz,1-CH3);13C NMR(100 MHz,CD3OD)δ:52.1(C-1),42.4(C-3),29.1(C-4),113.0(C-5),147.8(C-6),146.0(C-7),113.6(C-8),126.1(C-4a),132.4(C-8a),22.0(1-OCH3),56.4(6-OCH3)。以上数据与文献[14]报道基本一致,故鉴定为isosalsoline。
化合物5白色无定形粉末(甲醇);改良碘化铋钾显色剂呈砖红色,提示其为生物碱类化合物;ESI-MS:m/z208.0 [M+H]+;1H NMR(400 MHz,CD3OD)δ:7.36(1H,s,H-8),6.80(1H,s,H-5),3.90(3H,s,6-OCH3),3.59(2H,t,J= 6.8 Hz,H-3),3.10(3H,s,NCH3),2.93(2H,t,J= 6.7 Hz,H-4);13C NMR(100 MHz,CD3OD)δ:167.2(C-1),49.6(C-3),28.2(C-4),110.8(C-5),152.5(C-6),146.5(C-7),115.1(C-8),132.7(C-4a),122.7(C-8a),56.5(6-OCH3),35.5(NCH3)。以上数据与文献[15]报道基本一致,故鉴定为thalifoline。
化合物6白色无定形粉末(甲醇);改良碘化铋钾显色剂呈砖红色,提示其为生物碱类化合物;ESI-MS:m/z194.1 [M+H]+;1H NMR(400 MHz,CD3OD)δ:7.35(1H,s,H-8),6.83(1H,s,H-5),3.90(3H,s,6-OCH3),3.46(2H,t,J= 4.0 Hz,H-3),2.93(2H,t,J= 8.0 Hz,H-4);13C NMR(100 MHz,CD3OD)δ:168.7(C-1),41.2(C-3),28.6(C-4),111.1(C-5),152.8(C-6),146.6(C-7),114.8(C-8),133.6(C-4a),122.4(C-8a),56.5(6-OCH3)。以上数据与文献[16]报道基本一致,故鉴定为northalifoline。
化合物7白色无定形粉末(甲醇);改良碘化铋钾显色剂呈砖红色,其为生物碱类化合物;ESI-MS:m/z108.0 [M-H]-;1H NMR(400 MHz,CD3OD)δ:7.81(1H,dd,J= 3.2,1.0 Hz,H-6),7.12(1H,dd,J= 5.4,1.0 Hz,H-4),7.06(1H,dd,J= 5.4,3.2 Hz,H-5),2.39(3H,s,2-CH3);13C NMR(100 MHz,CD3OD)δ:147.9(C-2),154.6(C-3),123.4(C-4),123.6(C-5),138.9(C-6),18.5(2-CH3)。以上数据与文献[17]报道基本一致,故鉴定为2-甲基-3-羟基吡啶。
化合物8白色无定形粉末(甲醇);ESI-MS:m/z419.0 [M-H]-;1H NMR(400 MHz,CD3OD)δ:6.59(1H,s,H-5),6.38(2H,s,H-2′和H-6′),4.31(1H,d,J= 5.5 Hz,H-1),3.86(3H,s,8-OCH3),3.74(6H,s,3′,5′-OCH3),3.51(2H,m,H-3a),3.50(2H,m,H-2a),3.38(3H,s,6-OCH3),2.70(1H,m,H-4),1.97(1H,m,H-2),1.63(1H,m,H-3);13C NMR(100 MHz,CD3OD)δ:42.3(C-1),48.5(C-2),40.9(C-3),33.6(C-4),107.8(C-5),147.7(C-6),139.3(C-7),148.7(C-8),126.2(C-9),130.2(C-10),138.9(C-1′),106.9(C-2′,C-6′),149.0(C-3′,5′),134.5(C-4′),66.8(C-3a),64.2(C-2a),56.6(6-OCH3),60.2(8-OCH3),56.8(3′,5′-OCH3)。以上数据与文献[18]报道基本一致,故鉴定为(+)-lyoniresinol。
化合物9白色无定形粉末(甲醇);ESI-MS:m/z389.2 [M+H]+;1H NMR(400 MHz,CD3OD)δ:5.82(1H,s,H-4),4.32(1H,d,J= 7.8 Hz,H-1′),3.85(1H,dd,J= 11.2,2.0 Hz,Hb-6′),3.66(1H,dd,J= 11.8,4.9 Hz,Ha-6′),3.34(1H,m,H-5′),3.27(1H,t,J= 9.8 Hz,H-4′),3.25(1H,t,J= 12.0 Hz,H-3′),3.14(1H,t,J= 8.2 Hz,H-2′),2.66(1H,J= 17.9 Hz,Ha-2),2.14(1H,d,J= 18.3 Hz,Hb-2),2.09(1H,m,Hb-7),2.04(3H,s,H-13),1.85(1H,m,Ha-7),1.78(1H,m,Hb-8),1.50(1H,m,Ha-8),1.25(3H,s,H-10),1.10(3H,s,H-12),1.02(3H,s,H-11);13C NMR(100 MHz,CD3OD)δ:43.1(C-1),51.1(C-2),201.0(C-3),126.7(C-4),171.8(C-5),79.4(C-6),34.7(C-7),33.0(C-8),78.3(C-9),22.1(C-10),24.4(C-11),24.0(C-12),22.0(C-13),104.3(C-1′),75.3(C-2′),77.9(C-3′),71.7(C-4′),78.4(C-5′),62.8(C-6′)。以上数据与文献[19]报道基本一致,故鉴定为icariside B5。
化合物10无色晶体(甲醇);ESI-MS:m/z196.8 [M-H]-;1H NMR(400 MHz,CD3OD)δ:7.36(2H,s,H-2,6),3.89(6H,s,3,5-OCH3);13C NMR(100 MHz,CD3OD)δ:121.1(C-1),108.4(C-2,6),148.9(C-3,C-5),142.1(C-4),56.9(3,5-OCH3)167.9(-COOH)。以上数据与文献[20]报道基本一致,故鉴定为丁香酸。
化合物11无色针状结晶(甲醇);ESI-MS:m/z174.8 [M+Na]+;1H NMR(400 MHz,CD3OD)δ:7.09(2H,J= 8.4 Hz,H-2,6),6.73(2H,d,J= 8.5 Hz,H-3,5),3.49(2H,s,H-7);13C NMR(100 MHz,CD3OD)δ:126.8(C-1),131.4(C-2),116.2(C-3),157.4(C-4),116.2(C-5),131.3(C-6),41.1(C-7)176.2(C-8)。以上数据与文献[21]报道基本一致,故鉴定为对羟基苯乙酸。
化合物12无色针状结晶(甲醇);ESI-MS:m/z138.2 [M-H]-;1H NMR(400 MHz,CD3OD)δ:7.88(2H,d,J= 8.7 Hz,H-2,6),6.82(2H,d,J= 8.7 Hz,H-3,5);13C NMR(100 MHz,CD3OD)δ:122.8(C-1),133.0(C-2,6),116.0(C-3,5),163.4(C-4),170.1(-COOH)。以上数据与文献[22]报道基本一致,故鉴定为对羟基苯甲酸。
化合物13浅黄色粉末(甲醇);ESI-MS:m/z165.2 [M-H]-;1H NMR(400 MHz,CD3OD)δ:7.07(2H,d,J= 8.4 Hz,H-2,6),6.72(2H,d,J= 8.4 Hz,H-3,5),3.66(3H,s,8-OCH3),3.52(2H,s,H-7);13C NMR(100 MHz,CD3OD)δ:126.3(C-1),131.3(C-2,6),116.3(C-3,5),157.6(C-4),40.9(C-7),174.6(C-8),52.4(8-OCH3)。以上数据与文献[23]报道基本一致,故鉴定为对羟基苯乙酸甲酯。
化合物1~13的结构见图1。

图1 化合物1~13的化学结构Fig.1 Structures of compounds 1-13
2.2 化合物对LX-2细胞的抑制活性
检测了化合物1~13对LX-2细胞的抑制活性。在浓度为10 μmol/L时,化合物2、5、6、10~12对TGF-β1诱导的LX-2细胞增殖具有显著抑制作用,其抑制率分别为(90.72 ± 5.13)%、(49.14 ± 9.57)%、(90.23 ± 3.99)%、(75.81 ±7.19)%、(54.36 ± 10.84)%和(54.74 ± 11.87)%,其中化合物2的抑制作用最强。其余化合物对TGF-β1诱导的LX-2细胞增殖无抑制作用(见图2)。
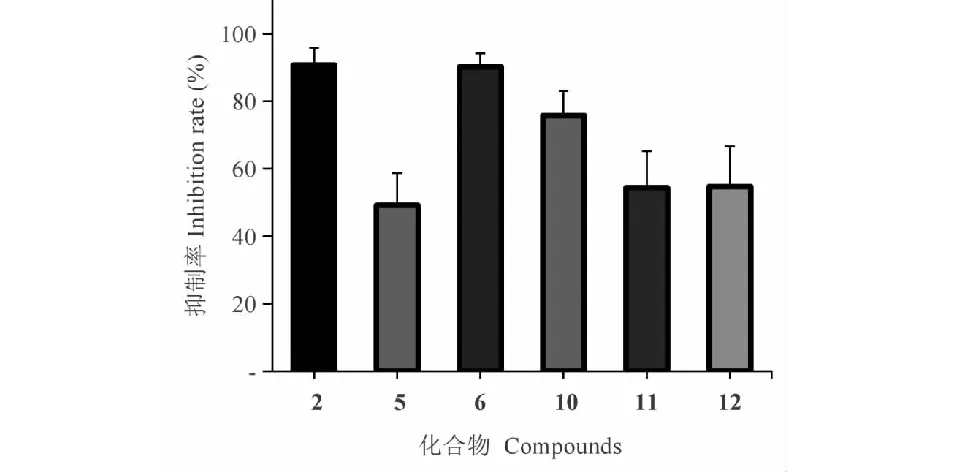
图2 化合物浓度在10 μmol/L时对LX-2细胞增殖的抑制活性(n = 3)Fig.2 The inhibitory activities of compounds on LX-2 cells at the concentration of 10 μmol/L ( n = 3)
3 结论
本研究从粉防己中分离鉴定得到13个化合物,其中有7个生物碱类成分,结构类型分别为原小檗碱类(1)、苄基异喹啉类(2)、异喹啉类(4~6)、吡咯类(3)和吡啶类(7)。化合物1~13均为首次从该植物中分离得到,在千金藤属植物中化合物3、4、6~9未见报道。前期研究发现粉防己中的成分具有显著地抗肝纤维化[6]作用,针对分离得到的化合物进行了抗肝纤维化活性评价。通过检测化合物对TGF-β1诱导的LX-2细胞增殖的影响,初步判断了化合物的抗肝纤维化活性,结果表明有6个化合物(2、5、6、10~12)对LX-2细胞增殖有显著抑制作用。本研究结果将进一步阐明了粉防己抗肝纤维化的药效物质,同时也为抗肝纤维化的先导化合物筛选提供参考。
