趋化素样因子1对肾癌细胞ACHN生物活性的影响及其相关机制
2023-01-14宣成睿塔拉王翠艳徐晓艳
宣成睿, 塔拉, 王翠艳, 徐晓艳
(1.内蒙古医科大学病理生理学教研室, 呼和浩特 010059; 2.内蒙古自治区人民医院泌尿外科, 呼和浩特 010017; 3.内蒙古医科大学病理学教研室, 呼和浩特 010059)
肾癌是泌尿系统肿瘤中仅次于膀胱癌的第二大致命癌症,占所有成人恶性肿瘤的5%[1]。2018年,国际癌症研究中心的数据显示:在全球范围内,肾细胞癌(renal cell carcinoma,RCC)是男性第六大最常诊断的癌症,在女性中排名第十,分别占所有肿瘤诊断的5%和3%[2-3]。肾细胞癌约占肾脏肿瘤的90%,其中85%为肾透明细胞癌。早期RCC 通常是无症状的,17% 的患者在诊断时已经远处转移。手术切除仍是临床局限性肾癌的有效治疗手段,但对于晚期肾癌,由于易发生骨转移和肺转移,并且RCC对常规治疗方式的敏感性较差,患者5年生存率不足10%[4]。在中国,肾癌的发病率呈逐年上升趋势,自回归移动平均模型分析显示:2025年肾癌死亡率将达到1.81/10万人,较2019年增加7.74%[5]。肾癌的患病率在逐年攀升,死亡率居高不下,但是肾癌致癌的分子机制仍不清楚[6]。基于早期诊断是降低患者死亡率的有效途径,明确肾透明细胞癌诊断相关的特异性生物标志物,变得尤为重要。
趋化素样因子1(chemokine like factor 1, CKLF1)是由北京大学首次成功克隆的一个细胞因子。该因子化学性质活泼,可对多种细胞如嗜中性粒细胞、单核细胞和淋巴细胞产生趋化活性[7]。CKLF1的高表达与肝癌、卵巢癌的发生以及不良预后相关[8-9],在肾癌中的作用目前未见相关报道。前期研究发现,CKLF1在肾癌组织中呈高表达状态[10],为进一步明确CKLF1对肾癌细胞生物活性的影响,现通过将质粒pEGF-N1-CKLF1转染肾癌细胞ACHN,实现CKLF1的过表达。观察CKLF1对肾癌细胞ACHN细胞周期、增殖以及凋亡的影响,并探讨其发生机制。
1 材料和方法
1.1 材料
人肾透明细胞癌ACHN细胞株购自北京协和医学院基础学院;真核细胞表达质粒pEGFP-N1-CKLF1及空载体pEGFP-N1由北京大学医学部免疫系韩文玲教授惠赠。MEM培养基、胎牛血清和胰蛋白酶购自Gibco公司。CCK-8试剂盒购自中国上海酶联生物科技有限公司; Cyclin D1、Bcl-xL、STAT3、P-STAT3、GAPDH一抗、二抗均购自Abcam公司。YF647A-AnnexinV 凋亡试剂盒购自宇恒生物公司。SF细胞系4D细胞核转染系统购自德国Lonza公司,细胞培养箱购自德国 Heraeus 公司;流式细胞仪购自美国 BD公司。IncuCyte系统购于美国 Essen BioScience 公司。
1.2 方法
1.2.1 分组
实验分为两组即对照组和实验组。对照组ACHN细胞转染pEGFP-N1质粒。实验组ACHN细胞转染pEGFP-N1-CKLF1质粒。
1.2.2 细胞培养
ACHN细胞培养根据说明书,采用MEM培养基加终浓度为10%胎牛血清,置于37 ℃含5% 二氧化碳的细胞培养箱内常规培养。
1.2.3 细胞转染
采用Lonza公司的细胞核转染技术,分别将实验组质粒pEGFP-N1-CKLF1和对照组质粒pEGFP-N1导入ACHN细胞的细胞浆和细胞核中。具体操作如下:将消化好的ACHN细胞,置于高压灭菌处理的1.5 mLEP管中,用100 μL Nucleofector电转液重悬将细胞,并将细胞数调整为1.0×106。将2 μg pEGFP-N1-CKLF1和2 μg pEGFP-N1真核细胞表达质粒,分别加入上述电转液中,充分混匀。将混匀后的溶液分别置于专用电转杯,调节电转条件及参数,进行电转。分别向电转完成后的各组细胞中加入400 μL含血清培养液,充分混匀,导入到加入2.5 mL含血清培养液的6孔板内进行培养。
1.2.4 转染效率检测
细胞转染后48 h,荧光显微镜拍照,观察绿色荧光蛋白表达情况,及表达CKLF1的细胞所占细胞总数比例,反映细胞的转染效率。
1.2.5 转染后 ACHN细胞增殖活性检测
将转染后的ACHN细胞悬液接种于96孔板,细胞密度6×103个/孔,在接种24、48、72 h后,每孔分别加入10 μL的CCK-8检测试剂,混匀后置于37 ℃5%CO2培养箱中孵育4 h,用酶标仪490 nm下检测样品吸光度值。
1.2.6 转染后 ACHN细胞周期检测
将转染后处于对数生长期的ACHN细胞用胰酶消化处理,置EP管中1 000 r/min离心5 min。弃上清,加入预冷的PBS洗涤一次,吸除PBS,缓慢滴入1 mL75%预冷乙醇。缓慢摇匀,置于-20 ℃冰箱固定4 h。取出固定好的细胞置于4 ℃离心机1 000 r/min离心5 min,弃掉乙醇。用预冷PBS液洗涤细胞两次,每次1 000 r/min离心5 min。之后弃上清,加入1 mL预冷PBS缓冲液重悬细胞,按试剂盒说明加入配好的碘化丙啶染色液,混匀避光30 min。上机前滤网过滤细胞,流式细胞仪检测细胞周期。
1.2.7 转染后ACHN凋亡检测
将转染后的肾癌ACHN细胞,分别接种于6孔板中。每组3个复孔,常规培养48 h后,根据试剂盒说明进行操作。将各组细胞消化,离心,用预冷的 PBS洗涤细胞,加入 500 μL 结合缓冲液重悬细胞,然后每组细胞各加入AnnexinV 和PI各5 μL,室温避光放置15 min,流式细胞仪检测各组细胞凋亡率。
Hochest染色:将灭菌后的盖玻片置于6孔板中,将转染后的肾癌ACHN细胞,接种于六孔板中,进行细胞爬片。48 h后,PBS冲洗细胞两次, 4%的多聚甲醛室温固定20 min。加入Hoechst 33258 染色液0.5 mL覆盖整个盖玻片,室温避光染色5 min。吸除染色液,PBS清洗一次。荧光显微镜下拍照。
1.2.8 western blot检测蛋白Cyclin D1、 Bcl-xL、STAT3、P-STAT3表达情况
将转染后的肾癌ACHN细胞,分别接种于6孔板中。48 h后,将RIPA细胞裂解液加入6孔板中,裂解细胞,裂解后进行总蛋白提取。使用酶标仪BCA法分别测定所提取的蛋白浓度。取30 μg蛋白加入 5×Loading Buffer,沸水中煮10 min,使蛋白质变性。常规SDS PAGE 凝胶电泳,转膜,5%脱脂奶粉封闭。加入cyclin D1一抗(1∶1 000), Bcl-xL一抗(1∶1 000),GAPDH 一抗(1∶5 000),STAT3(1∶1 000)、P-STAT3(1∶1 000),4 ℃过夜。洗膜后加入二抗(1∶10 000),使用Odyssey LI-COR红外成像系统收集荧光信号。
1.3 统计学分析
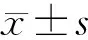
2 结果分析
2.1 细胞转染结果
荧光显微镜下观察结果显示,90%以上的细胞有绿色荧光蛋白表达,证明转染效率很好。如图1所示。

图1 质粒转染ACHN细胞48 h后表达情况Fig.1 Expression of ACHN cells 48 hours after plasmid transfection
2.2 转染后 ACHN细胞增殖活性检测
CCK8细胞增殖活性检测结果显示:与对照组相比较,转染24 h后,实验组的吸光度值与对照无明显差异,(P>0.05)转染48、72 h后,实验组吸光度值明显高于对照组(P<0.05),如图2所示。
*表示与对照组比较P<0.05图2 CCK8实验检测结果Fig.2 CCK8 experimental test results
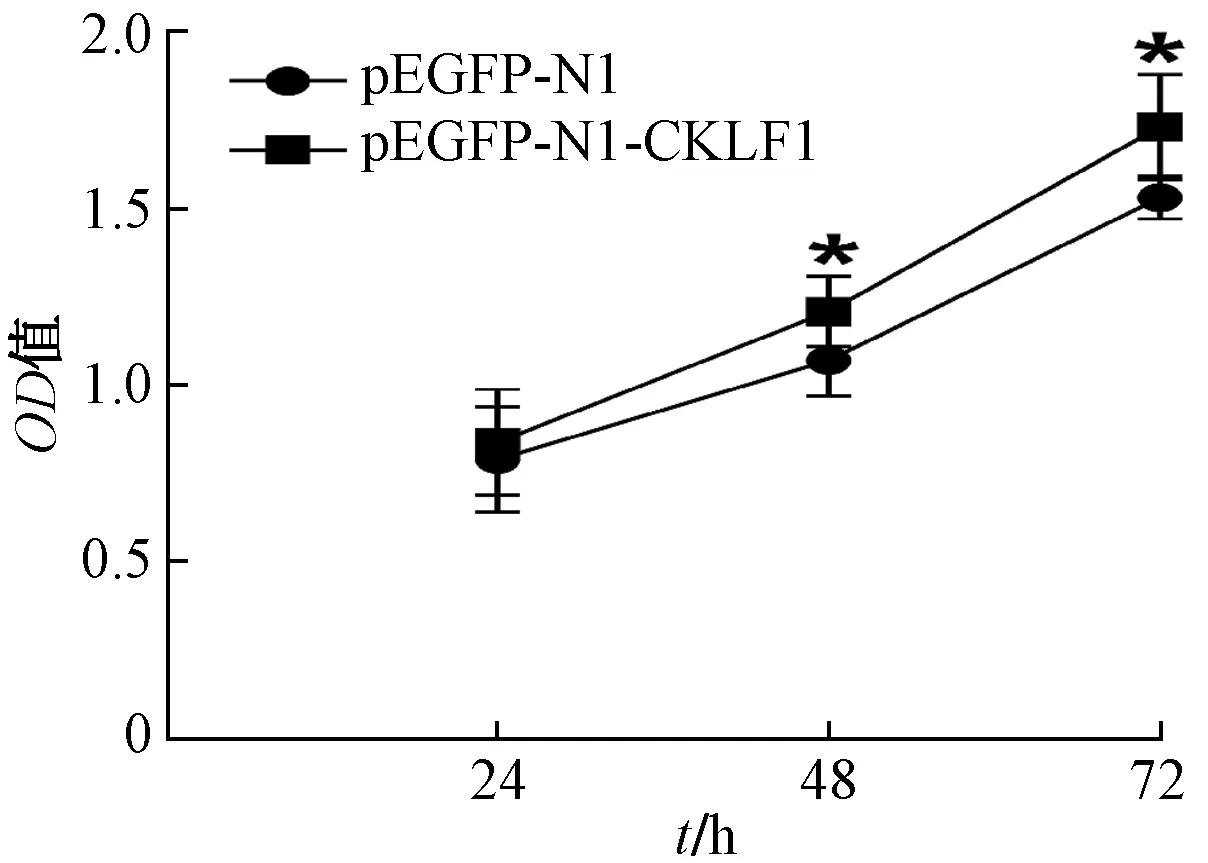
2.3 转染后 ACHN细胞周期
流式细胞术检测的细胞周期变化如图3所示。与对照组相比较,实验组细胞的增殖指数(perliferation index,PI)即G2+S期细胞所占比例明显高于对照组。如图4所示。
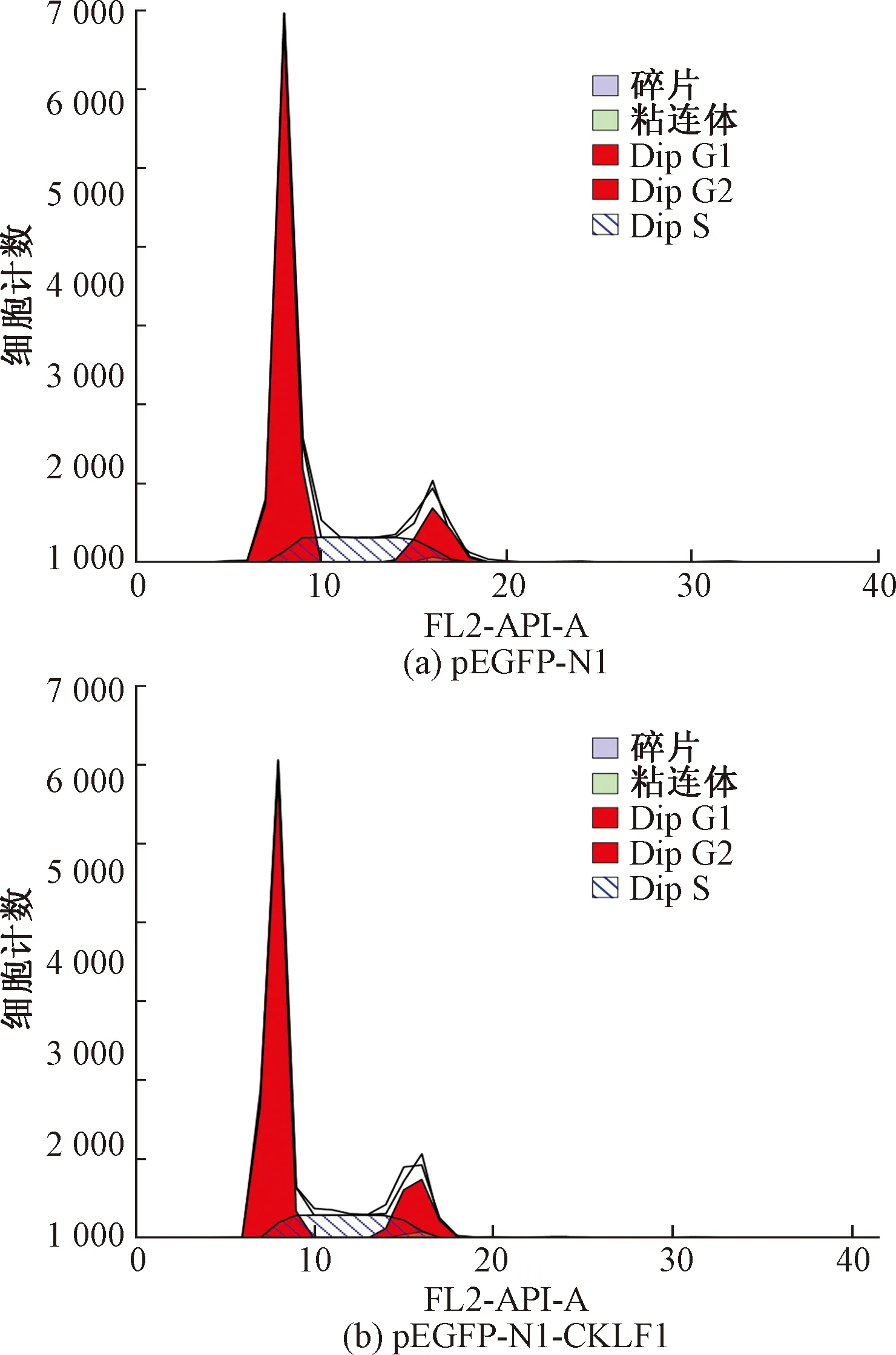
图3 转染48h后ACHN细胞周期变化情况Fig.3 Changes of ACHN cell cycle 48 h after transfection
*表示与对照组相比较P <0.01图4 ACHN细胞转染后增殖指数变化情况Fig.4 Changes of proliferation index of ACHN cells after transfection
2.4 CKLF1过表达对肾癌细胞ACHN凋亡的影响
Hochest染色结果显示:对照组与实验组细胞均呈淡蓝色荧光染色,非凋亡细胞核呈现荧光深浅不一的结构样特征,内有较深的蓝色颗粒;而凋亡细胞的细胞核由于浓集而呈亮蓝色,细胞核染色增强,荧光更为明亮,呈圆形或者固缩状、团块状结构。实验组细胞凋亡率明显低于对照组,如图5所示。
流式细胞的细胞仪检测结果显示:与对照组相比较,转染48 h后,实验组细胞的凋亡率明显低于对照组(P<0.05),如图6和图7所示。

红色箭头所指为凋亡细胞图5 Hochest染色细胞凋亡形态变化Fig.5 Hochest staining for morphological changes of apoptosis
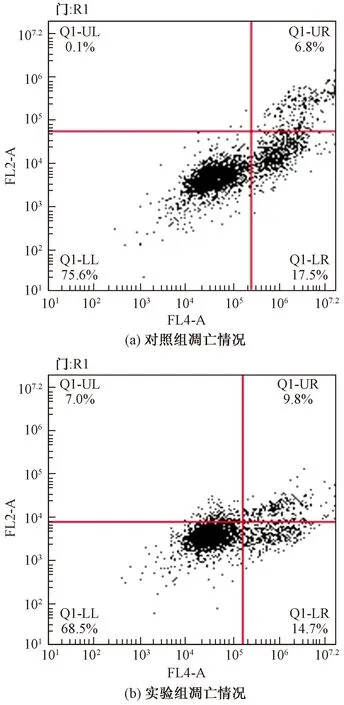
图6 流式细胞术检测转染后细胞凋亡情况Fig.6 Flow cytometry detection of cell apoptosis after transfection
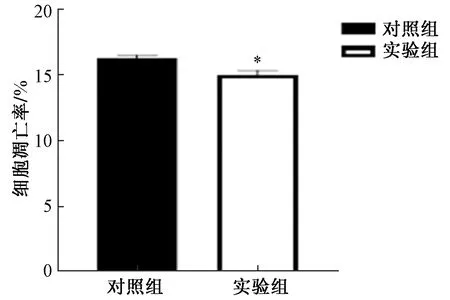
*表示与对照组比较P <0.05图7 转染后细胞凋亡率变化Fig.7 Changes in apoptosis rate after transfection
2.5 western blot 检测蛋白cyclin D1、 Bcl-xL、STAT3、P-STAT3表达情况
western blot结果显示CKLF1过表达48 h后,与对照组相比较细胞周期相关蛋白Cyclin D1表达量明显高于对照组,P<0.05(图8)。抑制凋亡的 Bcl-xL蛋白表达量与对照组相比较,明显升高P<0.05(图9)。STAT3蛋白相对表达量与对照组相比较,无明显差异(P>0.05),而与对照组相比较P-STAT3的相对表达量明显升高,P<0.05(图10)。

*表示与对照组相比较P<0.05图8 CKLF1对蛋白CycD1表达的影响Fig.8 The effect of CKLF1 on the expression of protein CycD1

*表示与对照组相比较P<0.05图9 CKLF1过表达对Bcl-xL蛋白表达的影响Fig.9 Effects of CKLF1 overexpression on Bcl-xL protein expression
3 讨论与结论
肾癌的发病率在世界范围内呈逐年上升趋势,发生 RCC 的终生风险在1.3%~1.8%。根据世界卫生组织提供的最新数据,每年有超过 14 万例肾细胞癌相关死亡病例[11]。目前临床治疗中尚无有效的早期诊断肾细胞癌的生物标志物,肾癌发病的分子机制尚不清楚。因此,更好地了解 RCC发生 的分子机制并制定有效的诊疗策略对患者来说至关重要。
正常情况下,机体通过神经、体液等机制,对体内一切细胞的增殖、分化、凋亡起着精确的调节作用。自主性增殖、凋亡受阻是肿瘤发生以及病程进展的关键。大量研究证实,细胞因子对肾癌发生、发展以及预后具有重要调控作用。肾细胞癌患者外周血浆中,细胞因子IL-22的异常表达有可能促进RCC的临床进展、细胞因子IL-22的表达水平可能与RCC的恶性程度相关[12]。细胞因子信号转导抑制蛋白3(suppressor of cytokine signaling 3,SOCS3)在肾透明细胞癌组织中表达下调,且与病理分期呈负相关[13]。胰岛素样生长因子 1受体(insulin-like growth factor 1 receptor,IGF-1R)与其相应的配体结合对肾透明细胞癌的增殖和进展起重要作用。在缺氧诱导因子1α(hypoxia inducible factor-1α,HIF-1α)和在缺氧诱导因子2α(hypoxia inducible factor-2α,HIF-2α)同时存在的情况下,缺氧诱导因子抑制因子(Factor inhibiting hypoxia-inducible factor-1,FIH-1)可以通过调节HIF-1α下游基因的表达来抑制肾癌细胞的增殖[14]。在对肾癌细胞的凋亡调控中:沉默趋化因子受体7(CXC chemokine re-ceptor 7,CXCR7)后,可抑制凋亡相关蛋白Bcl-2的表达,抑制肾癌细胞的凋亡[15]。微小RNA-93靶向大型肿瘤抑制因子2(large tumor suppressor 2,LATS2)调控肾癌细胞增殖及凋亡[16]。
通过质粒转染实现了CKLF1在肾癌细胞ACHN的过表达。CCK8实验结果显示,CKLF1可明显促进肾癌细胞的增殖。进一步检测的细胞周期变化也同样证实了这一结果。转染后,与对照组相比较,实验组肾癌细胞的增殖指数明显升高。CyclinD1在细胞周期调控系统中发挥重要的正调节作用。CyclinD1与其相对应的细胞周期蛋白依赖激酶结合,加速细胞周期进程,进而促进肿瘤细胞的增殖。因此,检测了转染48 h后CyclinD1蛋白表达水平的变化。Western blot结果显示,与对照组相比较,CKLF1明显促进了CyclinD1的表达,进而促进了细胞的增殖。与凋亡相关的检测结果显示:转染48 h后,与对照组相比较,实验组的细胞凋亡率明显减低,而凋亡抑制蛋白Bcl-xL 的表达明显升高,提示CKLF1过表达可抑制肾癌细胞的凋亡。
JAK-STAT信号通路由3个部分组成:接收信号的酪氨酸激酶相关受体、传递信号的酪氨酸激酶JAK和产生效应的转录因子STAT。STAT3是STAT 家族的成员之一,作为一种转录因子,STAT3可被多种细胞因子和生长因子激活,这些细胞因子和生长因子通过糖蛋白 130 (gp130) 发出信号。为响应这些信号,Janus 激活激酶 (JAK) 家族的成员在 Tyr705 处磷酸化 STAT3,使 STAT3 二聚化二聚体的形式进入细胞核内与靶基因结合,调控下游基因的转录,调节细胞的增殖、分化、凋亡过程。早期的研究表明, STAT3信号转导在多种肿瘤中发挥重要作用。对乳癌癌组织的研究显示,P-STAT3表达明显上调,EGFR 通过 STAT3 磷酸化和 JAK/STAT3 信号传导促进乳腺癌进展[17]。STAT3是人肝癌和结肠癌细胞保持活力、存活和迁移所必需。通过一种非肽类小分子 STAT3 抑制剂 LY5降低 STAT3 下游靶基因表达可诱导肝癌和结肠癌细胞凋亡[18]。此外STAT3激活增加与 RCC 中晚期转移性疾病和较差的存活率相关。这种增加的活性主要是由于生长因子和细胞因子信号传导增加形成[19-21]。CyclinD1 、Bcl-xL均是 p-STAT3 靶基因,CKLF1可刺激CyclinD1 、Bcl-xL蛋白表达, 因此可以推断,作为细胞因子之一的CKLF1可能通过此途径发挥其对增殖、凋亡的调控作用。Western blot结果显示:CKLF1过表达48 h后,与对照组相比较,JAK-STAT 信号通路的下游蛋白P-STAT3的表达水平明显升高,提示,CKLF1可能通过JAK-STAT3信号通路实现了其对肾癌细胞增殖和凋亡的调控作用。
趋化素样因子1过表达后,可明显促进肾癌细胞ACHN的增殖、抑制其凋亡,此效应可能通过激活JAK-STAT3信号转导通路实现。CKLF1在肾透明细胞癌的发生、发展中可能是重要的促癌基因,可作为肾透明细胞癌治疗的潜在靶点。
