马氏珠母贝TTLL基因的序列特征、SNP筛选及其与生长性状的关联分析
2023-01-14尹诗欣李志屿杨晶淼廖永山杨创业邓岳文王庆恒
尹诗欣,李志屿,杨晶淼,廖永山,杨创业,3,邓岳文,3,王庆恒,3
(1.广东海洋大学 水产学院,广东 湛江 524088;2.广东海洋大学 珍珠研究所,广东 湛江 524088;3.广东省珍珠养殖与加工工程技术研究中心,广东 湛江 524088)
微管蛋白酪氨酸连接酶样(tubulin tyrosine ligase-like,TTLL)是一类参与α-、β-微管蛋白翻译后修饰的酶,广泛分布于神经组织、胞质、纺锤体、中心粒、鞭毛和纤毛轴丝的微管内,特异性催化氨基酸与微管蛋白或其他底物的连接,该过程对于维持细胞形态、胞内物质运输、细胞周期、有丝分裂及细胞运动具有重要作用[1-4]。目前,在哺乳动物中已经有13种TTLL被报道[5]。Erck等[6]研究发现,敲除小鼠Musmusculus神经元中TTL,会严重阻碍其生长发育,甚至造成其死亡;而离体培养的神经元却表现出生长的异常加快和轴突的过早建立,说明其在生长发育过程中发挥重要作用。Pathak等[7]对斑马鱼DaniorerioTTLL基因研究发现,TTLL1在大脑神经元、TTLL4在肌肉及TTLL7在耳板中均有组织特异性表达;联合敲除TTLL3和TTLL6,会导致纤毛运动能力几乎完全丧失,并诱导多种轴突超微结构缺陷,说明该基因可能在纤毛运动及生长发育方面发挥作用。随着高通量测序技术在软体动物研究中的广泛应用,已发现在马氏珠母贝Pinctadafucatamartensii、长牡蛎Crassostreagigas、美洲牡蛎Crassostreavirginica和虾夷扇贝Mizuhopectenyessoensis等基因组序列中均注释到了TTLL基因,但对其具体功能及序列信息的研究尚未见报道。本课题组前期通过马氏珠母贝QTLs与2个近交家系(A:F1♀×F1♂,D:F2♀×F2♂)和2个杂交家系(B:F1♀×F2♂,C:F2♀×F1♂)的转录组结果进行关联分析,发现TTLL基因在杂交家系中表达量相对较高[8],暗示其可能参与马氏珠母贝生长发育过程。
马氏珠母贝是中国培育海水珍珠的主要贝类,广泛分布于中国南方沿海地区。近年来,由于海区环境的恶化及养殖群体性状的退化,严重影响了马氏珠母贝的产业化和规模化发展[9-10]。针对马氏珠母贝的产业发展现状,相关部门在扩大群体数量、保护优良遗传基因的同时,选育具有优良性状且适应海区养殖的新品种,是解决当前产业困境的有效方法之一。因此,深入研究影响马氏珠母贝经济性状的相关基因,对其产业的可持续发展具有非常重要的意义。本研究中,通过克隆并分析马氏珠母贝TTLL基因序列,利用实时荧光定量PCR技术检测其在不同组织、不同规格个体、不同家系个体及不同发育时期的表达水平,对该基因的外显子SNPs进行筛选,并分析其与生长性状间的关联性,以期为应用标记辅助选择改良马氏珠母贝生长等重要经济性状提供参考依据。
1 材料与方法
1.1 材料
选取广东省徐闻县大井村海区规格一致、生长旺盛和无病害的2龄马氏珠母贝10只,剪取闭壳肌、外套膜、性腺、足、鳃和肝胰腺,经液氮速冻后保存于超低温冰箱中,用于分析TTLL基因在不同组织中的表达。同批培育的马氏珠母贝分为大规格和小规格个体2组,分别挑取20只,大规格贝壳长为(60.45±3.18)mm,小规格贝壳长为(48.38±3.68)mm,然后取其闭壳肌经液氮速冻后保存于超低温冰箱中,用于分析TTLL基因在不同规格个体中的表达。选取近交家系和杂交家系的2龄马氏珠母贝各20只,取其闭壳肌,经液氮速冻后保存于超低温冰箱中,用于分析TTLL基因在不同家系个体中的表达[8]。取马氏珠母贝的卵、受精卵、囊胚、原肠胚、担轮幼虫、D型幼虫、早期壳顶幼虫和眼点幼虫,经液氮速冻后保存于超低温冰箱中,用于分析TTLL基因在不同发育时期的表达。
1.2 方法
1.2.1TTLL基因全长的克隆 基于本实验室构建的马氏珠母贝转录组数据库[11],筛选注释为TTLL基因的基因序列,采用Primer Premier 6.0软件设计全长克隆引物及荧光定量引物(表1)。按照Trizol法说明书提取马氏珠母贝不同组织的总RNA,通过琼脂糖凝胶电泳及Nano Drop ND1000 紫外分光光度计分析RNA的纯度及浓度。按照SMART RACE cDNA Amplification Kit说明书制备5′RACE和3′RACE模板。利用RACE-PCR技术对5′端和3′端进行扩增,具体反应体系和扩增程序参照杨晶淼[8]的研究方法,获得PCR产物后,用琼脂糖凝胶电泳检测其完整性,用微量核酸分析仪检测其浓度,将目的片段经切胶回收纯化后,连接至pMD19-T载体上,再转化至E.coli-DH5α感受态细胞中,经菌液PCR验证呈阳性的克隆送至生工生物工程股份有限公司(广州分部)测序。

表1 TTLL基因克隆及荧光定量所用引物序列Tab.1 Primer sequence used in the cloning and Real-time PCR of TTLL gene
1.2.2 生物信息学分析 利用DNAMAN软件进行序列拼接及氨基酸序列推导;利用NCBI数据库中的ORF Finder软件预测开放阅读框ORF;采用PSITE V1软件分析氨基酸序列活性功能位点;采用SMART 软件预测蛋白结构域;采用ExPASy软件预测蛋白等电点、分子量和亲疏水性;采用TMHMM 2.0软件预测蛋白跨膜结构;采用SignalP 5.1软件预测是否具有信号肽;采用SOPMA软件分析蛋白主要的二级结构; 采用Phyre软件预测蛋白三级结构;采用Blastx软件在线同源性搜索比对,查找多个物种的TTLL氨基酸序列;采用ClustalW软件进行氨基酸多序列比对;采用MEGA 7.0软件,基于邻接法构建系统进化树。分析网站参照房晓宸等[12]和陈琨等[13]的方法。
1.2.3TTLL基因表达分析 通过实时荧光定量PCR检测TTLL基因在马氏珠母贝不同组织、不同规格、不同家系及不同发育时期的表达模式。qRT-PCR反应程序参照焦钰等[14]的方法。以β-actin作为内参基因,利用2-ΔΔCT法计算TTLL基因的相对表达量。
1.2.4TTLL基因SNP位点的筛选及分析 根据本课题组前期获得的马氏珠母贝“海选 1 号”(655个个体)和金黄壳色选育群体(193个个体)的全基因组重测序数据[15],筛选马氏珠母贝TTLL基因外显子区的SNP位点;采用PopGen32软件统计分析SNP位点的有效等位基因数(Ne)、观测杂合度(Ho)、期望杂合度(He)和哈迪-温伯格平衡(HWE)等遗传参数;采用PIC软件计算SNP位点的多态性信息含量;采用Haploview 4.2软件计算D′值和R2值,以及进行连锁不平衡分析;采用SPSS 24.0软件对不同单倍型的生长性状和突变位点与生长指标进行关联性分析。
1.3 数据处理
采用SPSS 24.0 软件分别对各组织、各发育时期及各家系中的表达量进行单因素方差分析,并用Duncan法进行组间多重比较,对大、小规格的表达量进行T检验,显著性水平设为0.05。
2 结果与分析
2.1 TTLL基因的序列和结构
利用DNAMAN软件将测序获得的结果与基因组Unigene序列进行比对,拼接获得马氏珠母贝TTLL基因cDNA全长为1 962 bp,其中,5′UTR长度为134 bp,3′UTR长度为191 bp,开放阅读框(ORF)为1 611 bp,编码536个氨基酸,polyA为26 bp(图1)。

5′UTR和3′UTR用小写字母表示;ORF用大写字母表示;带框核苷酸分别对应起始密码子(ATG)和终止密码子(TAG);黄色背景代表TTL结构域。5′UTR and 3′UTR are showed by letters; ORF are showed by capital letters; The boxed nucleotides correspond to the initiation codon (ATG) and stop codon (TAG); Yellow background represents the TTL domain.图1 马氏珠母贝TTLL的cDNA序列及其推导的氨基酸序列Fig.1 Full length cDNA and the deduced amino acid sequence of TTLL gene in pearl oyster Pinctada fucata martensii
PSITE V1软件预测显示,马氏珠母贝TTLL蛋白含有2个N-糖基化位点、2个cAMP与cGMP依赖蛋白激酶磷酸化位点、13个蛋白激酶C磷酸化位点、10个酪蛋白激酶Ⅱ磷酸化位点、2个酪氨酸激酶磷酸化位点、5个N-豆蔻酰化位点、2个异戊二烯基结合位点和5个微体C端信号序列。SMART分析显示,TTLL氨基酸序列靠近N端含有一个TTL结构域,位于第1位~第207位氨基酸上。经Blastx比对发现,马氏珠母贝、美洲牡蛎、长牡蛎、虾夷扇贝、紫贻贝Mytilusgalloprovincialis、欧洲扇贝Pectenmaximus、小家鼠和人Homosapiens等物种的TTLL氨基酸序列中均含有TTL结构域(图2)。

图2 不同物种TTL结构域比较Fig.2 Comparison of TTL structure domain in different species
2.2 TTLL蛋白的理化性质
采用ExPASy软件对马氏珠母贝TTLL蛋白进行分析,结果显示,该蛋白原子总量为8 824,分子结构式为C2 758H4 408N802O827S29,预测该蛋白理论等电点(pI)为7.91,相对分子质量为62 960。TTLL蛋白由20种氨基酸组成,其中,N端氨基酸残基为蛋氨酸(Met),亮氨酸(Leu)含量最高(10.4%),色氨酸(Trp)含量最低(0.4%);带负电荷的氨基酸残基(Asp+Glu)总数为83个,带正电荷的氨基酸残基(Arg+Lys)总数为85个;不稳定系数为67.51,被划分为不稳定蛋白;脂溶性指数与亲水性平均系数(grand average of hydropathicity,GRAVY)分别为80.21和-0.683。采用Signal P 4.1和TMHMM 2.0软件在线预测该蛋白的信号肽和跨膜结构域,均未发现。TTLL蛋白二级结构显示,α-螺旋占46.64%,无规则卷曲占32.84%,延伸链和β-转角分别占14.55%和5.97%。
2.3 TTLL氨基酸多序列比对
经Blastx比对发现,马氏珠母贝与长牡蛎、美洲牡蛎、紫贻贝、欧洲扇贝和虾夷扇贝等的TTLL氨基酸序列具有较高的同源性,其中,马氏珠母贝与长牡蛎的TTLL氨基酸序列一致性最高,达72.59%。采用ClustalW软件对TTLL氨基酸序列进行多重比对,结果显示,TTL结构域序列高度保守(图3)。
2.4 TTLL系统进化树
在NCBI上查找多个其他物种的TTLL氨基酸序列信息(表2),利用MEGA 7.0软件构建系统进化树(图4),结果显示,马氏珠母贝TTLL与长牡蛎等无脊椎动物的TTLL 聚为一大支, 脊椎动物的 TTLL聚为另外一大支, 这与传统的分类基本一致。这表明,与马氏珠母贝TTLL亲缘关系最近的是长牡蛎和美洲牡蛎,其次为紫贻贝、虾夷扇贝和欧洲扇贝。

表2 马氏珠母贝与其他物种TTLL氨基酸序列的同源性对比Tab.2 Homology alignment of TTLL amino acid sequence in pearl oyster Pinctada fucata martensii and other species
2.5 TTLL蛋白的高级结构
对马氏珠母贝和长牡蛎的TTLL蛋白进行三维结构预测(图5),结果显示,两者的结构主要是以无规则卷曲为主,其次是α-螺旋,且在结构上相似度较高,表明马氏珠母贝TTLL的高级结构保守。
2.6 TTLL基因的表达模式
qRT-PCR分析发现:TTLL基因在马氏珠母贝闭壳肌、足、外套膜、鳃、肝胰腺和性腺中均有表达(图6(a)),性腺中的相对表达量最高,且显著高于其他组织(P<0.05),其次是鳃;TTLL基因在大规格贝中的表达量显著高于小规格(P<0.05,图6(b));TTLL基因在马氏珠母贝发育早期表达差异较为显著(P<0.05),在卵和受精卵中的表达量显著高于其他发育时期(P<0.05),伴随着发育的进行,从原肠胚期到眼点幼虫期表达量比较平稳(图6(c));TTLL基因在杂交家系的表达量显著高于近交家系(P<0.05,图6(d))。
2.7 TTLL基因SNP位点的遗传多态性分析
在马氏珠母贝TTLL基因中共发现277个SNP位点,其中,109个SNP位点符合哈迪-温伯格平衡(P>0.05)。对这些SNP位点进行遗传信息分析,结果表明:Ne为1.001 2~1.986 5,平均值为1.141 9;Ho为0.001 2~0.514 2,平均值为0.108 1;He为0.001 2~0.496 9,平均值为0.104 9;PIC为0.001 2~0.373 3,平均值为0.092 5。PIC是衡量基因变异程度的指标,本研究中发现,6个位点为中度变异多态(0.25≤PIC≤0.5),103个位点为低度变异多态(PIC<0.25)(附表1)。通过Haploview 4.2软件对TTLL基因SNP位点进行连锁不平衡分析,结果发现,7对属于完全连锁不平衡(D′=1,R2=1),655对属于强连锁不平衡(0.8≤D′≤1,0.33≤R2≤1),3 675对属于弱连锁不平衡(D′<0.8,R2<0.33),34对属于连锁平衡(D′=0,R2=0)(图7)。

*表示保守的氨基酸; :表示强相似的氨基酸; .表示弱相似的氨基酸; 红色方框为TTL结构域。* indicates the conserved amino acid; : indicates strong similar amino acid; . indicates weak similar amino acid; red box represents the TTL domains.图3 马氏珠母贝与其他物种TTLL氨基酸序列的多重序列比对Fig.3 Multiple alignment of TTLL amino acid sequences between the pearl oyster Pinctada fucata martensii and other species

图4 基于邻接法构建的马氏珠母贝TTLL系统进化树Fig.4 Phylogenetic tree of TTLL amino acid sequences in pearl oyster Pinctada fucata martensii based on Neighbor-Joining

(a) A—闭壳肌,F—足,M—外套膜,Gi—鳃,Go—性腺,He—肝胰脏; (c) E—卵,Fe—受精卵,B—囊胚,G—原肠胚,T—担轮幼虫,D—D型幼虫,EU—早期壳顶幼虫,EL—眼点幼虫;(d)A—近交家系(F1♀×F1♂),B—杂交家系(F1♀×F2♂),C—杂交家系(F2♀×F1♂),D—近交家系(F2♀×F2♂)。标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)。(a) A—adductor muscle,F—foot,M—mantle,Gi—gill,Go—gonad,He—hepatopancreas; (c) E—egg,Fe—fertilized egg,B—blastula,G—gastrula,T—trochophore stage,D—D-shaped larvae,EU—early umbo larvae,EL—eye-spotted larvae;(d)A—inbred family(F1♀×F1♂),B—hybrid family(F1♀×F2♂),C—hybrid family(F2♀×F1♂),D—inbred family(F2♀×F2♂). The means with different letters are significantly different in the groups at the 0.05 probability level, and the means with the same letter are not significant differences.图6 马氏珠母贝TTLL基因相对表达量分析Fig.6 Analysis of relative expression level of TTLL gene in pearl oyster Pinctada fucata martensii
2.8 TTLL基因SNP位点与生长性状的关联分析
在马氏珠母贝TTLL基因外显子区域共获得37个SNP位点,其中,23个SNP位点与生长性状的相关性显著(P<0.05)。对外显子SNPs位点进行单倍块分析,发现 4个 SNP 位点形成了2个单倍块(图8)、5种单倍型(表3)。结合生长性状分析发现:Block1中单倍型 TG的壳长、壳高均显著高于单倍型CA(P<0.05),与单倍型TA无显著性差异(P>0.05);Block2中单倍型GG为优异单倍型,其壳长、壳宽、壳高、壳质量和总质量均显著高于单倍型AA(P<0.05)(表3)。再对TTLL基因突变位点进行分析,结果发现,4个位点(g.7572350 T>G、g.7572368 A>G、g.7572401 T>C、g.7572402 A>G)发生了错义突变,3个位点(g.7572405 C>T、g.7572414 T>C、g.7572438 A>T)发生了同义突变(表4)。结合表型进行关联分析发现,3个突变位点与生长性状显著相关(P<0.05)。位点g.7572350 T>G中,基因型GG的壳宽显著高于基因型GT和TT(P<0.05),其壳长和壳质量也显著高于基因型TT(P<0.05);位点g.7572368 A>G中,基因型GG的壳宽显著高于基因型AA和AG(P<0.05),其壳质量和总质量也显著高于基因型AA(P<0.05);位点g.7572405 C>T中,基因型CT的壳长和壳高显著高于基因型CC(P<0.05);而突变位点g.7572401 T>C、g.7572402 A>G、g.7572414 T>C和g.7572438 A>T与生长性状均无显著性差异(P>0.05)(表4)。

方框中颜色从白色到红色,代表连锁程度从低到高。The colors ranging from white to red represent the degree of linkage from low to high.图7 马氏珠母贝TTLL基因SNP位点的连锁不平衡分析Fig.7 Linkage disequilibrium analysis for the SNPs of TTLL gene in pearl oyster Pinctada fucata martensii

图8 马氏珠母贝TTLL基因外显子区域SNPs单倍块分析Fig.8 Haploblock analysis for the SNPs in the exon region of TTLL gene in pearl oyster Pinctada fucata martensii
3 讨论
3.1 马氏珠母贝TTLL基因的序列特征
本试验中,利用RACE技术成功获取马氏珠母贝TTLL基因全长,同时获得具有TTLL基因编码的氨基酸序列的特征基序,这些基序对应于具有ATP依赖性羧酸胺/硫醇连接酶活性的典型ATP/Mg2+结合位点,说明TTLL可能在软体动物发育过程中发挥重要作用[16]。其次,马氏珠母贝TTLL氨基酸序列无信号肽和跨膜结构域,无分泌或跨膜蛋白的重要特征;但其氨基酸序列含有2个cAMP与cGMP依赖蛋白激酶磷酸化位点、13个蛋白激酶C磷酸化位点、10个酪蛋白激酶Ⅱ磷酸化位点和2个酪氨酸激酶磷酸化位点等多个磷酸化位点。有研究表明,TTLL蛋白家族可通过磷酸化在多个位点进行翻译后修饰参与调控细胞周期,推测马氏珠母贝TTLL蛋白可能与哺乳动物TTLL蛋白一样,参与调控马氏珠母贝的细胞周期进程[17-19]。本研究表明,马氏珠母贝与长牡蛎TTLL氨基酸序列的一致性最高, 为 72.59%;进化树分析显示,马氏珠母贝与长牡蛎、美洲牡蛎、紫贻贝、欧洲扇贝和虾夷扇贝的TTLL氨基酸序列聚为一支,说明TTLL在双壳类动物进化过程中相对保守,且其TTL结构域在高级结构上高度保守,这与长牡蛎TTL结构高度相似,进一步说明该基因为TTLL基因。
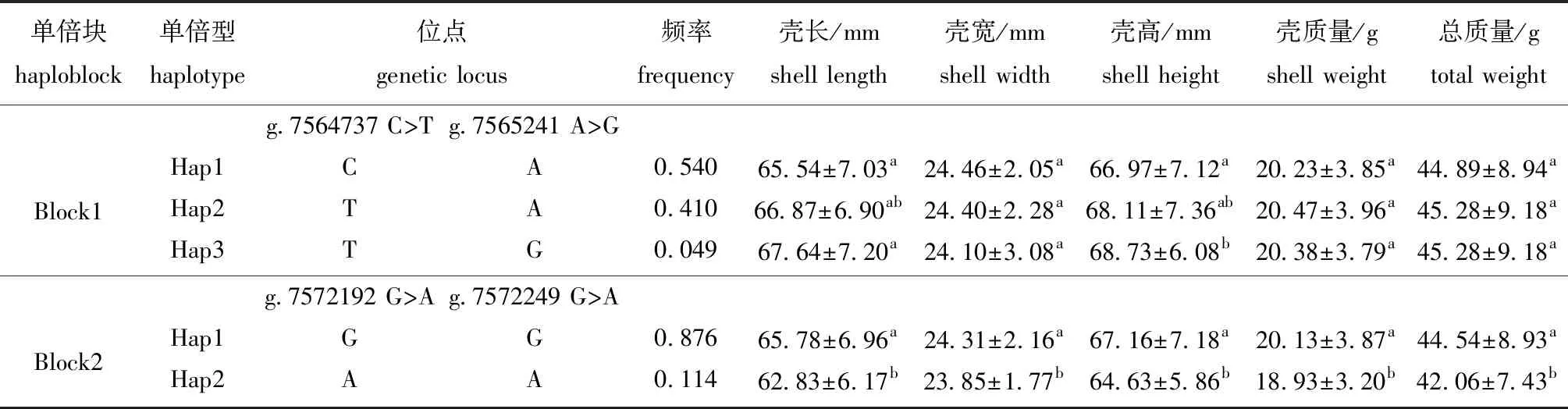
表3 马氏珠母贝TTLL基因单倍型与生长性状的关联性分析Tab.3 Correlation analysis of TTLL gene haplotype with growth traits in pearl oyster Pinctada fucata martensii

表4 马氏珠母贝TTLL基因突变位点与生长性状的关联性分析 Tab.4 Correlation analysis of TTLL gene mutation position with growth traits in pearl oyster Pinctada fucata martensii
3.2 TTLL基因的表达模式
有研究表明,TTLL蛋白参与调节神经发育、胞内运输、细胞分化和有丝分裂等生理过程[5, 7]。本研究中,对TTLL基因的组织表达分析发现,其在马氏珠母贝外套膜、闭壳肌、性腺、肝胰腺、鳃和足中均有表达,在性腺中的表达量显著高于其他组织,性腺作为软体动物的生殖器官,推测其可能在马氏珠母贝生长发育中担任着重要角色。有研究表明,马氏珠母贝生长性状候选基因EGFR(Epidermal growth factor receptor)在大规格个体组中的表达量显著高于小规格个体组[20],这与本研究中TTLL基因在大规格马氏珠母贝中的显著高表达一致,说明其对马氏珠母贝的生长过程具有重要作用。此外,本研究中检测了不同发育时期TTLL基因的表达量,结果显示,TTLL基因在马氏珠母贝卵细胞和受精卵中的表达量显著高于其他发育时期。有研究表明,TTL结构域通过对α-微管蛋白酪氨酸化影响细胞有丝分裂过程中的微管功能[21-22],由此推测,TTLL基因可能通过调控细胞繁殖或分化过程在马氏珠母贝生长发育过程中发挥重要功能。本研究中,利用近交和杂交家系材料分析发现,TTLL基因在马氏珠母贝杂交家系中显著高表达,这与本课题组前期研究马氏珠母贝生长相关基因(OSR1、NR5A2、TubB-4B和GPCR-84)在杂交家系中高表达的结果一致[8],进一步说明了TTLL在马氏珠母贝生长方面发挥重要作用。
3.3 TTLL基因SNP位点分析
SNP为第三代遗传分子标记技术,由于其具有遗传稳定性好、双等位基因分型和自动化分型等特性,因此,常用于遗传育种和图谱构建及性状关联分析[23-24]。一项基于GWAS的研究发现,多个与两种疾病均有显著关联的SNP位点,尤其是以位于16号染色体的3型β-微管蛋白基因(Tubulin beta 3 class Ⅲ,TUBB3)上的rs4785741位点为主,该基因与神经元迁移相关,是神经发育过程中的重要影响因子[25]。单倍型是若干个决定同一性状的基因组成的基因型[26],而单倍型分析在寻找和定位动植物重要性状方面具有重要作用,目前,大多通过数学建模的方式获得[27]。本研究中,利用 Haploview 4.2 软件对马氏珠母贝TTLL基因外显子区的SNP位点进行单倍型分析,结果显示,4个 SNP 位点形成了2个单倍块、5种单倍型。其中,单倍型GG为优异单倍型,其壳长、壳宽、壳高、壳质量和总质量均显著高于单倍型AA,说明该单倍型具有作为以各生长性状为目标的遗传育种标记的潜力,这为进一步培育马氏珠母贝的优良品种提供了基础资料。另外,基因外显子SNPs的突变可能会导致基因编码的蛋白发生结构功能的变化及调控基因表达,进而影响其表型性状[28-29]。于德财[30]在研究噪声敏感人群的全外显子区域时发现了6个突变位点,其中包括TTLL4 rs3731877,该突变在细胞的生长、繁殖和分化过程中具有重要作用。本研究中共发现了4个错义突变位点和3个同义突变位点,其中,3个突变位点与生长性状显著关联。位点g.7572350 T>G和g.7572368 A>G为错义突变,编码的氨基酸分别由色氨酸和蛋氨酸转变为甘氨酸和亮氨酸,其基因型GG的壳宽均显著大于其他两种基因型。该结果表明,这两个位点可能与马氏珠母贝的生长性状具有一定联系,且等位基因型G可能利于马氏珠母贝的生长。而位点g.7572405 C>T为同义突变,基因型CT的壳长和壳高均显著大于基因型CC。虽然同义突变不引起编码蛋白结构及活性等变化,但可能会影响基因转录从而影响蛋白功能,如mRNA编码序列的长度、结构和稳定性,以及tRNA翻译效率等[31],由此推测,g.7572405 C>T同义突变可能影响了马氏珠母贝TTLL基因的表达效率和翻译偏好性,进而影响蛋白转录后的修饰,形成不同生物活性的成熟TTLL蛋白,并造成了个体生长性状上的差异。这些位点基因型的突变对生物体的影响较大,因此,从中筛选出与生长性状(壳长、壳宽、壳高、壳质量或总质量)显著关联的分子标记,可为马氏珠母贝选育优良新品种提供分子工具和科学参考。
4 结论
1)采用RACE技术,首次从马氏珠母贝中克隆获得了TTLL基因cDNA全长序列为1 962 bp。
2)TTLL基因在马氏珠母贝性腺组织、大规格群体、卵细胞、受精卵及杂交家系中显著高表达,说明其在马氏珠母贝生长发育过程中发挥着重要作用。
3)TTLL基因的优异单倍型GG,以及突变位点g.7572350 T>G、g.7572368 A>G和g.7572405 C>T均有利于马氏珠母贝的生长,该结果对于选育具优良性状的马氏珠母贝具有重要实践意义。
