乳粉中金黄色葡萄球菌测定不确定度评定
2023-01-13顾晟琳夏亚文
顾晟琳,夏亚文,徐 琼
上海市质量监督检验技术研究院,上海 200233
0 引言
金黄色葡萄球菌(Staphylococcus aureus)属于葡萄球菌属,是革兰氏阳性菌,为一种常见的食源性致病微生物,可引发任何动物的中毒和感染。据2017—2019年福建省预包装食品中致病菌污染调查结果显示,金黄色葡萄球菌在多种食品中被广泛检出,包括肉制品、调味品、速冻米面等[1]。此外,乳制品也是金黄色葡萄球菌常检出的一大类食品类别[2~4]。
目前对于金黄色葡萄球菌的检测有诸多新技术。如利用多重聚合酶链式反应(Multiplex Polymerase chain Reaction,Multiplex PCR)方法,可同时检测婴幼儿配方奶粉中的金黄色葡萄球菌、沙门氏菌和克罗诺杆菌[5];应用环介导等温扩增技术可实现不同乳制品中金黄色葡萄球菌的实时监测[6];基于流式细胞术(Flow Cytometry,FCM)可以建立快速检测牛奶及奶粉中金黄色葡萄球菌的方法[7];金纳米粒子也可实现食源性金黄色葡萄球菌的检测[8]。虽然上述的检测方法比常规检测方法更简便、快速,但是在国际能力验证和国内盲样考核工作中,依然主要采用平板计数法对样品中的金黄色葡萄球菌进行定量验证[9,10]。
但目前已有多种因素,如稀释液温度[11]、试剂耗材、操作过程、仪器设备、人员及环境[12]、检测使用的培养基[13]等均会对最终的传统平板计数法的结果产生影响。因此对于金黄色葡萄球菌的平板计数法的不确定度研究,对于样品中微生物数量的估算准确性具有重要的意义。本文主要参考《GB 4789.10—2016食品微生物学检测 金黄色葡萄球菌检验》和《JJF 1059.1—2012测量不确定度评定与表示》,探讨了乳粉中金黄色葡萄球菌计数测定不确定度评定方法,以便为评价测定结果的准确性和可靠性提供技术依据。
1 材料和方法
1.1 材料
氯化钠(分析纯),国药集团化学试剂有限公司;Baird-Parker平板,广东环凯微生物科技有限公司;血琼脂平板、脑心浸出液肉汤、营养琼脂培养基、冻干血浆,北京陆桥技术有限责任公司。
1.2 主要仪器与设备
MS6001S十分之一电子天平,梅特勒-托利多国际贸易(上海)有限公司;SMI12生化培养箱,美国SHELLAB公司;LA2-6A1-E生物安全柜,新加坡ESCO公司;SX700高压蒸汽灭菌锅,日本TOMY公司。
1.3 试验方法
依据GB 4789.10—2016[14]第二法对质控样品进行测定。主要流程简述如下:称取质控乳粉25.0 g,加入225 mL无菌生理盐水中,混匀为1∶10样品均液。对此样品均液进行10倍梯度稀释,每次用移液管吸取1 mL上一个稀释度的样品均液,注入9 mL无菌生理盐水中,振匀,选择其中2~3 个连续适宜稀释度的均液进行后续加样涂布操作。加样时每个稀释度的样品匀液分别以0.3 mL、0.3 mL、0.4 mL(共计1 mL)接种3 块Baird-Parker平板,然后均匀涂布整个平板。涂布后,将平板于生物安全柜中静置10 min后翻转,于(36±1)℃倒置培养24~48 h。选择3 块菌落总数合计在20~200 CFU之间的一个稀释度的平板进行典型的金黄色葡萄球菌菌落计数。由一位人员对同一质控奶粉样品进行6 次重复定量试验。
2 结果和分析
2.1 不确定度的主要来源分析
根据GB 4789.10—2016中第二法平板计数法,分析不确定度来源有样品的均匀性以及稳定性、取样体积以及重复性、稀释体积、培养时间以及温度、测试环境的条件、人员的操作过程以及计数差异等因素,主要分析样液制备、稀释、加样体积以及重复性试验的不确定度,其他因素在此忽略。
2.1.1 样液制备引入的不确定度(B类[15])
检测过程中使用的250 mL量筒、电子天平及检测环境温度变化的影响引入的不确定度,由检验证书数据计算可得。
2.1.2 稀释引入的不确定度(B类)
检测过程中使用的1 mL和10 mL刻度移液管及检测环境温度变化的影响引入的不确定度,由检验证书数据计算可得。
2.1.3 加样体积引入的不确定度(B类)
检测过程中使用的1 mL刻度移液管及检测环境温度变化的影响引入的不确定度,由检验证书数据计算可得。
2.1.4 重复性试验引入的不确定度(A类)
主要是由样品的重复测定造成的结果波动所引入。
2.2 数学模型
依据GB 4789.10—2016中第二法,检测金黄色葡萄球菌菌落数T值为式(1)

T-样品中金黄色葡萄球菌菌落数;
A-某一稀释度典型菌落的总数;
B-某一稀释度血浆凝固酶阳性的菌落数;
C-某一稀释度用于血浆凝固酶试验的菌落数;
d-稀释因子。
2.3 测量不确定度计算
2.3.1 样液制备引起的不确定度Urel(制备)
(1)电子天平称量值m称的不确定度
在称量25 g样品,制备样品匀液时使用电子天平引入的不确定度,来源为:①天平示值误差:由检定证书给出的允差为±0.5 g,按均匀分布考虑,②重复性:由检定证书给出的允差为±0.5g,按均匀分布考虑,因此,
(2)250 mL量筒体积V量的不确定度
在量取225 mL生理盐水,制备样品匀液时使用量筒引入的不确定度,来源为:①体积:由检定证书给出的允差为±0.25 mL,按均匀分布考虑:②温度:温度变化的范围为±4 ℃,按均匀分布考虑:

(3)合成Urel(制备)
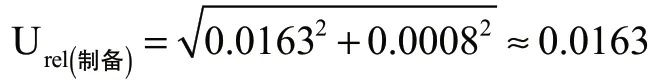
2.3.2 连续稀释引起的不确定度Urel(稀释)
在对样品匀液进行梯度稀释时,一般是用无菌吸管吸取上级样品均液1 mL,注入9 mL无菌生理盐水的试管中,因此对于连续稀释引起的不确定度Urel(稀释)主要涉及1.0 mL刻度移液管体积V1和10 mL刻度移液管体积V2两个方面。
(1)1.0 mL刻度移液管体积V1的不确定度
①体积:检定证书提供的数值(1±0.01 mL);

②温度:温度变化的范围为±4 ℃;
近似于矩形分布
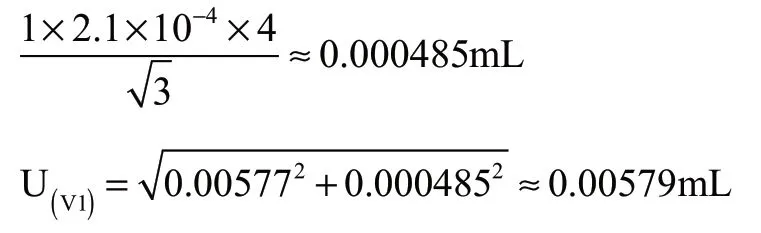
由1.0 mL刻度移液管体积V1引入的相对不确定度为:

(2)10 mL刻度移液管体积V2的不确定度
①体积:由检定证书给出的允差为±0.014 mL;
按均匀分布考虑:
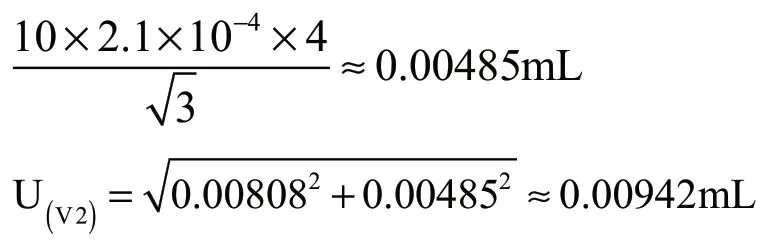
由10 mL刻度移液管体积V2引入的相对不确定度为

(3) 一次稀释产生的相对不确定度Urel(一次稀释),运用泊松关于微生物培养产生的不确定度定量测定理论中的公式进行计算:
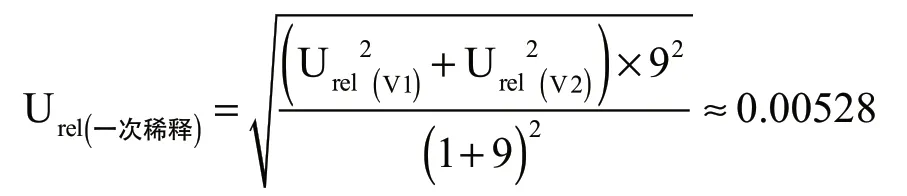

2.3.3 加样体积引入的不确定度Urel(加样)
加样时使用1 mL刻度移液管以0.3 mL、0.3 mL、0.4 mL接种3 块Baird-Parker平板,1 mL刻度移液管均用了3 次,主要包括2 次移取0.3 mL样品稀释液和1 次0.4 mL样品稀释液,引入的不确定度主要涉及1.0 mL刻度移液管体积的U(V1)。则加样时相对标准不确定度为:
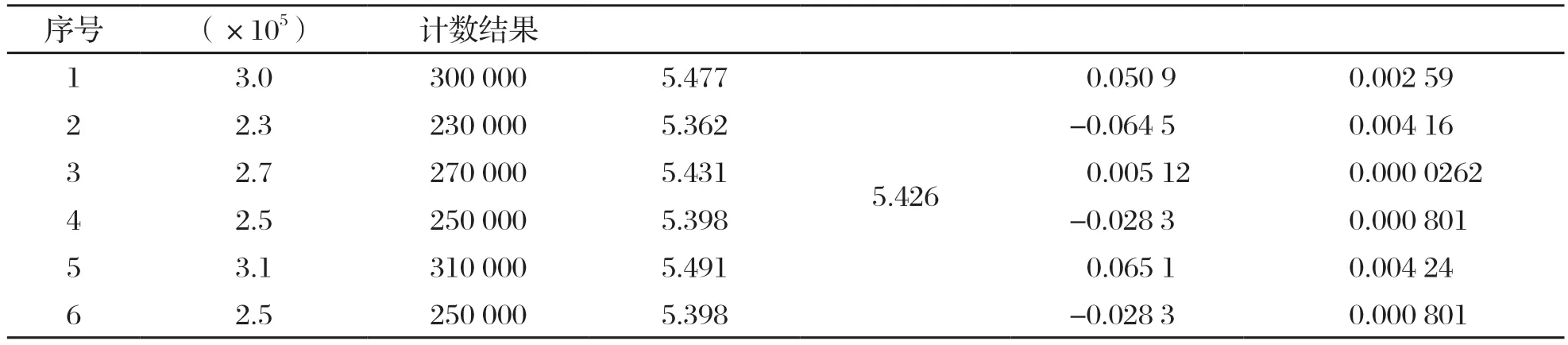
表1 同一质控样品6 次计数结果和计算值

2.3.4 同一样品重复性试验引起的不确定度评定Urel(R)
由一位检验人员对同一质控样品进行6 次重复计数实验,计数结果和计算值见表l。对6 次计数结果取对数,并对对数值进行均值和残差的计算,然后代入贝塞尔公式计算得出计数结果对数值标准偏差的合成样本标准差。

由于每个样品重复测定6 次,总体合成不确定度:
2.3.5 金黄色葡萄球菌平板计数的合成不确定度Urel和扩展不确定度U
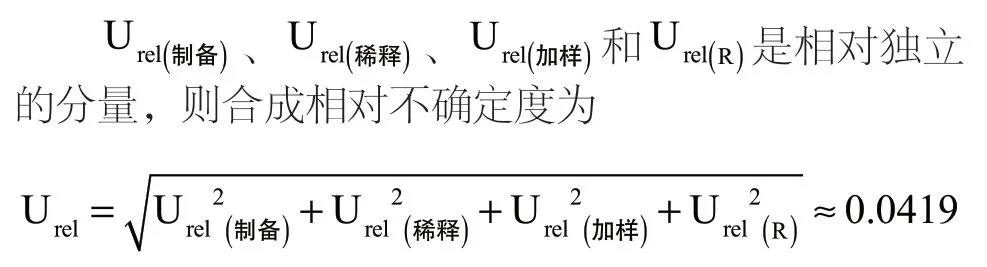
本次试验重复6 次,则自由度V=n-1=5,选择置信水平P=95%,根据t分布可知:k=t 95(5)=2.571
因此,扩展不确定度为:

2.3.6 结果报告
由于本次试验将检测结果取对数后进行不确定度计算,因此扩展不确定度针对的是测量结果的对数值,是以当检测结果以对数值的形式表示时,测试结果对数值的平均值为5.43,取值区间为5.43±0.108,即5.32~5.54;测试结果则以对数值的取值再取反对数所得,其取值区间为2.1×105~3.5×105CFU/g之间。
3 结论
本试验按照GB 4789.10—2016中第二法平板计数法的操作规程进行试验,探究的不确定度来源主要是样液制备、稀释、加样体积3 个B类不确定度以及重复性试验1 个A类不确定度。其中,重复性试验由1 位检验人员对同1 份奶粉质控样品进行6 次重复试验,主要探究对于1 份奶粉样品的检测结果的准确性。由于此次金黄色葡萄球菌重复性检测结果具有较大的偏离,不适合直接按照贝塞尔公式计算,因此本试验在金黄色葡萄球菌计数的测量中采用取对数的方法对不确定度进行评定[16]。
经结果发现,由同1 位检验人员独立操作整个金黄色葡萄球菌检验过程时,其加样体积引入的不确定度较大,其次是重复性试验。因此,在试验时,尤其在日常的检测过程中,样品的测定必须严格控制试验条件,提高检验人员操作技能。此外还应多做平行试样,以确保实验数据的准确性。同时也确认了本研究建立的方法对于这类检验条件下金黄色葡萄球菌不确定的评定可行性。
