miR-23a-3p在脂多糖诱导的人肾小管上皮细胞中的表达及作用
2023-01-13许新杰葛勤敏
许新杰, 葛勤敏
(上海交通大学医学院附属新华医院急诊科,上海 200092)
脓毒症是一种危及生命的临床综合征,其发病特征是患者对感染的反应失调而引起的器官功能障碍,急性肾损伤(acute kidney injury, AKI)是脓毒症最严重的并发症之一,流行病学研究显示,脓毒症与50%的AKI密切相关[1]。脓毒症性急性肾损伤的发病机制是多因素和复杂的,涉及炎症、氧化应激、细胞凋亡和微血管功能障碍等[2]。有研究显示,脓毒症诱导AKI的主要特征可以通过将人肾小管上皮细胞(HK-2)暴露于脓毒症患者的血浆中来重现,因此肾小管上皮细胞的适应性改变和功能障碍可能是脓毒症性患者AKI发生的中心环节[3]。
本课题组前期研究发现,与正常健康人相比,miR-23a-3p在脓毒症性AKI患者的血清中表达水平明显下降[7]。本研究主要探讨miR-23a-3p在LPS诱导的人肾小管上皮细胞的表达变化及其作用,以期为后续靶向治疗脓毒症性AKI提供一些新的见解。
1 材料与方法
1.1 细胞系及主要试剂
人肾小管上皮细胞(HK-2)获自中国科学院典型培养物保藏委员会细胞库(上海);脂多糖(Lipopo-lysaccharide, LPS)购自美国Sigma-Aldrich公司生产的同一批次的大肠杆菌血清型O55: B5(货号: L2880);细胞培养使用的DMEM/F-12培养液和青霉素/链霉素购自美国Gibco公司,胎牛血清购自以色列Biological Industries公司;GAPDH、IL-6和p-NF-κB抗体购自美国Abcam公司,Cleaved Caspase-3抗体购自美国Cell Signaling Technology公司,泛素特异性蛋白酶5(Ubiquitin-specific protease 5, Usp5)抗体购自美国Santa Cruz Biotechnology公司;miR-23a-3p mimic购自中国上海吉玛基因公司,二抗辣根过氧化物酶(horseradish peroxidase, HRP)标记山羊抗小鼠抗体、HRP标记山羊抗兔抗体和细胞计数试剂盒-8(cell counting kit-8, CCK-8)购自上海碧云天生物技术有限公司;反转录试剂盒购自日本TaKaRa公司;TRIzol购自生工生物工程(上海)股份有限公司;NanoDrop 2000分光光度计购自美国Thermo Fisher Scientific公司。
1.2 细胞培养
在37 ℃、5%CO2的细胞培养箱中,使用含有10%胎牛血清和1%青霉素/链霉素的DMEM/F-12培养液培养HK-2细胞。当细胞生长状态良好且融合度达到80%左右进行1∶2传代,之后在6孔板中进行均匀铺板,然后采用0、1、5、10 μg/mL的LPS浓度梯度和0、3、6、12、24 h的时间梯度分别诱导HK-2细胞。
1.3 CCK8检测细胞活力
取生长状态良好的HK-2细胞制备成1×105/mL的细胞悬液,以每孔100 μL均匀铺于96孔板中。24 h 后细胞完全贴壁时换液,然后分别向各孔加入0、1、5、10 μg/mL的LPS处理HK-2细胞24 h,之后弃去96孔板原有培养液,每孔加入100 μL新鲜配制含10% CCK-8试剂的完全培养液,放回细胞培养箱等待1 h时取出。使用酶标仪(Bio-Rad,美国)检测每孔中450 nm波长处的光密度(D450)数值,计算每孔细胞的相对活力。
1.4 细胞分组和转染
将实验分为3组: 正常对照组、LPS+空白对照(NC)组和LPS+miR-23a-3p模拟物(mimic)组。LPS干扰浓度和时间为10 μg/mL 3 h。按照脂质体LipofectamineTM2000(Invitrogen)的说明书进行细胞的瞬时转染,转染前使用无双抗的细胞培养液将生长状态的良好的HK-2细胞接种至6孔板,当细胞融合度达到60%左右时转染miR-23a-3p mimic,5 h 后更换回完全培养基,转染后24 h时提取细胞的RNA,48 h收集细胞的蛋白,继续后续实验。
1.5 实时定量聚合酶链反应(qRT-PCR)
使用TRIzol试剂从细胞中提取总RNA,Nano-Drop 2000分光光度计测定RNA浓度和纯度,反转录试剂盒合成cDNA,其中常规RNA反转录条件为: 37 ℃ 15 min,85 ℃ 5 s,4 ℃保存;对于待测的miR-23a-3p采用茎环法[8],反转录条件则改为: 42 ℃ 15 min,85 ℃ 5 s,4 ℃保存。使用实时荧光定量PCR仪QuantStudio3进行cDNA扩增,扩增程序为: 95 ℃ 30 s,95 ℃ 10 s和60 ℃ 30 s 40个循环,最终使用2-ΔΔCT法对检测到的RNA量进行标准化,算出RNA的相对表达量。所有引物均由上海生工生物工程股份有限公司加工合成,见表1。
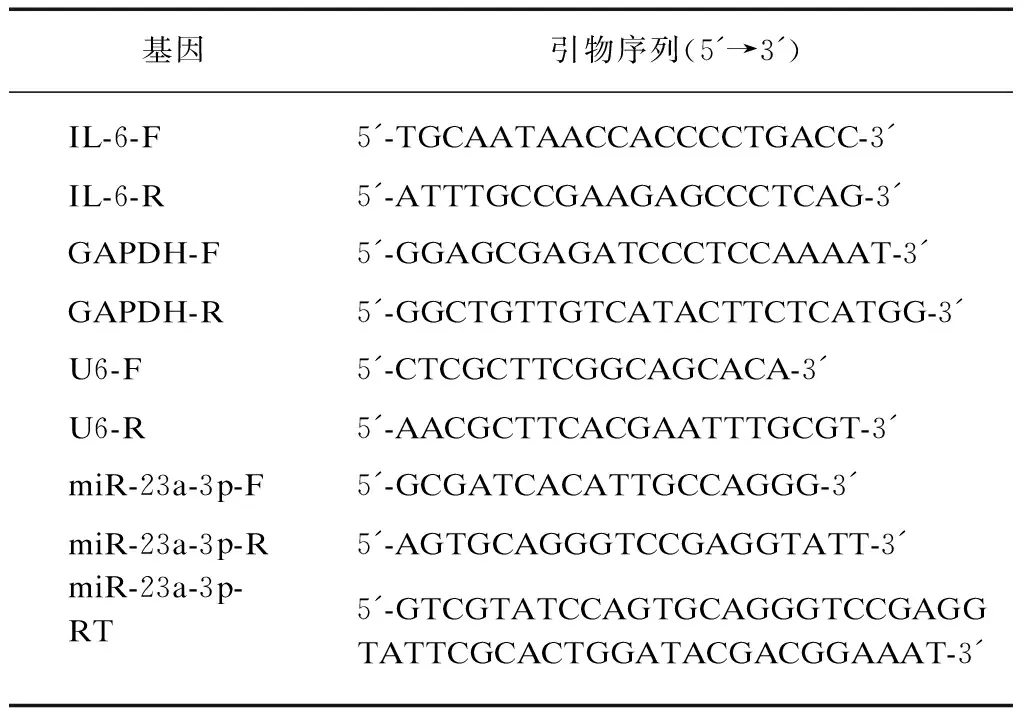
表1 引物序列
1.6 Western印迹法检测
首先将细胞分组中的完全培养基吸出,用磷酸盐缓冲液(phosphate buffer saline, PBS)清洗1次,然后加入含蛋白酶/磷酸酶抑制剂的冰冷放射免疫沉淀(radio immunoprecipitation assay, RIPA)缓冲液裂解,冰上孵育30 min。将裂解物在4 ℃下进行离心(15 000×g,5 min),然后收集上清液,加入速溶型蛋白上样缓冲液,100 ℃下变性5 min。12.5%的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离总蛋白,电泳将蛋白转移至聚偏二氟乙烯膜上(Millipore,美国)。用快速封闭液封闭10 min后,将膜与稀释的一抗在4 ℃下孵育过夜。然后TBST洗涤10 min,共3次,将膜与稀释的二抗室温孵育1 h,TBST再次洗涤10 min,共3次。ECL化学发光检测试剂盒观察蛋白质印迹条带,最终用Image J软件进行条带灰度分析及数据处理。
1.7 统计学处理
2 结 果
2.1 LPS对HK-2细胞活力和炎症水平的影响
CCK-8检测细胞活力显示,与正常对照组相比,不同浓度1、5、10 μg/mL的LPS处理HK-2细胞24 h后,HK-2细胞活力分别为86.33%±2.53%、71.09%±1.48%、61.04%±0.48%,随LPS浓度的增加而逐渐下降,差异有统计学意义(P<0.05),见图1A;而代表细胞炎症的IL-6 mRNA水平分别为1.75±0.05、2.72±0.32、4.21±0.61,随LPS浓度的增加而显著增加,差异有统计学意义(P<0.01),见图1B。将LPS处理HK-2细胞的干扰浓度定于10 μg/mL 的条件下,本研究检测了不同时间LPS处理HK-2细胞中IL-6 mRNA水平的表达差异,与正常对照组相比,LPS刺激3、6、12、24 h时,IL-6 mRNA水平分别为3.97±0.15、3.07±0.06、2.85±0.23、2.51±0.26,其中LPS刺激3 h时IL-6 mRNA达到高峰,随后逐渐下降,差异有统计学意义(P<0.01),见图1C,表明使用10 μg/mL的LPS诱导HK-2细胞3 h可以构建脓毒症性急性肾损伤的体外细胞疾病模型。
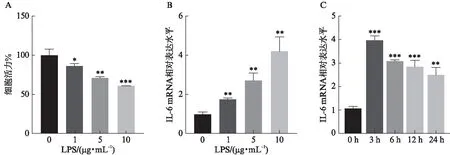
图1 LPS对HK-2细胞活力和炎症水平的影响Fig.1 The effect of LPS on HK-2 cell viability and inflammation level与正常对照组相比,*P<0.05;**P<0.01;***P<0.001;(n=3)
2.2 miR-23a-3p在LPS诱导的HK-2细胞中的表达
qRT-PCR检测细胞中miR-23a-3p水平的表达,与正常对照组相比,不同浓度(1、5、10 μg/mL)的LPS处理HK-2细胞24 h后,miR-23a-3p相对表达水平分别为0.70±0.05、0.54±0.06、0.49±0.02,HK-2细胞中的miR-23a-3p随LPS浓度的增加呈明显下降趋势,差异有统计学意义(P<0.01),见图2。
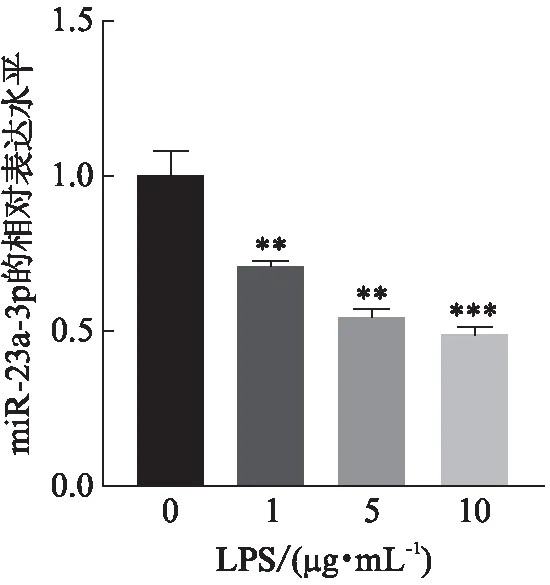
图2 miR-23a-3p在LPS诱导的HK-2细胞中的表达Fig.2 The expression of miR-23a-3p in LPS-induced HK-2 cell与正常对照组相比,**P<0.01;***P<0.001
2.3 miR-23a-3p对LPS诱导HK-2细胞炎症和凋亡的影响
使用10 μg/mL的LPS刺激HK-2细胞3 h,与正常对照组相比,LPS+NC组中的p-NF-κB和IL-6蛋白相对表达水平显著增加,差异有统计学意义(P<0.05),见图3A,同时伴随着凋亡相关蛋白Cleaved Caspase-3的增加,差异有统计学意义(P<0.05),见图3B,;而与LPS+NC组相比,LPS+miR-23a-3p mimic组的p-NF-κB、IL-6蛋白和Cleaved Caspase-3蛋白水平则呈现下降趋势,差异有统计学意义(P<0.05),见表2、图3。
表2 miR-23a-3p对HK-2细胞中蛋白相对表达水平的影响
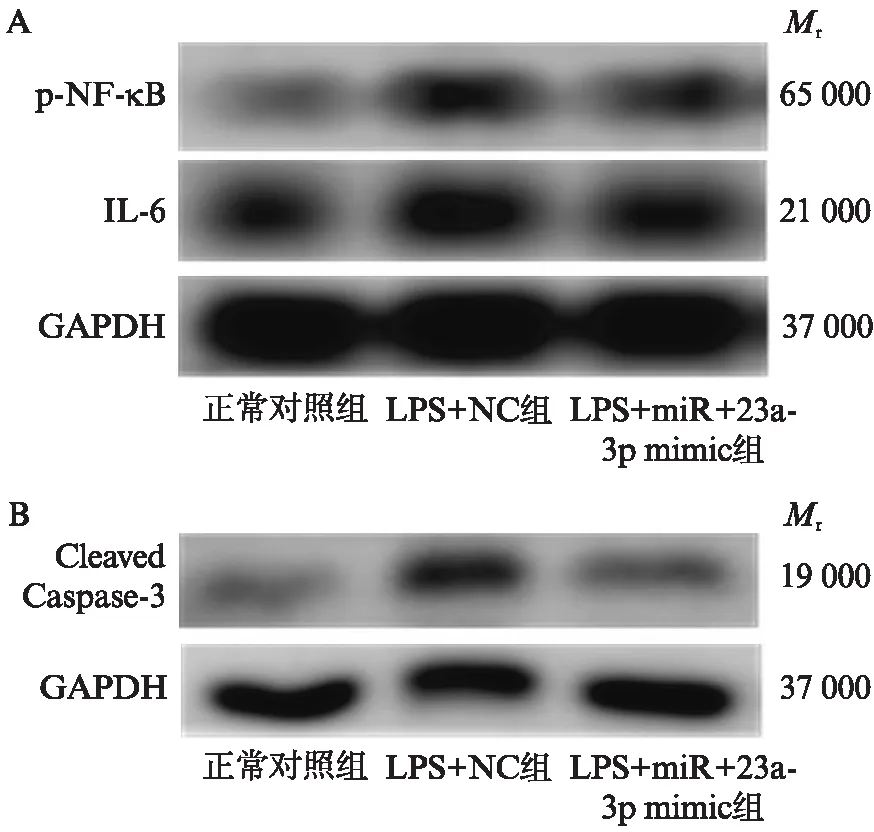
图3 miR-23a-3p对LPS诱导HK-2细胞炎症和凋亡的影响Fig.3 The effects of miR-23a-3p on LPS-induced inflammation and apoptosis in HK-2 cell
2.4 Usp5可能是miR-23a-3p作用的靶基因
通过生物信息学分析(www.targetscan.org)表明,Usp5是miR-23a-3p作用的靶基因之一,见图4A。同时与正常对照组相比,LPS+NC组中的Usp5蛋白的相对表达水平明显增加,差异有统计学意义(P<0.05);而与LPS+NC组相比,LPS+miR-23a-3p mimic组中的Usp5相对表达水平降低,差异有统计学意义(P<0.05),见图4B和表2。
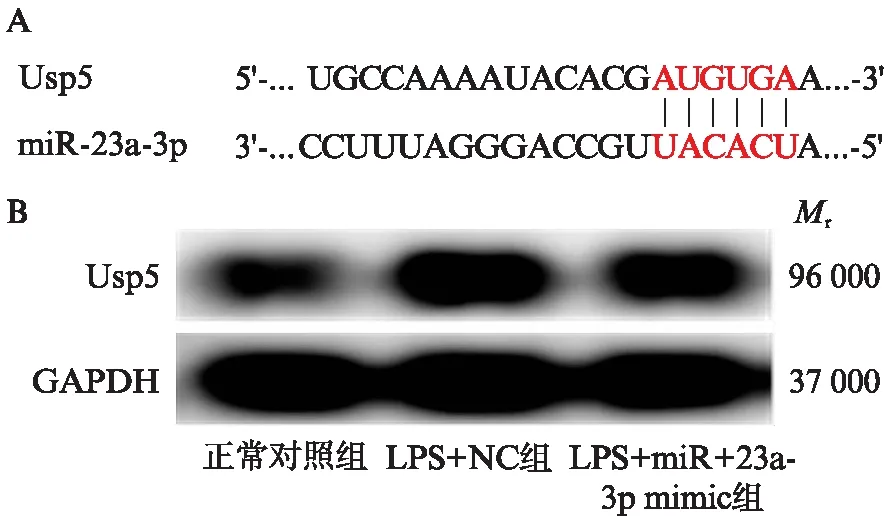
图4 Usp5可能是miR-23a-3p作用的靶基因Fig.4 Usp5 may be a target gene of miR-23a-3p
3 讨 论
LPS是革兰阴性菌细胞壁的一种成分,与脓毒症性AKI的发生密切相关,使用LPS诱导人肾小管上皮细胞常用于构建脓毒症性急性肾损伤的体外细胞疾病模型[9-10]。IL-6是一种典型的促炎细胞因子,具有功能多效性,与各种肾脏疾病的发病机制和进展密切相关[11]。研究发现IL-6不仅可以预测脓毒症患者AKI的发展和对肾脏替代治疗(RRT)的需求,还可以预测脓毒症性急性肾损伤患者的死亡率,因此炎症因子IL-6的变化成为本研究构建模型时检测的重点[12]。本研究发现,HK-2细胞的活力在随LPS浓度呈依赖式下降的同时,IL-6 mRNA代表的炎症水平随LPS浓度呈依赖式上调。值得注意的是,在LPS刺激HK-2细胞3 h时,IL-6 mRNA水平达到高峰,之后呈现随时间递减的趋势,猜测可能与HK-2细胞内部负反馈调节来适应LPS损伤有关。同时发现,在10 μg/mL LPS刺激HK-2细胞3 h时,p-NF-κB、IL-6和Cleaved Caspase-3的蛋白水平显著升高,提示HK-2细胞发生了炎症和细胞凋亡,这些细胞损伤的变化与脓毒症性AKI的主要发病机制相符合[2],表明脓毒症性AKI体外细胞疾病模型构建成功。
研究显示miR-23a-3p在多种疾病模型中发挥了对炎症和细胞凋亡的抑制作用,比如人脐带间充质干细胞衍生的小细胞外囊泡通过传递miR-23a-3p激活PTEN/AKT信号通路促进体外软骨缺损再生[13],与此靶向作用机制相一致,原代小鼠皮层神经元中miR-23a-3p水平的上调可以抑制依托泊苷诱导的细胞凋亡和炎症反应[14],同时miR-23a-3p还可以通过靶向早期生长应答因子1减弱糖尿病肾病中的炎性细胞因子和纤维化标志物的表达[15],但miR-23a-3p在脓毒症性急性肾损伤中是否也发挥着一定作用尚不明确。本研究发现,在LPS诱导的人肾小管上皮细胞的体外细胞疾病模型中,miR-23a-3p表达水平下降,这与本课题组前期在脓毒症性急性肾损伤患者血清中的发现结果一致[7]。进一步探究表明通过转染miR-23a-3p模拟物可以显著降低p-NF-κB、IL-6和Cleaved Caspase-3蛋白水平的表达,说明miR-23a-3p可以减轻LPS诱导人肾小管上皮细胞中的炎症和细胞凋亡水平,逆转细胞损伤。
Usp5是一种普遍表达的去泛素化酶,它已被证明与炎症、细胞凋亡、DNA修复和肿瘤细胞生长有关[16]。Usp5的表达与促炎因子的表达呈正相关,敲低Usp5可以抑制LPS诱导的人牙周膜干细胞的炎症反应[17]。有研究证实miR-23a-3p可以通过靶向抑制Usp5促进IKKβ的泛素化,从而阻断LPS损伤的小鼠肺上皮细胞中NF-κB信号通路,减轻细胞损伤[18]。本研究发现在LPS刺激的HK-2细胞中,Usp5蛋白表达水平升高,而转染miR-23a-3p模拟物可以降低其水平,提示miR-23a-3p发挥保护作用的靶基因可能是Usp5。
综上所述,LPS可以损伤HK-2细胞,降低细胞内的miR-23a-3p水平,而通过转染miR-23a-3p模拟物可以显著减轻细胞的炎症和凋亡水平,逆转了LPS诱导的细胞损伤,其作用机制可能与靶向抑制Usp5有关,后续需要进一步探究证实。
