机械敏感性离子通道Piezo1在循环系统疾病中的研究进展
2023-01-13陈翠申锷
陈翠 申锷
机械传导在循环系统发育、生理和疾病状态中起着关键作用。机械敏感性离子通道是机械传导系统的重要部分。Piezo1离子通道是一种真正的机械敏感性非选择性阳离子通道,负责感受细胞膜受到的机械力刺激如剪应力、牵张力,介导多种细胞的阳离子电流和Ca2+信号,如内皮细胞、红细胞、平滑肌细胞、上皮细胞、成骨细胞和心脏成纤维细胞,将机械刺激转化为电信号或化学信号[1]。Piezo1参与心脏、血管、淋巴系统的生理和病理生理,包括淋巴管发育、血管张力、动脉重构和心脏结构发育等。在此,我们对Piezol在心脏、血管、淋巴系统中的作用进行综述如下。
1 Piezo1结构和生物学效应
Piezo1、Piezo2离子通道是Piezo通道家族的两种亚型,由Ardem Patapoutian团队首次发现于小鼠神经母细胞瘤细胞系中,二者均表达于细胞膜上,分别由PIEZO1基因(family with sequence similarity 38A,Fam38A)、PIEZO2基因(family with sequence similarity 38B,Fam38B)编码,47%的PIEZO2基因序列与PIEZO1基因相同[2]。人PIEZO1基因、PIEZO2基因位于16号染色体的16q24.3区和18号染色体的18p11.22-p11.21区[3]。2015年,Ge等[4]首次解析了小鼠Piezo1蛋白结构,人Piezo1蛋白与小鼠的高度同源。人Piezo1蛋白是多重跨膜蛋白,由2 521个氨基酸组成,质量约300 KDa,有38个跨膜α-螺旋,包括外侧9组重复的四个螺旋,以及构成中心孔的两个螺旋[5](图1)。三个Piezo1蛋白组成一个离子通道,质量约1 MDa。Piezo1离子通道形似有三个旋臂的风扇,中间形成向内凹陷的中心孔,孔上方有一个细胞外C末端结构域。旋臂呈弧形弯曲,其外部区域高于中心孔区域,形成倒置的钟形凹陷,细胞膜受到机械力刺激后凹陷展平[6],中心孔增大,使离子通过。人Piezo1离子通道允许通过的离子包括一价离子(如碱离子、K+、Na+、Cs+)、二价离子(Ba2+、Ca2+、Mg2+、Mn2+)以及有机阳离子(四甲基铵、四乙基铵)[3]。机械敏感性是Piezo1离子通道的固有特性,不需要其他蛋白质或第二信使参与信号转导[7]。
目前,研究表明Piezo1是多种生理过程不可或缺的部分,参与血管发育与功能、红细胞变形、内皮细胞稳态、轴突生长、尿渗透压调节等[3]。Piezo1通道结构与功能异常可导致多种病理发生, 如淋巴水肿,主动脉瓣二叶瓣、胚胎血管重塑缺陷等。
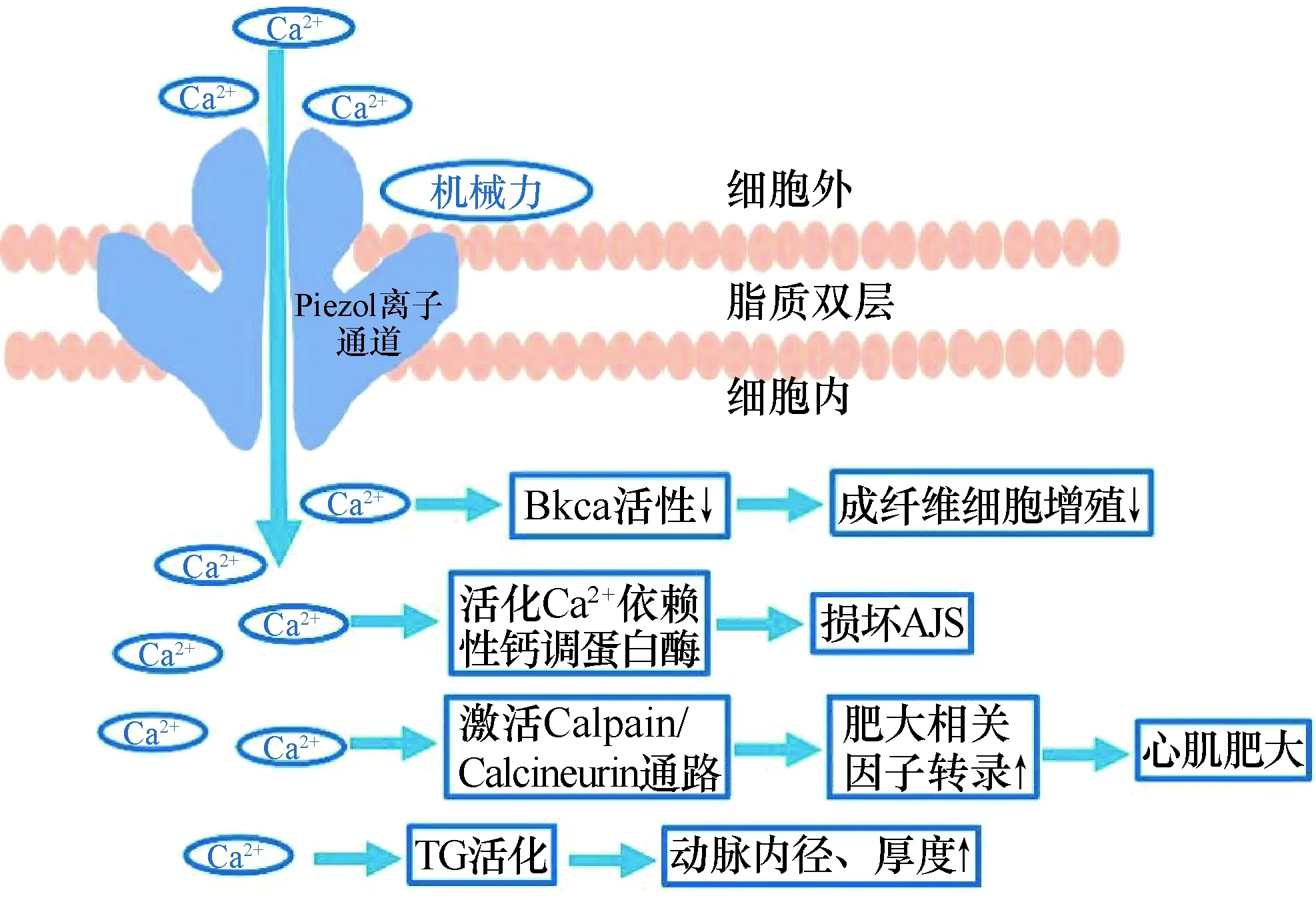
Piezo1感受机械力刺激后开放引起Ca2+内流,调节成纤维细胞增殖、内皮屏障完整性、心肌细胞肥大、阻力动脉重构图1 机械敏感性离子通道Piezo1的结构和功能
2 Piezo1与心脏疾病
2.1 心房颤动
心房颤动(atrial fibrillation, AF)是老龄化群体中发病率逐渐上升的一种室上性心律失常,重要表现之一是持续性心房扩张。随着AF病程延长,心房组织会发生明显的电重构和结构重构。心房肌细胞电重构的特点是动作电位及有效折返期缩短,并对心率变化的适应性减弱。心肌纤维化是AF相关性结构重构的显著特征之一,由心肌成纤维细胞过度增殖引起,亦可导致心肌电位传导减慢。由于牵拉刺激增强了对AF诱导的敏感性,机械过载可能促进AF的发生与维持。此外,快速牵拉心房组织会诱发局部动作电位、舒张期去极化电位变化,引起额外的收缩。在这种“机械-电反馈”过程中,心房细胞通过牵拉激活的离子通道(stretch activated channel,SAC)感知机械刺激并转化为电生理相关信号[8]。SAC也在人心房成纤维细胞中发挥作用,为了明晰AF时的SAC的具体功能,成纤维细胞与直接感受机械力的离子通道Piezo1则成为了代表性研究对象。
抑制大电导钙激活钾通道BKca电流可减轻成纤维细胞增殖程度[9]。Jakob等[8]研究发现正常人和持续性AF患者的心房成纤维细胞均可表达Piezo1和BKca离子通道。对正常成纤维细胞胞膜施加瞬时牵拉刺激可使Piezo1通道激活,在牵拉刺激消失后极短的时间内,即可记录到BKca通道的电流,但移除细胞外Ca2+或降低Piezo1活性均可引起BKca通道活性减低,进一步研究表明细胞膜受牵拉刺激后激活Piezo1通道,引起Ca2+内流并浓聚在BKca通道附近,激活BKca通道。与正常人相比,持续性AF患者心房成纤维细胞中的Piezo1活性和mRNA表达水平均增高,BKCa的表达水平虽无明显差异,但通道活性却下降。表明AF患者成纤维细胞上Piezo1调节BKca通道活性的方式与正常人不同(表1)。
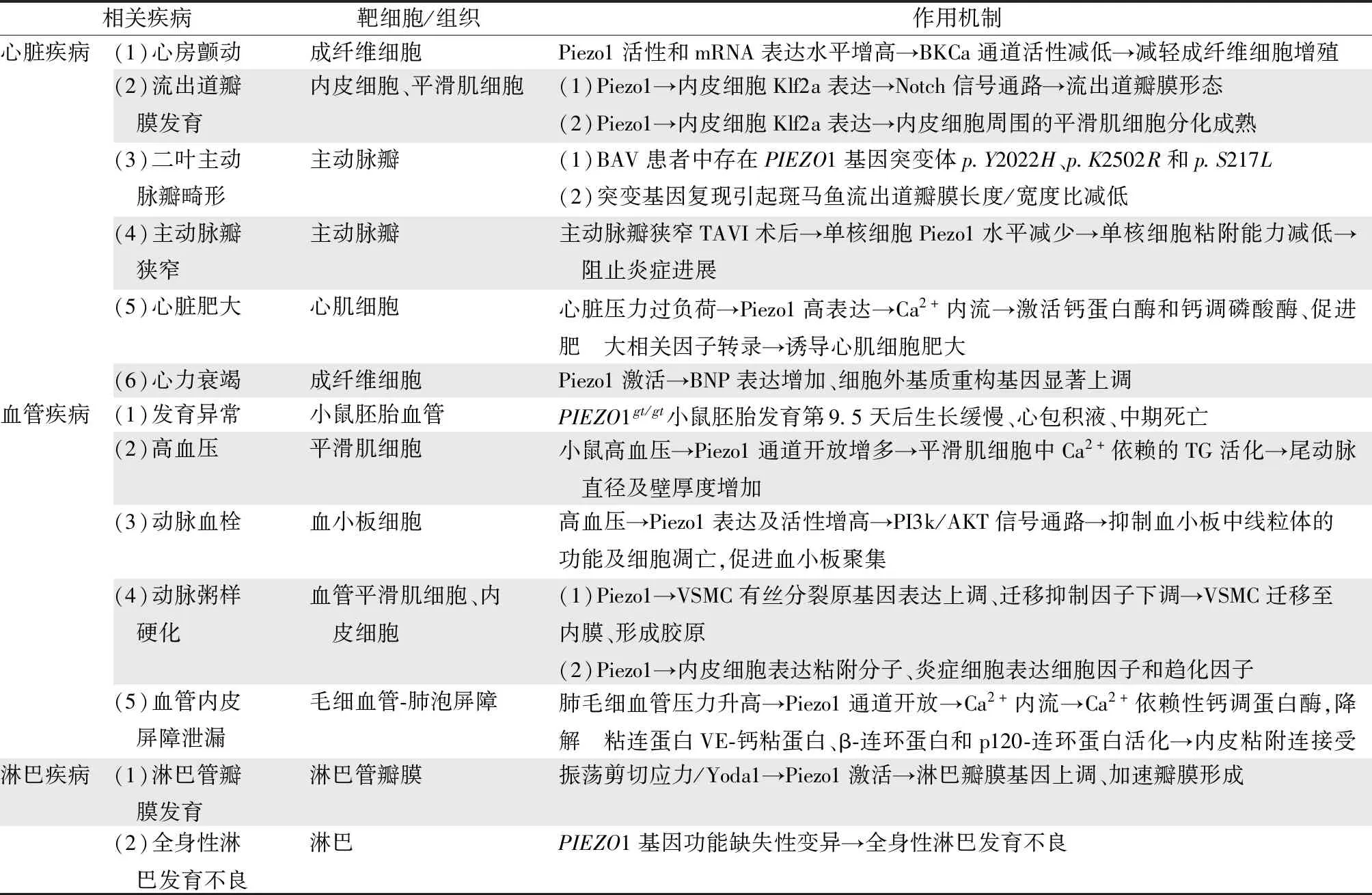
表1 Piezo1在循环系统疾病中的作用
2.2 心脏瓣膜发育与异常
心脏是胚胎发育过程中最先形成并发挥功能的器官,心脏瓣膜发育异常会导致不同程度的先天性心脏病。心脏流出道结构迅速发育并重构、形成包括主动脉瓣在内的各种心血管结构。遗传调节是影响瓣膜发育的重要机制,环境因素也参与心脏瓣膜发育的调节,如房室管中血流搏动产生的机械刺激。心脏细胞通过机械敏感离子通道感受机械刺激,并转化为细胞内信号,触发下游反应。目前已经明确机械敏感离子通道TRPV4和TRPP2协同促进房室管中Kruppel样转录因子2(Krüppel-like family of transcription factors 2,klf2a)的表达,促使瓣膜形成。Piezo1通道能够有效感知血流产生的剪应力,由此推测Piezo1与流出道结构发育、重构相关。
尽管哺乳动物和斑马鱼心脏在生理方面存在差异,但流出道的早期发育高度一致。斑马鱼心脏是单心房、单心室结构,含有三组瓣膜:流入道瓣膜、房室瓣、流出道瓣膜。其中流出道瓣膜形成与内皮细胞折叠、内皮细胞层周围的平滑肌细胞形成有关。Piezo通道是内皮细胞正确折叠的必要条件之一。Piezo1通道将机械力转化为流出道瓣膜的细胞内信号,通过调节内皮细胞Klf2a表达、平滑肌细胞Yap1定位,以及平滑肌细胞特异性标志物Elnb、Fn1表达,影响瓣膜发育及平滑肌细胞特征形成[10]。
Faucherre等[11]的研究也证实了Piezo1对斑马鱼心脏流出道及流出道瓣膜形成的必要性。研究人员在斑马鱼房室通道、流出道内皮细胞中发现了PIEZO1同源物-PIEZO1b。PIEZO1b缺失会导致斑马鱼流出道瓣膜发育缺陷。PIEZO1b突变胚胎的左室流出道内径变窄,而给予外源性PIEZO1RNA可挽救该缺陷。此外,研究团队在49名孤立性主动脉瓣二叶瓣(bicuspid aortic valve,BAV)患者的基因序列中发现了3个损害Piezo1蛋白功能的PIEZO1基因突变体:p.Y2022H、p.K2502R和p.S217L。复现此类突变可引起斑马鱼流出道瓣膜长度/宽度比减低,使瓣膜发育异常。
Piezo1不仅与瓣膜先天发育有关,也与后天病变相关。主动脉瓣狭窄(aortic stenosis,AS)是一种日益增多的退行性、炎症性病变。Baratchi等[12]研究表明AS介导增强单核细胞的炎症标志物表达水平、粘附能力及吞噬活性,促进主动脉瓣炎症进展。经导管主动脉瓣置换(transcatheter aortic valve implantation,TAVI)术后,AS患者主动脉瓣剪切力可显著降低,单核细胞膜上的Piezo1含量下调,单核细胞的粘附能力也减低,提示Piezo1可能是一个潜在的治疗靶点。
2.3 心脏肥大
心肌细胞肥大是心肌细胞对生理或病理性刺激的早期适应性反应,也是多种心血管疾病发病及死亡的独立危险因子,长期持续刺激会诱导心脏发生不可逆的失代偿性改变[13]。多种刺激可诱导心肌细胞肥大,机械应力过载是最重要的一个刺激因素。机械应力诱导心脏肥大与细胞内Ca2+稳态密切相关,Ca2+稳态失衡可激活并促进心肌细胞肥大相关因子转录[14]。瞬时受体电位通道(transient receptor potential channels,TRPC )、L型Ca2+通道(L-type calcium channel, LTCC)已被证明与病理性心脏肥大相关[15]。
鉴于Piezo1离子通道可敏锐地感知机械刺激并介导Ca2+内流,Zhang等[15]推测Piezo1离子通道参与机械负荷诱导心肌肥大的过程。研究发现,心脏压力过负荷引起心肌细胞T小管和闰盘上Piezo1水平显著升高。主动脉弓缩窄术后,与敲除PIEZO1基因的小鼠相比,未敲除基因的小鼠心脏体积明显增大、左室壁明显增厚,心肌纤维化程度、纤维化相关因子表达水平明显增加。Piezo1离子通道感知主动脉弓缩窄导致的心肌细胞膜受力变化,不仅提高Piezo1表达水平,还通过Ca2+内流激活钙蛋白酶和钙调磷酸酶,促进肥大相关因子转录,诱导心肌细胞肥大。敲除Piezo1基因后,Ca2+内流量减少,可延缓心脏肥大进程。表明Piezo1通道在心肌肥大进程中起重要作用(表1)。
2.4 心力衰竭
心力衰竭是多种心脏疾病发展的最终转归,预后不佳。心室重构是心衰发展的基本机制,过度的心肌纤维化是其重要病理改变。心力衰竭时,B型利钠肽(B-type natriuretic peptide,BNP)代偿性增多,通过利尿利钠、扩张血管、抑制胶原生成、抑制心肌纤维化等作用调节心室功能、压力负荷以及心室重构。心脏成纤维细胞受牵拉刺激后BNP的表达基因NPPB含量增加[16],但其具体机制尚不清楚。Ploeg等[17]研究发现成年大鼠接受Piezo1激动剂Yoda1处理后,BNP表达量增加,细胞外基质重构基因显著上调;沉默PIEZO1基因后,即使对心脏成纤维细胞施加牵拉刺激,BNP表达水平仍会下降。BNP可能起局部自分泌因子或旁分泌因子的作用,调节心脏成纤维细胞的激活和心肌组织重构。牵拉刺激还可引起心肌成纤维细胞Tgfb1、Tnc、Ctgf和Acta2基因表达,这些基因都与肌成纤维细胞分化和心脏重构有关。激活Piezo1可刺激Tnc基因表达;沉默Piezo1可上调未受牵拉的细胞中Ctgf基因表达水平,以及受牵拉细胞中Tnc和Acta2基因表达水平。证实Piezo1介导牵拉刺激引起心脏成纤维细胞表达BNP以及其它重构基因(表1)。
3 Piezo1与血管疾病
3.1 血管发育异常
哺乳动物胚胎的血管发育受血液流动产生的应力影响。正常小鼠心脏在胚胎发育第8.5天后开始搏动,将血液泵入新生的内皮网格,在第9.5天,剪切力驱动内皮细胞重构,成熟为大血管[18]。手术结扎小鼠胚胎的左弓形动脉阻止正常血液流动后,左弓形动脉会发生退化,而右侧的动脉扩张。虽然在成熟的血管内皮细胞中发现了可被牵张力和剪切力激活的离子通道,但胚胎发育过程中起作用的机械敏感性通道直到Ranade等[19]研究后才确定,该研究发现胚胎小鼠的血管内皮细胞表达Piezo1通道。在PIEZO1gt/gt(PIEZO1基因捕获)小鼠胚胎发育第9.5天,心率、血流均正常,背主动脉和心脏静脉也正常出现,表明在胚胎初始阶段,缺乏Piezo1不影响血管生成。但随后胚胎迅速表现出生长缓慢的现象,在第10.5天出现心包积液,并且大部分胚胎死于中期阶段,即第14.5天前,表明缺乏Piezo1引起小鼠胚胎中期血管重构缺陷,进而导致死亡。此外,即使在剪切力作用下,缺乏Piezo1也可引起内皮细胞应力纤维和细胞定位缺陷,表明Piezo1固有的机械敏感性与调节细胞形态相关,突出了哺乳动物胚胎发育过程中Piezo1在血管发育中的必要作用(表1) 。
3.2 高血压及其并发症
慢性高血压过程中,阻力动脉发生向心性重构,其管壁不增厚,但平滑肌细胞分布发生改变。小动脉内压力增高时,管壁发生强直性收缩,即肌源性反应,以保证血压波动剧烈时血流量维持在恒定水平。研究认为平滑肌细胞膜上的SACs开放是肌源性反应的触发机制。机械敏感性离子通道Piezo1在小动脉平滑肌细胞中高表达,Piezo1通道开放与肌源性反应的相关性也就成为了研究的对象。
Retailleau等[20]选择性敲除PIEZO1基因后,细胞不再表现牵张敏感通道的活性,表明Piezo1在动脉平滑肌细胞的机械力转导中起关键作用。细丝蛋白A(filamin A,FlnA)抑制Piezo1通道开放,高血压状态或FlnA缺失可使Piezo1通道开放量增多,引起小鼠尾动脉内径和动脉壁厚度增加。而敲除小鼠PIEZO1基因或长期使用转谷氨酰胺酶(transglutaminase,TG)抑制剂胱胺后,即使FlnA仍缺失,增厚的动脉壁也可被逆转变薄,由此推断Piezo1可能参与平滑肌细胞中Ca2+依赖的TG活化。表明在高血压或FlnA缺失情况下,平滑肌Piezo1在抵抗阻力动脉重构的过程中起关键作用。
近半数心血管疾病患者也遭受了严重的高血压并发症,这些并发症往往是血栓性的。高血压状态下,血栓形成前的最主要特征是血小板的异常激活[21]。血小板细胞通过感知血流动力异常,并内化这些信号自我激活。离子通道,如Piezo1,是血小板激活过程中最快,最有效的效应器之一,通过控制膜内外的离子流动来调节血小板生理反应。高血压时,血小板细胞膜上Piezo1离子通道表达水平及活性均增高,改善了血小板对VCAM1和纤连蛋白的粘附,从而活化整合素。研究表明Piezo1通过PI3k/AKT信号通路,抑制血小板中线粒体的功能及细胞凋亡,促进血小板聚集;而抑制Piezo1通道活性可明显减弱血小板的高反应性,提高血小板中的线粒体功能及细胞凋亡,从而可有效地抑制动脉血栓形成,减小高血压小鼠中风后的梗死面积[22]。
3.3 动脉粥样硬化
动脉粥样硬化(atherosclerosis,AS)是一种多因素炎症性疾病,可促进多种心血管疾病发生与发展,如心肌梗死、缺血性心脏病和卒中。研究发现粥样斑块多见于弯曲动脉及分支动脉处,此处的湍流剪切力促进AS的发生和发展。Shinge等[23]研究表明湍流状态下,血管内皮细胞Piezo1感知血流剪切力,介导上调血管平滑肌细胞(vascular smooth muscle cell,VSMC)有丝分裂原基因(如血小板衍生生长因子、内皮素1和血管内皮生长因子)表达,并下调VSMCs迁移抑制因子纤溶酶原激活物抑制剂1、细胞生长迁移抑制因子(如一氧化氮、转化生长因子β)表达水平及功能,促使VSMC迁移到内膜,产生胶原,促进纤维帽和脂质核心的形成。此外,Piezo1在炎症细胞如单核细胞、巨噬细胞和T细胞中表达并发挥作用[24]。Piezo1激活内皮细胞表达粘附分子、促进细胞附着,激活单核细胞和巨噬细胞启动促炎信号通路,表达不同的细胞因子和趋化因子[24],促进AS形成。而Piezo1缺失时,即使存在机械力刺激,巨噬细胞和单核细胞也不表达炎症细胞因子、趋化因子以及转录因子和缺氧诱导因子。证明Piezo1的存在对动脉硬化形成是必要的(表1)。
3.4 血管内皮屏障泄漏
肺泡上皮细胞和血管单层内皮细胞组成毛细血管-肺泡屏障,肺内液体的稳态取决于内皮屏障的完整性。内皮粘附连接(adhere junctions,AJs)由与β-连环蛋白、α-连环蛋白和p120-连环蛋白相关的跨膜粘附蛋白VE-连环蛋白组成, 是蛋白质和液体交换的主要细胞旁路,破坏AJs可使VE-连环蛋白的同型相互作用减少,从而增加内皮的通透性。肺毛细血管压力升高也可破坏内皮屏障,导致富蛋白质的血浆渗漏,引起肺水肿。研究表明[25],Piezo1可感知由左房压升高或主动脉缩窄引起的肺毛细血管压力升高,通道开放使Ca2+内流,活化Ca2+依赖性钙调蛋白酶,降解粘连蛋白VE-钙粘蛋白、β-连环蛋白和p120-连环蛋白,损坏AJs,增加肺血管通透性;而敲除内皮细胞的PIEZO1基因或抑制钙蛋白酶均可保护粘连蛋白及内皮粘附连接免于破坏,并且消除内皮屏障泄漏和肺水肿现象(表1)。
4 Piezo1与淋巴疾病
4.1 淋巴管瓣膜发育
淋巴系统控制组织液平衡、免疫细胞运输和脂质吸收。淋巴管瓣膜开放与关闭确保了淋巴液单向流动,瓣膜功能异常或结构畸形可明显损害液体引流、免疫反应以及肠道对脂质的吸收。类似于血液流动可通过Piezo1控制血管及瓣膜发育,淋巴液流动也可通过Piezo1控制淋巴管瓣膜发育。Choi等[26]发现淋巴管内皮细胞中的Piezo1可感知振荡剪切应力(oscillatory shear stress,OSS),并将信号整合到控制淋巴管瓣膜发育、维护瓣膜的基因程序中,敲除Piezo1基因可有效地抑制这一过程。使用Yoda1激活 Piezo1不仅可加速淋巴瓣膜的形成,也可触发体外培养的LEC中一些淋巴瓣膜基因的上调。无OSS作用时,异位过表达Piezo1可上调淋巴管瓣膜基因表达水平。使用泛内皮Cre驱动器 (Cdh5[PAC]-CreERT2) 或淋巴特异性Cre驱动器 (Prox1-CreERT2) 在特定时间敲除PIEZO1均可抑制新生小鼠淋巴瓣膜形成。此外,敲除成年小鼠淋巴管中的PIEZO1可导致大量淋巴管瓣膜退化。证明Piezo1是控制淋巴瓣膜发育和维护瓣膜的重要因子(表1)。
4.2 全身性淋巴发育不良
全身性淋巴发育不良是由淋巴引流异常引起的罕见病,特征性表现为均匀且广泛扩散的淋巴水肿、淋巴管扩张、乳糜胸、积液。目前发现四种基因变异,PIEZO1基因功能缺失性变异[27]是其中一种。变异的基因即能以复合杂合子形式存在,也能以纯合子形式存在;该变异即可引起胎儿死亡,也可导致新生儿死亡[26]。新生儿期幸存下来的个体水肿可完全消退,但可在儿童期复发。与功能获得性变异相比,PIEZO1功能缺失性变异引起的胎儿淋巴水肿在出生后并发症更少。Datkhaeva等[28]还观察到携带相同PIEZO1基因变异的兄弟姐妹间表现出不同的严重程度,表明个体间存在不同的遗传修饰或受到了环境的影响。
5 总结与展望
Piezo1的发现使对力感受器的研究实现了从零到一的突破。尽管已经有许多研究探索了它在循环系统中的作用及重要性,但对于实现从一到一百的完全理解仍然只是冰山一角。虽然目前有一些研究表明Piezo1与循环系统疾病相关,但其在具体疾病中的作用阶段、信号通路、分子机制尚未完全明确。此外,Piezo1在细胞与组织中广泛表达并不代表其功能具有对应的普遍重要性,目前所认识到的作用,是不是真正引起相关疾病的关键作用也需要进一步深入研究。
利益冲突:无
