靶向脂滴的三苯胺衍生物的设计合成及荧光成像
2023-01-12王志宇丁飞杨葛佳一
王志宇,丁飞杨,葛佳一,邓 奕,胡 磊,王 慧
(皖南医学院 药学院,安徽 芜湖 241002)
脂滴是细胞中储存脂肪的细胞器,参与细胞代谢、膜的合成与转运等多种细胞活动,与神经退行症、糖尿病、癌症、脂肪肝等疾病息息相关。脂滴与多种细胞器(内质网、线粒体、过氧化物酶体等)之间存在相互作用,脂滴的功能失调会引起多种连锁反应,导致多种疾病发生,但其中的作用机制尚不明确[1-2]。为了研究脂滴的功能,荧光成像是当前最有力的技术。目前,尼罗红和各种基于BODIPY的探针(BODIPY 493/503)已商业化,是研究脂滴荧光成像最常用的工具。但这2种探针各有一定的不足,比如尼罗红选择性低,信噪比低,在脂滴染色的同时内质网和其他膜结构也会被染色;BODIPY 493/503斯托克斯位移小,背景干扰大,这些局限性对实验结果会造成一定的误差[3-4]。因此,开发具有高选择性和高信噪比的靶向脂滴的荧光探针仍具有挑战性。
基于此,本文以三苯胺和4-吡啶甲醛作为构筑单元,设计合成了一种靶向脂滴的化合物L(合成路线见图1),在分子中引入了具有较好的脂溶性和较强给电子能力的三苯胺官能团。结合紫外可见吸收光谱、荧光发射光谱和理论计算,系统研究了化合物L的光学性质,探索了化合物L在细胞中的靶向部位及其在监测脂滴数量变化方面的潜力。
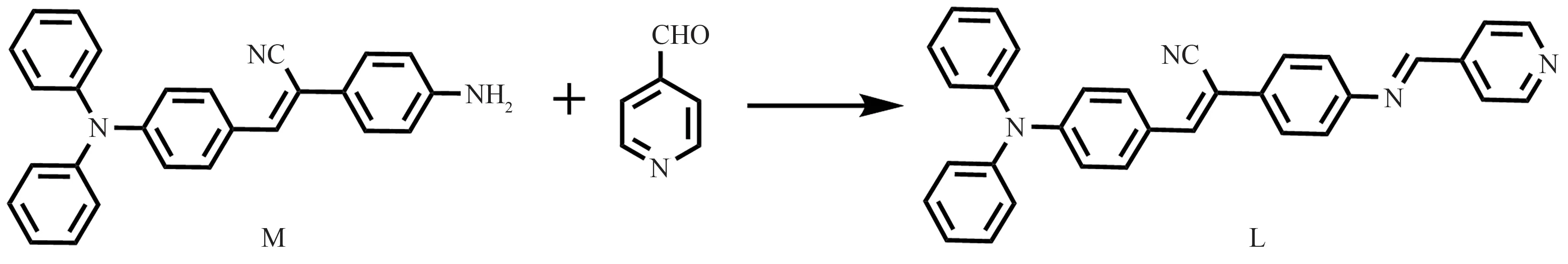
图1 化合物L的合成路线图Figure 1 Synthetic route of compound L
1 材料与方法
1.1 仪器与试剂
仪器:Finnigan LCQ 型质谱仪,美国赛默飞公司;UV-5900 PC型紫外可见分光光度计,上海元析仪器有限公司;HITACHI F-4600 型荧光分光光度计(测试参数:激发波长410 nm,狭缝宽度均为10 nm,电压500 V),日本日立有限公司;Leica TCS SP8 共聚焦显微镜,德国徕卡公司;Bruker Avance 400 型核磁共振仪(TMS为内标),德国Bruker公司。
试剂:对硝基苯乙腈、三苯胺、4-吡啶甲醛、二甲基甲酰胺(DMF)、三氯氧磷(POCl3)、二氯亚锡、苯、乙醇、四氢呋喃、二氯甲烷、乙酸乙酯、乙腈等试剂均为化学纯或分析纯,购自上海阿拉丁试剂有限公司。
1.2 化合物L的合成
中间体M 的合成见参考文献[5]。在50 mL 圆底烧瓶中加入化合物M(0.38 g,1 mmol),用30 mL 无水乙醇使其完全溶解,然后分别加入4-吡啶甲醛(0.14 g,1.3 mmol)和2滴冰乙酸,回流反应12 h后,析出橙红色固体,趁热抽滤,粗产物用乙醇重结晶,得橘红色固体产物L(0.32 g),产率为67%。1H NMR(400 MHz,d6-DMSO): δ 8.80~8.72 (m, 3H), 7.96 (s, 1H), 7.88~7.86 (m, 4H), 7.81 (d,J= 8.6 Hz, 2H), 7.48 (d,J= 8.4 Hz, 2H),7.41~7.37(m, 4 H), 7.22~7.13 (m, 6H), 6.97 (d,J= 8.8 Hz, 2H)。13C NMR (101 MHz,d6-DMSO): δ 159.67,151.12,150.46,149.44,146.02,141.76,131.51,130.78,129.85,129.80,126.36,125.57,125.10,124.66,122.23,122.09,119.99。ESI-MS:477.2063([M+1]+)。
1.3 化合物L的紫外可见吸收光谱和荧光发射光谱测定
为了研究化合物L的光物理性质,选取6种极性不同的溶剂1,4-二氧六环(DOA)、四氢呋喃(THF)、乙酸乙酯(EA)、乙醇(EtOH)、乙腈(ACN)和磷酸缓冲盐溶液(PBS,pH=7.40),探究了化合物L的紫外可见吸收光谱和荧光发射光谱。首先将化合物L 配成浓度为10-3mol/L 的母液,溶剂为二甲基亚砜。用移液枪移取50µL的母液置于5 mL的容量瓶中,分别用6种溶剂定容至5 mL,用于其紫外可见吸收光谱和荧光光谱的测定。荧光光谱的测试条件:激发波长为410 nm,狭缝宽度均为5 nm,电压为500 V。
1.4 化合物L对脂质体的荧光响应测定

1.5 细胞毒性实验
利用MTT 法[7]对细胞毒性进行评估,分别将5、10、15、20、25、30µmol/L 的化合物L 与HepG2细胞共培养24 h后,测定细胞存活率。
1.6 脂滴特异性成像
用化合物L孵育HepG2细胞30min,用PBS缓冲溶液洗涤3遍后直接用于激光共聚焦显微成像。
1.7 细胞内脂滴的数量变化监测
以Hela细胞为模型,用100µmol/L油酸处理HeLa细胞6 h后,除去皿中的培养基,随后加入新鲜的含有10µµmol/L化合物L的培养基,继续孵育细胞30 min,然后进行激光共聚焦成像。
2 结果与讨论
2.1 化合物L在不同溶剂中的光物理性质
图2(A)为化合物L在不同溶剂中的紫外可见吸收光谱。如图2(A)所示,随着溶剂极性的增加,化合物L的吸收峰位置没有发生明显的变化(PBS除外),且其最大吸收波长在400 nm左右。运用含时密度泛函理论(TD-DFT/B3LYP,6-31G*基组)对化合物L的跃迁过程进行理论计算,结构优化及TD-DFT计算均采用高斯09程序进行。由图3可知,理论计算出化合物L的最大吸收峰在403 nm左右,是HOMO-1到LUMO的跃迁,其中HOMO-1轨道的电子云主要集中在三苯胺和对硝基苯乙腈基团上,LUMO轨道的电子云主要集中在对硝基苯乙腈和4-吡啶甲醛基团上,可归属于分子内电荷转移(ICT)跃迁。理论计算得出的最大吸收峰与实验结果基本一致,为解释化合物L的紫外可见吸收光谱提供了有力的证据。
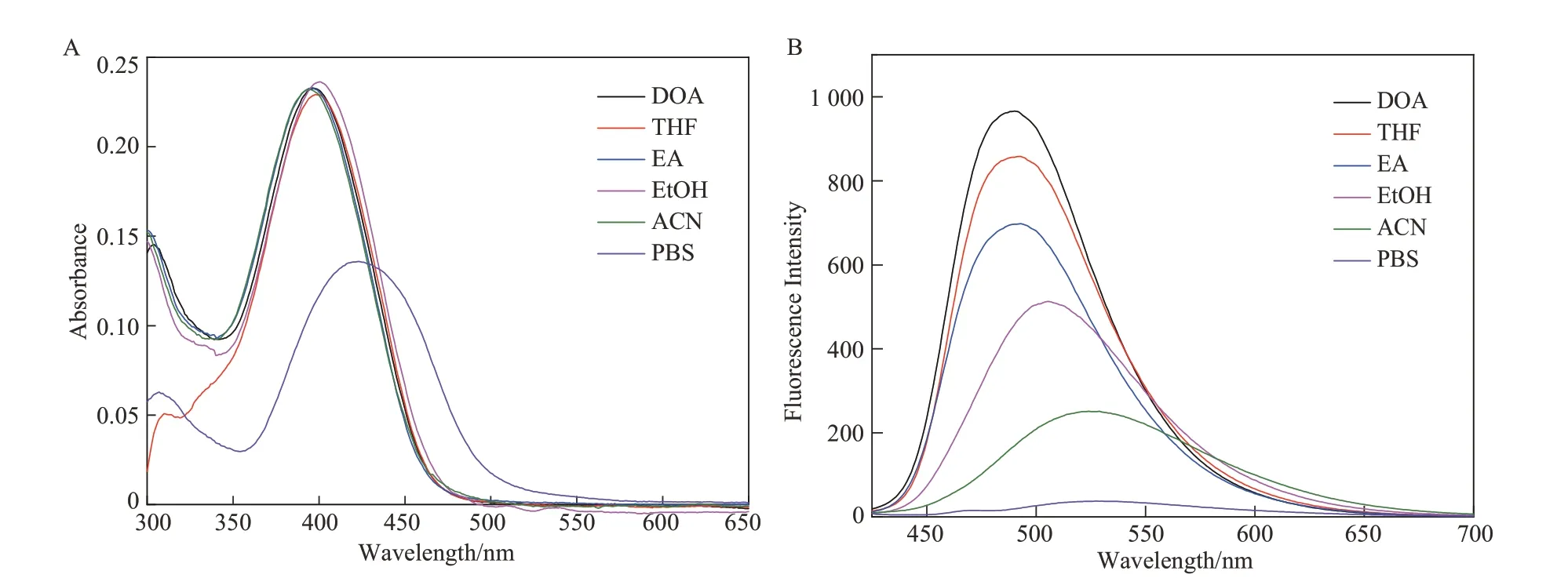
图2 化合物L在不同极性溶剂中的紫外可见吸收光谱(A)和荧光光谱(B)(浓度为10 μmol/L)Figure 2 UV-vis absorption(A)and fluorescence emission(B)spectra of compound L in different polar solvents(c=10 μmol/L)
图2(B)为化合物L在不同溶剂中的荧光发射光谱。根据图2(B)可知,随着溶剂极性的增大,化合物L的荧光光谱发生红移,荧光发射峰从490 nm(DOA)红移至527 nm(PBS),其最大发射波长红移了37 nm,表明化合物L 的激发态可能存在扭转的分子内电荷转移。而且化合物L 的荧光强度大小受溶剂的极性影响,在极性较弱的溶剂DOA中荧光强度较强,在极性较强的溶剂PBS 中荧光强度较弱,其在DOA 中的荧光强度是在PBS 中的荧光强度的25.8 倍,这种现象可能是由于化合物在极性溶剂中能级下降,导致激发态与基态间能级差缩小,从而引起非辐射跃迁增大,说明化合物L符合溶致动力学效应[8-9]。
2.2 化合物L对脂质体的荧光响应
化合物L 对脂质体的荧光响应实验结果见图4。由图4 可知,当脂质体和O/W 乳剂加入到化合物L 的PBS缓冲溶液中后,化合物L的荧光强度分别增强了93倍和10倍,而其它分析物的加入并没有引起化合物L的荧光强度发生明显的变化,说明化合物L与脂质体和O/W乳剂之间的相互作用可增强化合物L在PBS溶液中的荧光强度。这种现象可解释为脂质体和O/W乳剂均有类似于囊泡的结构,由于化合物L具有较好的亲脂性,当向化合物L的PBS溶液中加入脂质体和O/W乳剂后,化合物L中的亲脂基团三苯胺使其更倾向于渗入到脂质体和O/W乳剂中的封闭囊泡结构中,分子中单键的旋转受到限制,最终导致其荧光增强。此结果表明化合物L具有靶向细胞内脂滴的潜力。
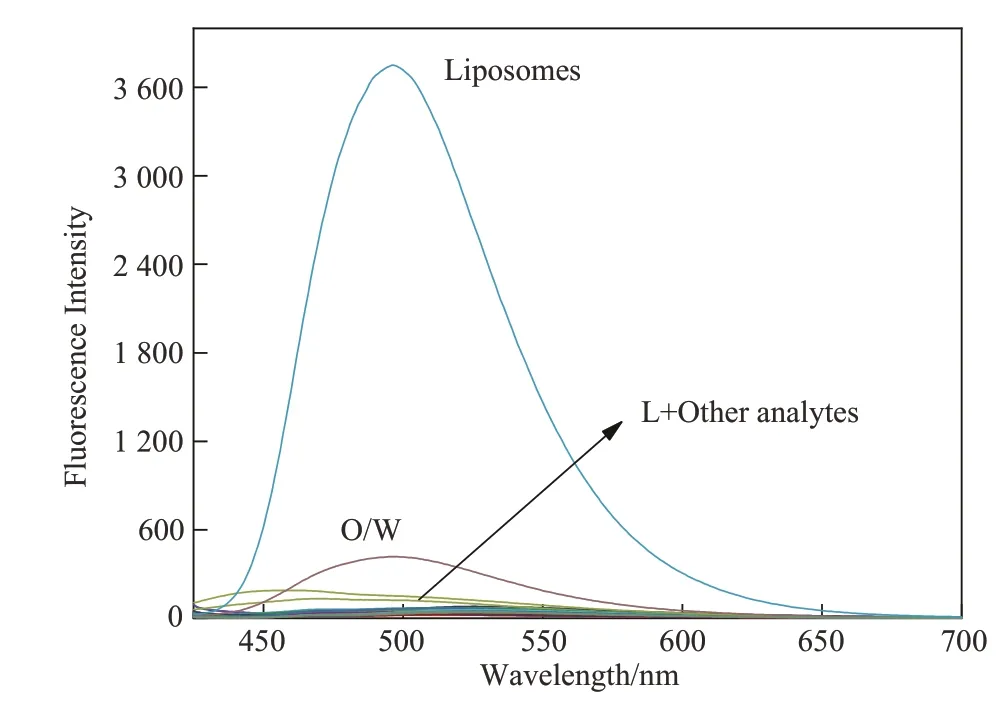
图4 化合物L与各种不同的分析物相互作用前后的荧光光谱Figure 4 Fluorescence spectra of compound L before and after interaction with various analytes
2.3 细胞毒性实验
细胞毒性是生物学应用的一个重要参数。化合物L的细胞毒性实验结果如图5所示,在5~30µmol/L的浓度下,化合物L与HepG2细胞共培养24 h后,细胞存活率均在80%以上,这说明化合物L的细胞毒性低,生物相容性好,可用于后续细胞实验。
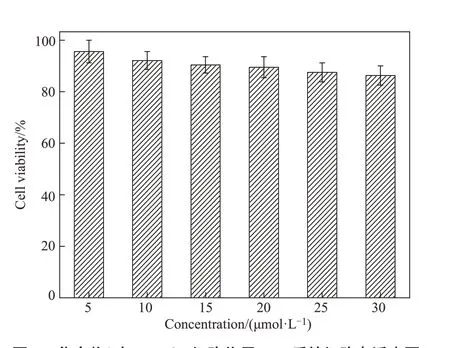
图5 化合物L与HepG2细胞作用24 h后的细胞存活率图Figure 5 Cell viability of HepG2 cells incubated with compound L for 24 h
2.4 脂滴特异性成像研究
化合物L的脂滴特异性成像研究如图6所示。从图6中可以看出,化合物L能够穿透细胞膜,在细胞中展现出颗粒状的亮点,结合前面的性质分析,猜测化合物L可能靶向于细胞内的脂滴部位。为了进一步验证化合物L靶向细胞的部位,选择脂滴商业染料BODIPY493/503与化合物L进行共定位实验。从图7中可以看出,商业染料BODIPY493/503和化合物L的重叠程度较高,计算得出二者的皮尔森相关系数为0.90,说明化合物L能够靶向在细胞内的脂质部位。
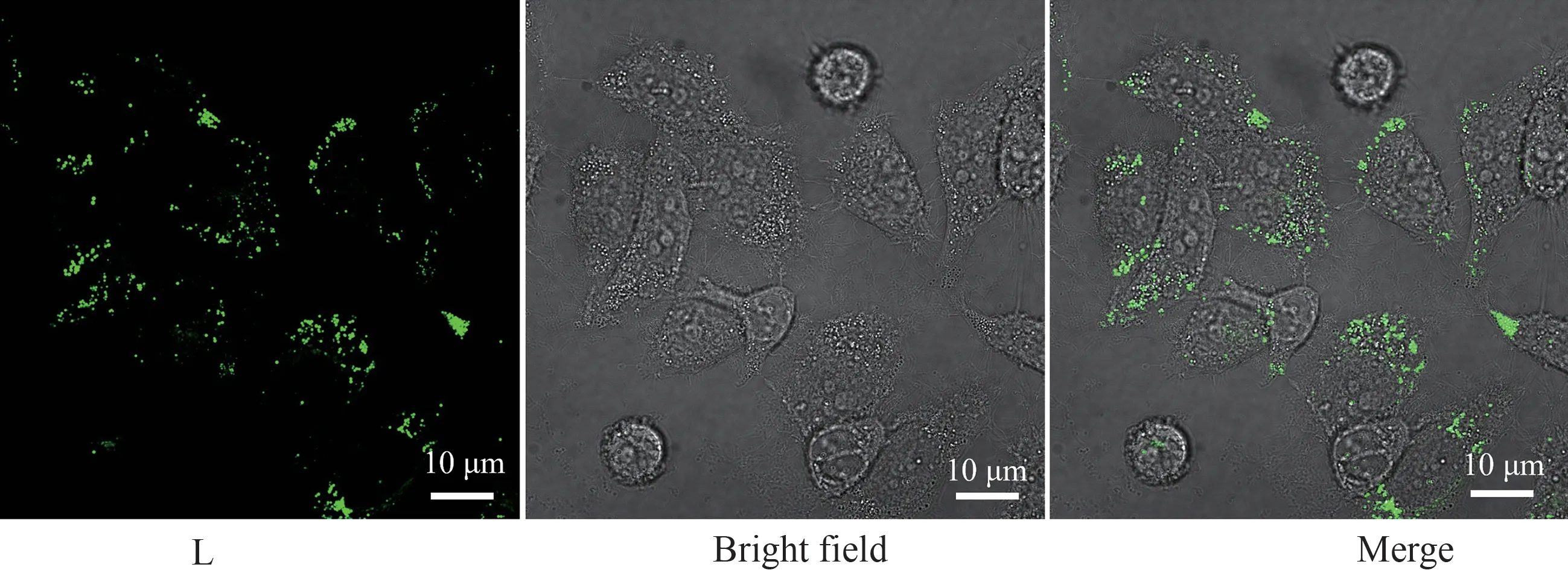
图6 化合物L与HepG2细胞给共培养30 min后的激光共聚焦成像图Figure 6 Confocal images of HepG2 cells incubated with compound L for 30 min
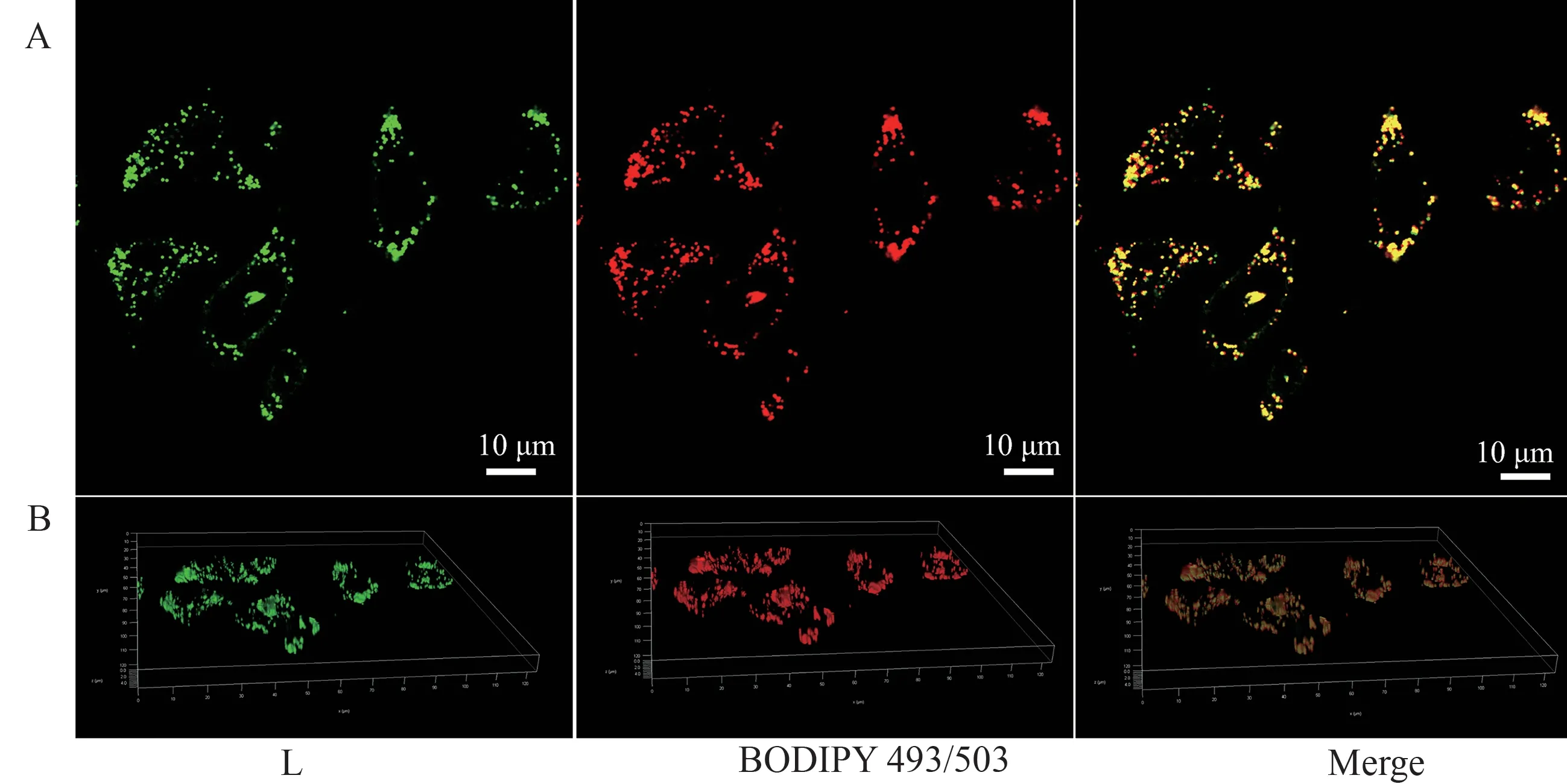
图7 (A)化合物L 与BODIPY493/503在HepG2细胞中的共定位实验;(B)化合物L 与BODIPY493/503的3D成像图Figure 7 (A)Colocalization experiments of HepG2 cells incubated with compound L and BODIPY 493/503;(B)The 3D viewer of HepG2 cells incubated with compound L and BODIPY 493/503
2.5 细胞内脂滴的数量变化监测
在证明化合物L能特异性靶向脂滴后,进一步评估了化合物L对脂滴数量的监测能力。作为细胞中储存脂质的细胞器,脂滴与脂质聚集相关的常见疾病例如脂肪肝、肝癌、肥胖和动脉粥样硬化密切相关[10]。根据文献报道[11],油酸可以刺激细胞产生脂滴。图8为油酸刺激细胞前后化合物L 与细胞共培养后的激光共聚焦成像。如图8所示,未用油酸刺激的细胞中脂滴含量较少,用油酸刺激细胞后,细胞内脂滴的数量明显增加,同时细胞内的荧光强度也明显增强。以上结果表明,化合物L可用于监测脂滴的数量变化,在分析脂滴相关的疾病方面具有巨大潜力。
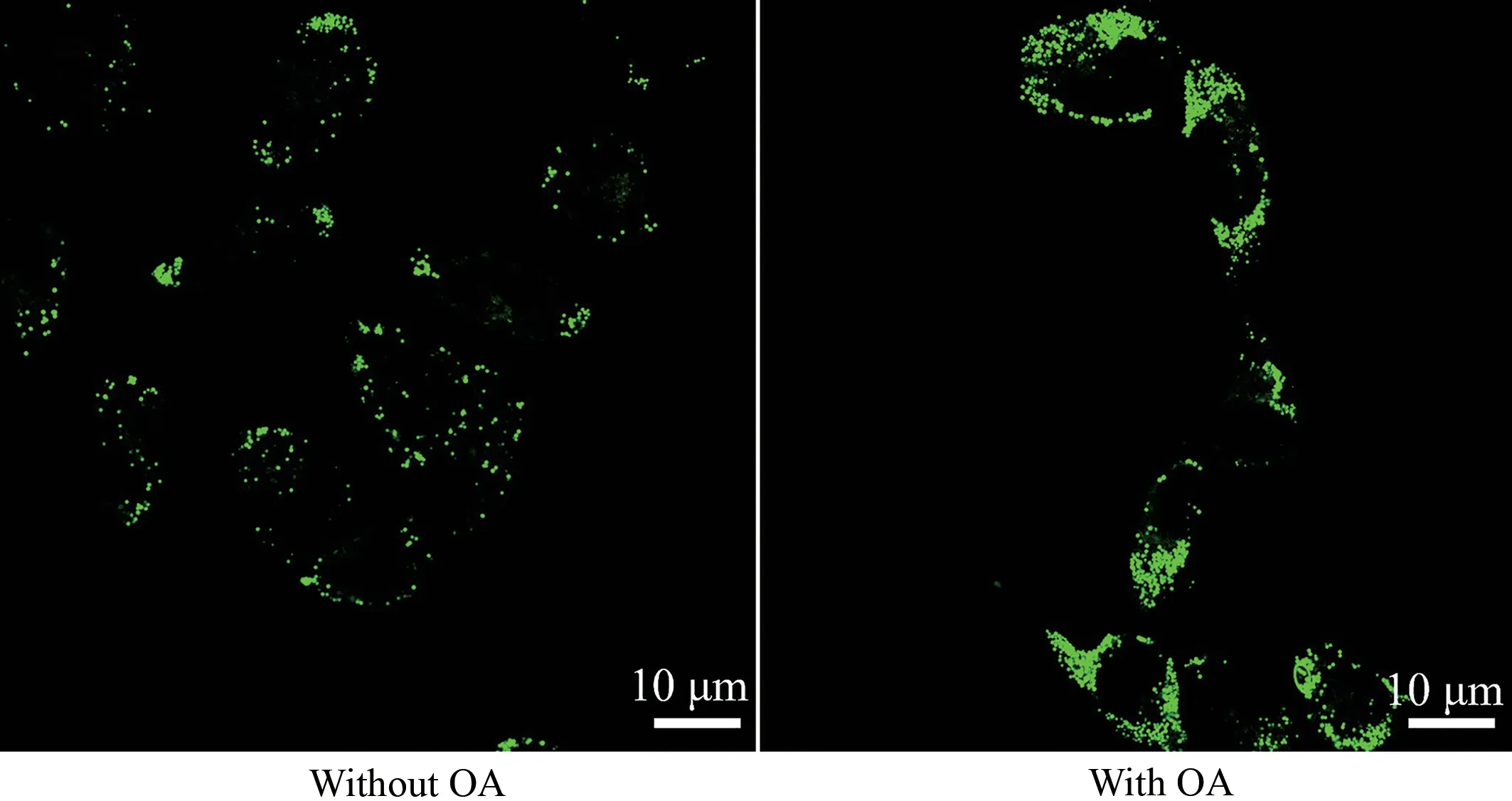
图8 油酸刺激细胞前后化合物L与细胞共培养后的细胞显影图Figure 8 Cell images of HepG2 cells treated with or without oleic acid after incubation with compound L
3 结论
本文合成了一种基于三苯胺衍生物的脂滴特异性靶向的化合物L,结合理论计算,系统研究了化合物L的光学性质,结果表明,随着溶剂极性的增加,化合物L的最大吸收峰位置未发生明显的变化(PBS除外),但荧光峰却发生了明显的红移且伴随着荧光强度降低。细胞实验结构表明,化合物L具有较高的细胞存活率,能特异性靶向在细胞内的脂滴部位,并可用于监测细胞内脂滴的数量变化。此研究结果为后期开发具有较好生物相容性和光学性质的脂滴荧光化合物提供了实验基础。
