MRI 灌注定量分析对非肿块强化乳腺病变的诊断价值
2023-01-12赵霞李秉营时光喜邹瑞琪王宁
赵霞 李秉营 时光喜 邹瑞琪 王宁
乳腺MRI 非肿块强化(non-mass enhancement,NME)病变形态松散不规则,其间可夹杂正常腺体及脂肪组织,缺乏特征性表现,易造成误诊、漏诊。无论从现有的乳腺影像报告和数据系统(Breast Imaging Reporting and Data System,BI-RADS)描述的形态特征、其他表示形态特点定性或者定量特征,还是定量的经典数学模型中提取的动力学参数,临床工作中单一特征类型的应用对这类病变的检出、描述和诊断都极具挑战性[1]。准确评估NME乳腺疾病范围,获得预后特征仍是亟待解决的难点。动态对比增强MRI(dynamic contrast enhanced-MRI,DCE-MRI)是乳腺病变检查的常规影像手段,可无创地获取半定量及定量血流动力学特征以及容量转移常数(volume transfer constant,Ktrans)、速率常数(rate constant,Kep)等用于预测病变组织内部的生物学侵袭性。本文回顾性分析56 例NME 乳腺病变的DCE-MRI 影像资料,探讨DCE-MRI 对NME乳腺病变良恶性的鉴别诊断价值及诊断效能,以提高NME 乳腺病变诊断准确性。
资料与方法
1.一般资料
回顾性收集2021 年1 月~12 月我院收治的56 例NME 乳腺病变患者临床和MRI 影像资料。均为女性,年龄27~76 岁,中位年龄43 岁。纳入标准:(1)均经超声诊断怀疑为乳腺病变,且动态对比增强MRI 检查均显示为非肿块强化病变,图像清晰并可测量;(2)既往未经过穿刺活检或放化疗等诊疗措施,并于MRI 检查后1 周内行手术或穿刺活检获得明确的病理结果。患者在检查前签署知情同意书,本研究经医院伦理委员会审查通过。
2.检查方法
采用GE Signa Pioneer 3.0 T MRI 扫描仪和8通道乳腺专用相控阵表面线圈及多通道并行采集技术。患者取俯卧位,双侧乳腺自然悬垂并固定于线圈中。扫描序列包括轴位T1WI、T2WI 以及DWI(b=0、800 s/mm2)以及动态增强扫描MRI。动态增强扫描采用三维容积超快速动态成像T1WI 脂肪抑制序列(differential subsampling with cartesian ordering,DISCO),共计扫描28 个时相,第一时相为蒙片扫描时间为54 s,随后开始动态增强扫描,每一时相为18.8 s,总采集时间为561.6 s,各期之间为无间隔扫描。具体扫描参数如下:TR 5.6 s,TE 最小值,翻转角15 度,体素1.2×1.2 mm,视野为36 cm×36 cm,层厚1.2 mm,相位编码方向为前后方向A/P,采集次数1 次,矩阵尺寸为300×300,带宽125。动态增强扫描2 期之后静脉团注对比剂钆布醇注射液(加乐显,拜耳),剂量0.2 ml/kg,注射流率2 ml/s,随后以相同流率追加20 ml 生理盐水冲管。
3.图像分析
所有图像处理工作在GE AW 4.7 工作站上完成,由两位工作10 年以上的MRI 诊断医师完成图像后处理。病变内参数均测量3 次取其平均值;勾画兴趣区(region of interest,ROI)时需尽量避开出血、坏死、囊性灶,选择病灶强化最快、最明显区域[2]。ROI 面积不小于50 mm2。
利用Ready View 软件观察NME 病变进行动态增强扫描的分布方式并测量病变的最大径,随后获取病变的时间-信号强度曲线(time-signal intensity curve,TIC)类型并测量半定量血流动力学特征参数早期强化率(early enhancement ratio,EER)、晚期强化率(late enhancement ratio,LER),计算公式为:
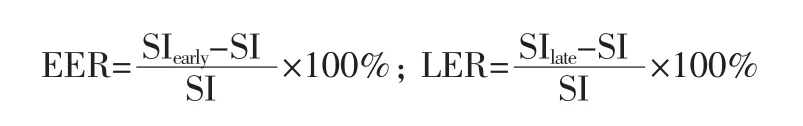
注:公式中SI(signal intensity)为增强前基线信号强度,SIearly为增强后91.6 s 时病变信号强度值,SIlate为增强后450 s时病变信号强度值
利用Gen IQ 软件测量病变内各项灌注参数,包括Ktrans、Kep、最大增强斜率(maximum slope of increase,MSI,mmol/s)、对比剂浓度时间曲线下的90 s 时的初始区域(initial area under the gadolinium curve,IAUGC)、对比增强比(contrast enhancement ratio,CER)、血管外细胞外间隙的容积(extravascular extracellular volume fraction,Ve)。其中预设T1校正值为900 ms,血管输入函数VIF 采用Model Based模式。Ktrans是对比剂从血管内扩散到血管外细胞外间隙的正向渗透速率,Kep是对比剂从血管外细胞外间隙回流到血管内的渗透速率。二者之间存在以下关系:

4.统计分析
采用SPSS 20.0 软件进行统计学分析。符合正态分布的计量资料以表示,良/恶性组间的比较采用独立样本t 检验;非正态分布的计量资料用M(Q1,Q3)表示,良/恶性组间的比较采用Mann-Whitney U 检验。通过绘制受试者工作特征(receiver operating characteristic,ROC)曲线获取各项MRI特征参数的曲线下面积(area under the curve,AUC)、敏感度及特异度等用以评价其诊断效能。应用组内相关系数(intraclass correlation coefficient,ICC)评价两名医师测量的各项参数的一致性(ICC 大于等于0.75 为高度一致,ICC 为0.4~0.75 之间为中度一致,ICC 小于0.4 为一致性较低)。P<0.05为差异具有统计学意义。以上均行方差齐性检验。
结果
56 例NME 乳腺病变患者,病理为良性者33例,包括单纯性腺病6 例、硬化性腺病2 例、增生性病变伴局部纤维腺瘤样结构8 例、小叶性肉芽肿性乳腺炎8 例、非特异性肉芽肿性乳腺炎6 例、慢性乳腺炎3 例。病理为恶性者23 例,包括浸润性导管癌6 例、浸润性小叶癌8 例、浸润性实性乳头状癌1 例、中-高级别导管内癌4 例、高级别导管内癌3 例、高级别导管内炎伴浸润性导管癌1例。按照非肿块强化的分布方式进行分类,良性病变中段性分布有1 例(慢性炎细胞浸润伴导管扩张),局灶分布6 例(增生性病变5 例,乳腺慢性炎1 例),区域分布13(单纯性腺病1 例,乳腺增生1例,乳腺炎11 例),多区域分布10 例(增生性病变4 例,腺病1 例,乳腺炎5 例),弥漫分布3 例(增生2 例,乳腺炎1 例)。按照非肿块强化的分布方式进行分类,恶性病变中线状分布1 例,为浸润性导管癌伴低乳头状型导管内癌;段状分布2 例,为浸润性导管癌;局灶分布1 例,为浸润性癌;区域分布12 例(高级别导管内癌7 例,浸润性乳腺癌4 例,浸润癌伴高级别导管内癌成分1 例);多区域分布7 例(浸润性癌6 例,中-高级别导管内癌,局部可见散在小腺体需免疫组化排除浸润1 例)。良性病变的最大径为(63.787±29.853)mm,恶性病变的最大径为(46.859±17.497)mm。病变最大径的组间差异t 检验显示组间差异具有统计学意义(P=0.02)。
两名医师测量各项参数间的一致性分析:统计分析结果显示EER 和LER 均具有较高的一致 性(ICC 分别为0.907、0.836)。Kep和Ktrans、MSI、IAUGC、CER 均具有较高的一致性(ICC 分别为0.927、0.917、0.962、0.902、0.931)。
良性NME 乳腺病变EER 明显低于恶性病变,组间差异具有统计学意义(P=0.002),LER 的组间差异无统计学意义(P=0.247)。恶性NME 乳腺病变的Kep、Ktrans、MSI、IAUGC、CER 等均高于良性病变,且差异具有统计学意义(P≤0.001)(表1,图1、2)。ROC 曲线显示半定量血流动力学特征中,EER 的诊断效能优于LER。定量特征参数诊断效能明显优于半定量特征,其中以Kep和Ktrans诊断效能较高(表2,图3)。

表2 各项DCE-MRI 特征对NME 乳腺病变的诊断效能
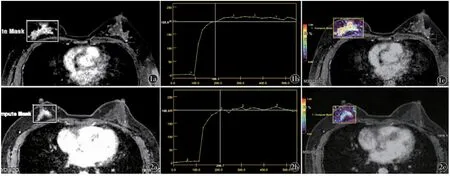
图1 女,45 岁,右侧乳腺内上及外上象限NME 病变,病理为浸润性小叶癌。a)动态增强扫描对比剂注入后91.6 s 时的强化图像;b)TIC曲线;c)灌注伪彩图图2 女,40 岁,右侧乳腺内上及外上象限NME 病变,病理为囊性增生病伴导管内乳头状瘤,部分导管上皮增生、钙化。a)动态增强扫描对比剂注入后91.6 s 时的强化图像;b)TIC 曲线;c)灌注伪彩图

图3 动态 增强扫描参数的ROC 分析。a)EER 和LER 的ROC 分析;b)Kep、Ktrans、MSI、IAUGC 的ROC 分析

表1 NME 乳腺病变DCE-MRI 各项参数分析
讨论
1.NME 乳腺病变影像诊断现状
乳腺NME 是较为特殊的一种病变,病变内可以夹杂正常腺体组织,与邻近腺体组织分界不清,具有复杂的组织病理学和生物学特征,对其良恶性的鉴别诊断具有一定挑战性[1]。既往针对NME病变,临床多采用钼靶或超声复诊,但经研究发现,其诊断敏感度较低,应用效果一般。随着DCE-MRI 逐渐应用于NME 乳腺病变诊断中,利用对比剂对乳腺病变组织进行廓清,使乳腺病变组织与周围组织的界限更加清晰,可以检查患者病变部位内的强化特点、病变边缘、大小及位置等,可准确反映病变的形态学特征,为临床诊治提供重要参考依据[3],还可获取血流动力学特征以及灌注特征(Ktrans、Kep)反映病变微环境的血流动力学、新生血管密度以及血管通透性特征进行量化诊断[4],是预测肿瘤血管生成和侵袭性的潜在成像生物标志物[5]。
美国放射学会2013 年第5 版MRI BI-RADS分类[6]中提到乳腺非肿块强化是指不同于周围正常乳腺实质强化、没有明确边界的强化区域,无法像肿块一样勾画出三维轮廓,一般无明显占位效应,常有脂肪或正常组织夹杂其间,同时推荐扫描协议包含DCE-MRI 序列,并将DCE-MRI 参数作为区分良恶性的重要信息。因此本研究中选择应用2D ROI 进行各项参数测量。肿瘤内的血管生成与恶性程度密切相关。与正常供血血管相比,肿瘤新生血管密度更大且分布不均匀,内皮细胞基底膜发育不完整,血管壁通透性更强。病变血流动力学特征与病变微循环中血管密度、毛细血管壁的通透性及肿瘤间质的压力等因素均有关。需要注意的是,NME 乳腺恶性病变中夹杂存在正常腺体,病变由新生肿瘤血管和正常腺体内发育完善的血管共同供血,而且部分良性病变血流灌注亦可较丰富(如纤维腺瘤、炎性病变等),与恶性病变之间存在重叠[7]。在临床工作中对乳腺病变性质的判断需要结合病变的形态、强化特点、MSI 和血流动力学特征等信息进行综合分析[8]。有研究证实NME 良恶性组间TIC 类型差异无统计学意义,因此建议TIC 类型仅作为鉴别乳腺非肿块病变良恶性的次要标准[9,10]。TIC 曲线可靠性较差的原因可能是:(1)血流量、毛细血管通透性、血管密度、血管外细胞外间隙等多种因素影响均可对TIC 曲线类型产生影响;(2)绘制ROI 测量过程中很难完全避开正常乳腺组织[11]。
2.DCE-MRI 灌注参数对NME 乳腺病变的价值
周健等[12]的研究结果显示,DCE-MRI 影像特征评价应以增强早期(2 min)为宜,因为过早对比剂还未充分进入病灶,过迟(延迟期)则常因病变内夹杂的或者周围的纤维腺体或增生腺体强化,掩盖病变原来的形态而导致误判。本研究采用EER、LER 以及CER 等影像特征反映病变内的血流动力学,目的就在于避免背景实质强化的干扰以及TIC 曲线对NME 病变良恶性判断的影响。结果显示,NME 乳腺恶性病变的EER、CER 明显高于良性病变,与既往研究[12-14]结果一致。LER 的组间差异无明显统计学意义,提示TIC 曲线类型对鉴别NME 乳腺病变的良、恶性价值有限,与李娜等[15]的研究结果一致。可能与恶性病变中微血管密度更大、毛细血管壁基底膜不完善、通透性更高导致对比剂流入速度更快有关。Mori 等[16]对77 例乳腺NME 病变行DCE-MRI 扫描,分别获得早期和延迟期信号增强比,运用ROC 曲线分析的结果显示二者用于病变良恶性鉴别诊断的ROC AUC均为0.81。本研究结果显示,EER 的诊断效能优于LER(准确度分别为74.4%、63.5%),但总体诊断效能稍低于Mori 等[16]的研究结果,可能与样本量小、入组偏倚有关。
本研究基于DCE-MRI 定量分析技术获得NME 病变的半定量及定量影像学特征,结果显示定量特征如Kep、Ve、Ktrans等在恶性病变中显著高于良性病变且差异有统计学意义,证实DCE-MRI 定量参数鉴别乳腺NME 良性与恶性具有一定价值,与前人的研究[17-20]结果相一致。分析原因可能是与肿瘤细胞刺激了新血管生成,血管内皮细胞增多、血流阻力降低形成的高灌注的病理生理基础密切相关[21]。
3.DCE-MRI 灌注参数对NME 乳腺病变诊断效能的ROC 曲线分析
本研究中ROC 分析结果显示,Ktrans、Kep在乳腺NME 病变良恶性鉴别诊断中具有良好的诊断效能,提示灌注参数可以更好地描述NME 乳腺病变内的血管生成及血管壁渗透性特征。同时,本研究在部分急性乳腺炎病变中也可见到高灌注状态(Ktrans、Kep显著升高),与李振宇等[22]的研究结果一致。可是因为炎性病变存在局灶性溶解坏死、蜂窝状脓腔形成,导致血管壁结构破坏,血管壁通透性增加,同时炎性反应使得腺体组织充血肿胀,炎性细胞浸润可以刺激血管生成,增加病变内的新生血管数量的同时扩张血管腔。
本研究的局限性:(1)为单中心回顾性研究且样本量较小,存在选择性偏倚;(2)采用2D ROI 手动勾画技术,先进性存在不足,所画ROI 没有将病变的整个实性部分包含在内不能代表整个肿瘤,可以尝试采用全肿瘤的3D ROI 半自动勾画分析病变。
综上所述,本研究基于DCE-MRI 定量分析技术对NME 乳腺病变良恶性进行评价,显示定量灌注相关参数具有良好的诊断效能。
