乳腺癌对比增强能谱乳腺X 线摄影与免疫组化标记物的相关性研究
2023-01-12李鸿恩谭健彬李悦龙吕培锋彭经纶曾益辉
李鸿恩 谭健彬 李悦龙 吕培锋 彭经纶 曾益辉
乳腺癌发病率约占恶性肿瘤的7%~10%,居女性恶性肿瘤发病率首位[1],其发病越来越年轻化,早期发现及诊治乳腺癌能显著提高患者生存期[2]。乳腺癌常规检查方法包括超声、乳腺钼靶、CT 及磁共振等,但每个检查都有局限性[3,4]。对比增强能谱乳腺X 线摄影(contrast-enhanced spectral mammography,CESM)是近年来逐渐发展起来的一种新型乳腺检查技术,是在常规乳腺X 线摄影基础上静脉推注对比剂。乳腺肿瘤细胞增殖快,瘤体及周围有大量供血血管,瘤体区域富集对比剂,真实反映乳腺病灶血流动力学,来提高乳腺疾病病灶检出率及诊断准确率[5,6]。免疫组化标记物雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、人类表皮生长因子受体-2(human epidermal growth factor receptor-2,HER-2)及细胞增殖抗原标记物(Ki-67)是乳腺癌患者诊治中进行术后化疗、内分泌治疗及判断预后的关键指标[7]。本研究,分析乳腺癌患者CESM 形态学特征及免疫组化标记物阳性表达情况,旨在探讨CESM 形态学特征与免疫组化标记物之间的潜在关系,以期通过无创技术、术前影像学CESM 检查形态学特征与分子生物学之间的内在联系,来间接体现肿瘤的部分免疫组化生物学指标。
资料与方法
1.一般资料
回顾性分析2019 年5 月~2021 年5 月在我院确诊乳腺癌女性患者88 例,年龄为29~72 岁,(48.91±10.48)岁。纳入标准:临床怀疑或超声发现乳腺病变后行CESM 检查的患者;病理及免疫组织化学证实为乳腺癌。排除标准:妊娠期或哺乳期妇女;对比剂过敏者;有多种药物过敏或有哮喘史者;合并严重内科疾病或肾功能不全者;乳房内植入物或乳房重建术患者;接受乳腺癌放疗或化疗者。本研究已通过医院伦理委员会审批。
2.仪器与方法
采用GE Senographe Essential 乳腺X 线机,对比剂采用碘帕醇注射液(国药准字H20053385,300 mg I/ml,用量1.5 ml/kg),使用高压注射器以流率3 ml/s 经肘静脉注射,注射后2 min 开始CESM检查,摄片顺序采用Bhimani 等[8]研究的方法,先拍摄患侧乳腺头尾位,再拍健侧乳腺头尾位和内外斜位,最后拍摄患侧乳腺内外斜位,于对比剂注射后7 min 内完成检查,检查后观察30 min。
3.免疫组化分析方法
由病理专业医师完成组织脱水-石蜡包埋-切片-分析-阅片。ER、PR 阳性表达主要分布在癌细胞核出现染色黄色或黄色颗粒,按阳性细胞所占百分比,小于1%为(-),1%~25%为(+),26%~50%为(++),大于50%为(+++);大于等于1%癌细胞核明确阳性,小于1%为阴性。HER-2 阳性表达主要分布在癌细胞膜上可发现渔网状颗粒,出现棕黄色以上染色,评分为0 或者(+)判断为HER-2 阴性,评分为(+++)判断为HER-2 阳性,评分为(++)的进一步行荧光原位杂交(fluorescence in situ hybridization,FISH)检测,如基因扩散记为阳性,不扩散记为阴性。Ki-67 阳性表达主要位于癌细胞核表现为黄色颗粒,大于等于14%癌细胞核高表达,小于14%为低表达[9]。
4.图像分析
由科室两名具有10 年以上经验丰富医师对CESM 进行图像分析及报告书写,并参照乳腺影像报告及数据系统(Breast Imaging Report and Date System,BI-RADS)进行诊断[10],分析形态学特征,观察指标包括:大小(≤2 cm、>2 cm)、形态(圆形及卵圆形、不规则)、边缘(有“毛刺征”、无“毛刺征”)、微钙化(有、无)、强化程度分[轻度强化(较周围正常腺体组织强化稍明显,但比乳晕强化程度弱)、中度强化(与乳晕强化程度相等)和重度强化(与乳头强化程度相等)]。存在分歧时,经协商达成一致。
5.统计学方法
采用SPSS 23.0 软件分析研究数据,计数资料以率表示,计量资料用表示,组间对比应用χ2检验,CESM 检查形态学特征与免疫组化标记物的相关性采用Spearman 相关分析,P<0.05 为差异有统计学意义。
结果
1.病理诊断
88 例乳腺癌均经病理学确诊,其中浸润性癌64 例、导管内原位癌10 例、浸润性癌伴导管内原位癌10 例、浸润性癌伴乳头状癌2 例、导管内癌伴乳头状癌2 例(图1~4)。
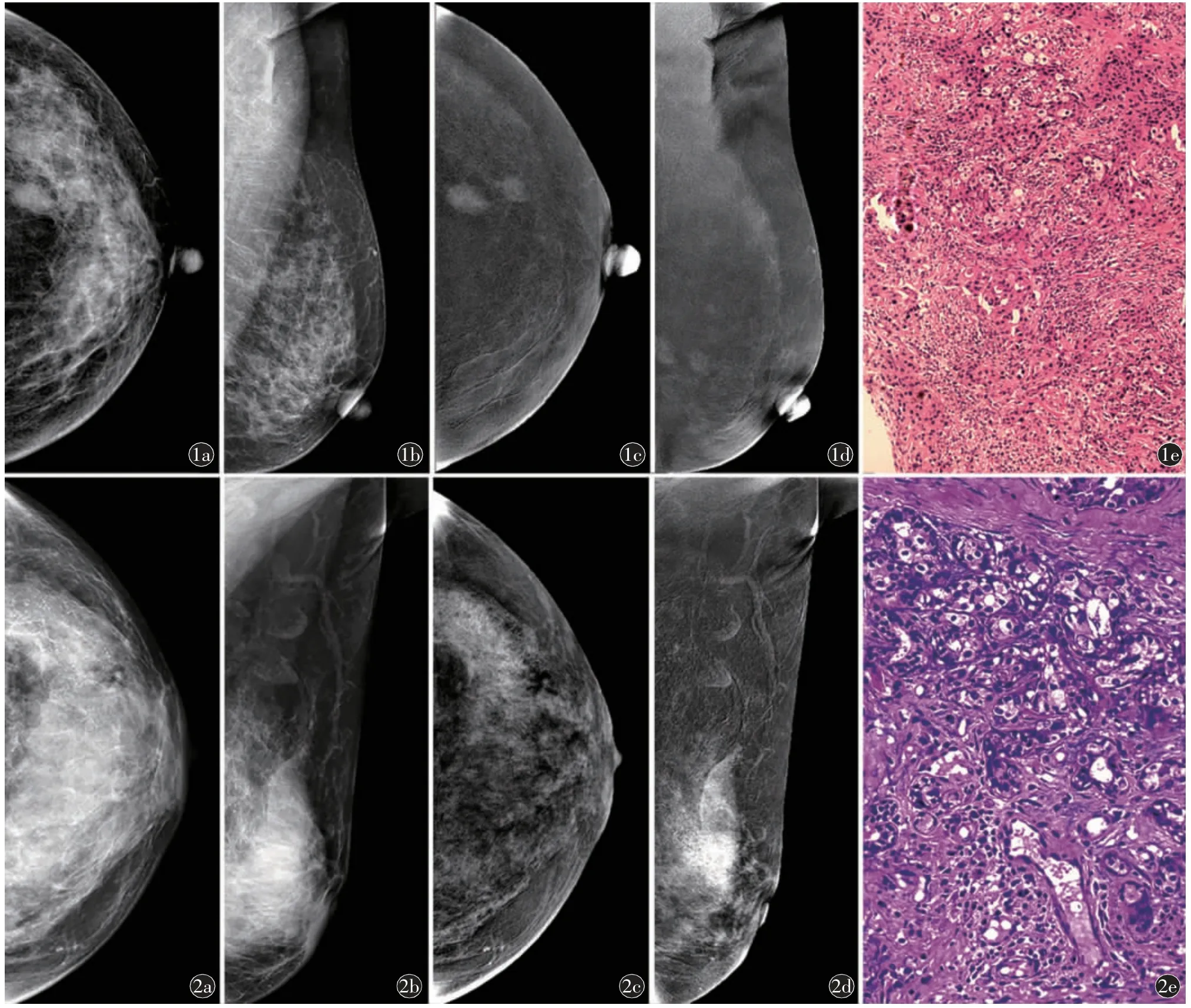
图1 浸润性癌,女,56 岁。a)左乳CESM 头尾位的低能图、b)左乳CESM 内外斜位的低能图示左乳乳头后方深部见两个肿块影,较大者大小约为1.6 cm,较小者约为1 cm,形态卵圆形,无微钙化,无毛刺征;c)左乳CESM 头尾位的减影图、d)左乳CESM 内外斜位的减影图,示对比能谱增强后肿块可见轻度强化,肿块边界更清楚,边缘清晰;e)苏木素伊红染色病理图(×100)。本例免疫组化ER(<1%+)、PR(<1%+)、HER-2(3+)、Ki-67(20%+)图2 导管原位癌,女,62 岁。a)左乳CESM 头尾位的低能图、b)左乳CESM 内外斜位的低能图示左乳外上腺体增厚,左乳外上象限可见一不对称致密影,边界模糊,形态不规则,大小为2.8 cm,可见微钙化,Ki-67 呈高表达,无毛刺征;c)左乳CESM 头尾位的减影图、d)左乳CESM 内外斜位的减影图示能谱增强见明显强化,HER-2 呈阳性表达,肿块内及附近见散在成堆的泥沙样钙化,呈段样分布;e)苏木素伊红染色病理图(×200)。本例免疫组化:ER(50%+)、PR(<1%+)、HER-2(3+)、Ki-67(40%+)
2.免疫组化标记物结果
免疫组化标记物结果为ER 54 例阳性(61.36%),34 例阴性(38.64%);PR 44 例阳性(50.00%),44 例阴性(50.00%);HER-2 62 例阳性(70.45%),26 例阴性(29.55%);Ki-67 74 例阳性(84.09%),14 例阴性(15.91%),免疫组化标记物阳性表达见图5~8。

图5 ER 阳性表达,×100图6 PR 阳性表达,×100图7 HER-2 过表达,×100图8 Ki-67 高表达,×100
3.乳腺癌CESM 特征与免疫组化标记物的关系
肿瘤大小与Ki-67 阳性表达有关(P=0.003),肿瘤超过2 cm,Ki-67 多呈高表达,与ER、PR 及HER-2 无相关性(P>0.05);形态与PR、HER-2 阳性表达有关(P=0.031、0.001),形态不规则,PR、HER-2 多呈阳性表达,与ER、Ki-67 无相关性(P>0.05);微钙化与Ki-67 阳性表达有关(P=0.009),含微钙化者Ki-67 多呈高表达,与ER、PR及HER-2 无相关性(P>0.05);“毛刺征”与ER 阳性表达有关(P=0.020),有“毛刺征”者ER 多呈阳性表达,与PR、HER-2 及Ki-67 无相关性(P>0.05);强化程度与HER-2、Ki-67 阳性表达有关(P=0.014、0.030),中、重度强化,HER-2 多呈阳性表达、Ki-67 多呈高表达,与ER 及PR 无相关性(P>0.05)(表1)。

表1 CESM 形态学特征与ER、PR、HER-2、Ki-67 的关系
Spearman 相关分析显示,CESM 肿瘤大小与Ki-67 阳性表达呈弱正相关(R=0.169,P=0.115)。形态不规则与PR 阳性表达呈弱正相关(R=0.207,P=0.053)、与HER-2 阳性表达呈弱正相 关(R=0.169,P=0.115)。含微钙化与Ki-67 阳性表达呈正相关(R=0.222,P=0.038)。有“毛刺征”与ER 阳性表达呈正相关(R=0.278,P=0.009)。强化程度与HER-2 阳性表达呈弱正相关(R=0.124,P=0.251)、与Ki-67 阳性表达呈弱负相关(R=-0.081,P=0.455)。
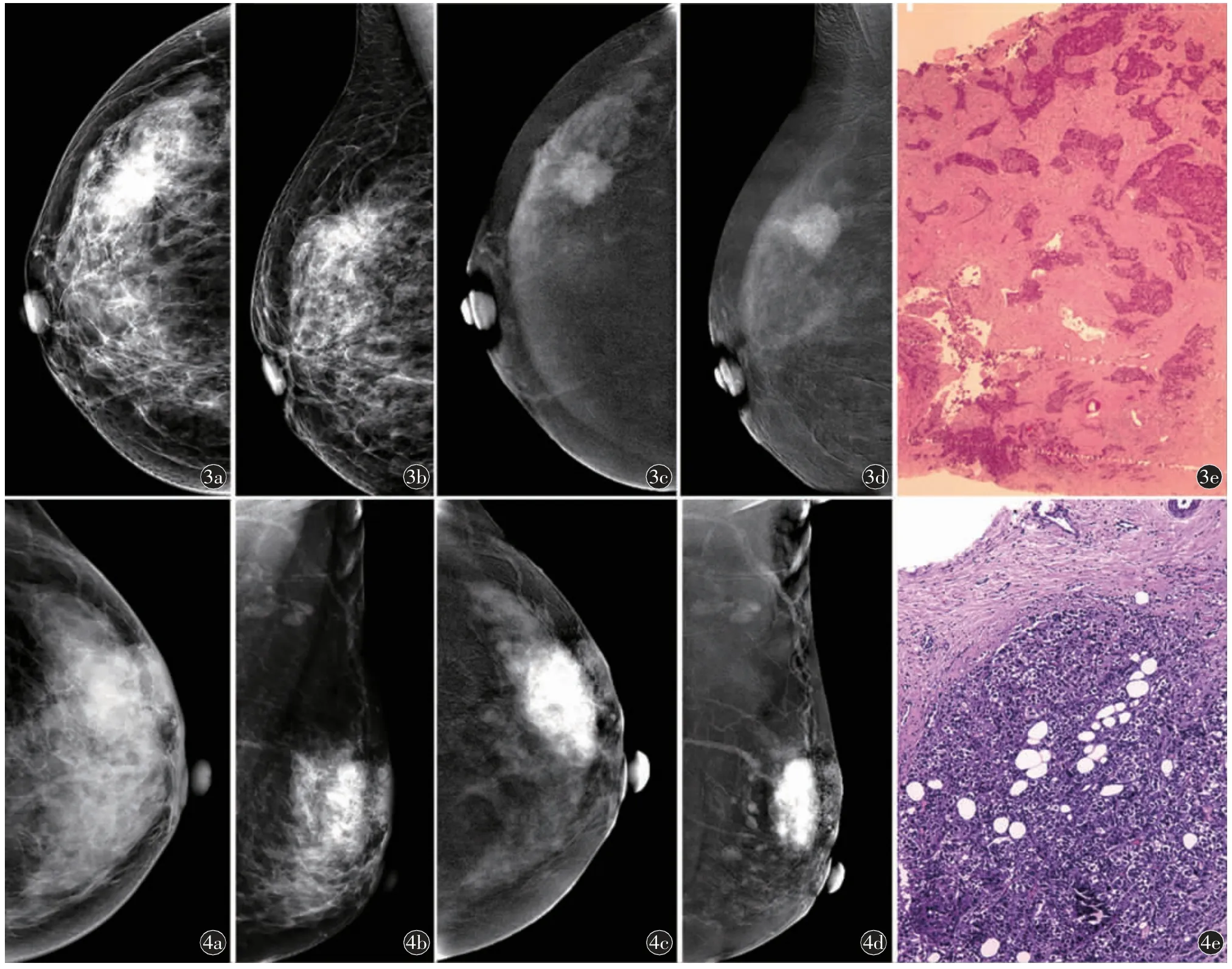
图3 导管原位癌伴浸润性癌,女,42 岁。a)右乳CESM 头尾位的低能图、b)左乳CESM 内外斜位的低能图示右乳外上象限见肿块样强化,大小为2.2 cm,形态不规则,无微钙化,有毛刺征,ER 呈阳性表达;c)右乳CESM 头尾位的减影图、d)左乳CESM 内外斜位的减影图示能谱增强见非肿块样片状强化;e)苏木素伊红染色病理图(×100)。本例免疫组化:ER(70%+)、PR(80%+)、HER-2(2+)、Ki-67(40%+)图4 浸润性癌,女,45 岁。a)左乳CESM 头尾位的低能图、b)左乳CESM 内外斜位的低能图示左乳外上腺体增厚、紊乱,大小约5.2 cm,Ki-67 呈高表达,形态不规则,无微钙化,无毛刺征;c)左乳CESM 头尾位的减影图、d)左乳CESM 内外斜位的减影图示左乳外上可见类椭圆形肿块影,呈重度强化,Ki-67 呈高表达;e)苏木素伊红染色病理图(×100)。本例免疫组化:ER(90%+)、PR(30%+)、HER-2(0)、Ki-67(30%+)
讨论
CESM 检查是利用碘剂在33.2 keV 处边缘效应出现X 线显著衰减现象,采用高能X 线(略高于33.2 keV)和低能X 线(略低于33.2 keV)2 种能量进行投照。经计算机处理后得到减影图像,即CESM 特有摄碘图。由于去除了正常乳腺腺体而凸显病灶形态,能够清晰反映乳腺组织内病灶供血情况,在致密型腺体及隐匿性病灶中具有独特优势[11,12]。ER、PR、HER-2、Ki-67 生物学指标在评价乳腺癌生物学行为、治疗方案的选取及预后方面起着重要的作用。本文主要研究乳腺癌患者CESM 形态学特征与免疫组化标记物之间的关系,来判断乳腺肿瘤的生物学行为及预后,为临床提供精准治疗。
1.乳腺癌ER、PR、HER-2、Ki-67 表达的意义
ER 是正常乳腺组织及部分病变组织中存在雌二醇受体与雌激素结合产物。PR 是雌激素与雌激素受体结合诱导生成的产物。乳腺癌ER 表达说明癌细胞保留激素依赖性生长的特点,是激素治疗潜在反应的主要指标[13]。韩晶等[14]研究显示ER 阳性提示乳腺癌细胞分化程度高,异型性低,恶性程度低,采用内分泌治疗较敏感,预后良好,文献研究显示约70%乳腺癌患者ER 呈阳性[15],本文88 例乳腺癌患者中ER 阳性54 例(61.36%),与文献研究一致。PR 表达是预测靶向治疗的主要指标。本文PR 在乳腺癌组织中的阳性表达约占50%,与王娟等[16]研究研究显示PR 在乳腺癌组织阳性率为55.87%相符。HER-2 是一种跨膜糖蛋白。在正常组织细胞内,具有将生长信号从细胞外传送至细胞内的作用,促进细胞正常生长及分裂。HER-2 过表达,容易刺激癌细胞生长迅速,细胞侵袭性强、易转移,常与乳腺癌的发生、发展有关[17]。研究显示HER-2 是判断乳腺癌患者预后及分子靶向治疗的关键性标志物[18]。HER-2 阳性表达提示乳腺癌预后较差[19]。Ki-67 是反应细胞增殖的核抗原。Ki-67 阳性表达提示肿瘤细胞增殖活跃、生长速度快、恶性程度高、侵袭性强及预后不良。它被作为推断乳腺癌增殖活性、侵袭性的重要依据。经新辅助化疗后可有效降低Ki-67 表达,降低肿瘤细胞增殖能力,能减少复发率。
2.CESM 特征与ER、PR、HER-2、Ki-67 相关性
(1)肿块大小:本研究结果显示肿块最大径大于2 cm 组Ki-67 阳性表达率明显高于小于等于2 cm 组,差异具有统计学意义(P<0.05)。究其原因是增殖是乳腺癌患者最重要的特性之一,Ki-67 阳性表达越高,癌细胞的增殖速度越快,肿块组织增大越明显,进一步说明肿瘤组织恶性程度高、侵袭性强及预后不良。与张蜜等[20]研究显示肿瘤大小与Ki-67 的高表达有相关性研究一致,可根据肿瘤大小来评估病灶发展速度及患者预后。(2)形态:本研究中形态不规则组PR 及HER-2阳性表达率明显高于形态规则组,差异具有统计学意义(P 均<0.05),说明肿瘤形态越不规则,PR及HER-2 阳性表达率越高,提示乳腺癌预后越差。(3)微钙化是最常见的乳腺癌标志物。本研究显示有微钙化组的Ki-67 阳性率均明显高于无微钙化组(P<0.05),与靳凤梅等[21]研究乳腺癌自动乳腺全容积扫查(automated breast volumes cancer,ABVS)显示微钙化与ER、PR、Ki-67 的表达水平无明显相关性(P>0.05),与HER-2 阳性率相关,研究结论不一致。考虑为ABVS 对乳腺癌微钙化检出率不高(仅47.5%),明显低于本文CESM 微钙化检出率(81.82%)。微钙化与免疫组化标记物Ki-67 阳性表达呈密切相关,提示含微钙化肿瘤增殖活性、侵袭性更高。“毛刺征”是由乳腺恶性细胞侵入周围正常组织形成的星状畸变,本研究显示CESM“毛刺征”与ER 的阳性表达相关(P<0.05),与国外学者研究结论相 符[22]。显示CESM征象有“毛刺征”的乳腺癌患者对内分泌治疗敏感,预后较好。(5)肿瘤强化程度:研究[23]显示恶性肿瘤边缘存在大量微血管,随血管生长因子的趋化作用及瘤内压力梯度影响,肿瘤生长较快,因此注药后肿瘤常呈中重度强化。本文研究显示HER-2、Ki-67 与病变强化程度有关(P 均<0.05),与Łuczyńska 等[24]研究一致。
3.本研究不足之处
样本量有限,并未对不同病理分级的病例数均衡再分析,未分析不同分子亚型乳腺癌与CESM 形态学特征的关系。后期需应用影像组学方法进一步深入研究乳腺癌各分子亚型的影像学特点。
综上所述,乳腺癌CESM 形态学特征病灶大小、微钙化及强化程度与Ki-67 阳性表达有关;形态与PR 阳性表达有关;形态、强化程度与HER-2阳性表达有关;“毛刺征”与ER 阳性表达有关。CESM 影像特征可预估乳腺癌部分免疫组化生物学指标,间接评价病灶,在提供诊疗方案及预测预后和转归方面具有重要价值。
