甘薯糖转运蛋白IbSWEET15的功能研究
2023-01-12吴旭莉吴正丹晚传芳李賾萱王志前唐道彬王季春
吴旭莉 吴正丹 晚传芳 杜 叶 高 艳 李賾萱 王志前 唐道彬,3 王季春,3 张 凯,3,*
甘薯糖转运蛋白IbSWEET15的功能研究
吴旭莉1,2,**吴正丹1,2,4,**晚传芳1,2杜 叶1,2高 艳1,2李賾萱1王志前1唐道彬1,2,3王季春1,2,3张 凯1,2,3,*
1西南大学农学与生物科技学院, 重庆 400715;2薯类生物学与遗传育种重庆市重点实验室, 重庆 400715;3南方山地农业教育部工程研究中心, 重庆 400715;4广西壮族自治区农业科学院经济作物研究所, 广西南宁 530007
SWEET蛋白在植物生长发育、胁迫响应和糖代谢过程中具有重要的调控作用, 而甘薯SWEET蛋白的研究鲜有报道。开展甘薯SWEET蛋白功能研究, 揭示其在糖转运及淀粉与糖代谢中的功能, 具有重要的理论与实践意义。根据不同淀粉性状甘薯块根中差异表达的SWEET编码基因转录本, 设计引物进行RACE克隆, 获得全长cDNA序列。利用在线软件对进行生物信息学分析, 并构建系统发育树明确其分类。通过在本氏烟草中瞬时表达IbSWEET15-GFP融合蛋白, 明确IbSWEET15的亚细胞定位; 以酵母突变体互补试验, 验证IbSWEET15蛋白在酵母中的糖转运功能。通过实时荧光定量PCR (qRT-PCR)分析在甘薯各器官中的表达特征; 构建表达载体并通过蘸花法转化拟南芥野生型Col-0, 获得异源表达拟南芥株系, 比较转基因株系与野生型拟南芥植株的淀粉和糖含量差异, 以明确IbSWEET15在淀粉和糖代谢过程中的功能。基因开放阅读框为879 bp, 编码292个氨基酸组成的SWEET蛋白, 具有2个MtN3_slv保守结构域及7个跨膜结构域, 属于SWEET蛋白家族第III分支成员。IbSWEET15定位于质膜, 在酵母中无蔗糖和己糖转运功能, 其编码基因在甘薯侧枝中表达量最高, 主茎、叶次之, 块根中最低。的拟南芥过表达株系的叶片可溶性糖含量显著下降, 而种子可溶性糖和淀粉含量均高于野生型。推测可能在光合产物源-库运输过程中的韧皮部装载以及植株淀粉和糖积累方面具有重要作用。本研究为揭示在甘薯淀粉和糖代谢及重要品质性状形成中的功能提供了重要信息。
甘薯;; 可溶性糖; 淀粉
甘薯((L.) Lam.)是重要的粮食、饲料、蔬菜和工业原料作物, 具有用途广和适应性强等特点[1]。淀粉和可溶性糖含量是甘薯的重要品质性状, 其中, 淀粉占甘薯块根干重的50%~80%[2], 是甘薯作为工业原料与新型能源制备的物质基础[3-5]。可溶性糖含量对甘薯块根食用和加工品质有重要影响, 虽然其组分含量在不同品种块根中有所差异, 但蔗糖占比始终不低于68%[6]。蔗糖, 作为大多数植物光合作用的终产物, 通过韧皮部维管束系统从“源”叶, 运输到根、茎、种子等“库”器官, 以满足植物生长发育所需[7]。韧皮部运输以质外体途径或共质体途径方式进行[8]。大部分植物中蔗糖的韧皮部运输需要借助SWEET (sugars will eventually be exported by transporter)蛋白将蔗糖以被动运输的形式外排至韧皮部周围的胞壁空间, 再经蔗糖转运蛋白SUC/SUT介导的次级主动运输进入筛管-伴胞(SE-CC)复合体[9-12]。随后, 蔗糖以自身或转化为淀粉和脂质等复合物的形式贮藏在库器官中[13]。因此, SWEET在甘薯淀粉和糖的积累过程中起到关键作用。但是迄今为止, 对甘薯中SWEET的分离鉴定及功能分析仍然较少。
植物中主要有3类糖转运蛋白: 蔗糖转运蛋白、单糖转运蛋白和SWEET蛋白。其中, SWEET蛋白是近年新发现的一类蛋白, 在真核生物中具有7次跨膜结构域(7TM)以及2个MtN3_slv保守结构域, 能够不依赖H+浓度梯度双向运输糖[14-17]。植物SWEET蛋白分为4个亚类, 第I、II、IV类偏好转运己糖, 第III类主要转运蔗糖, 也可能具有己糖转运活性[18]。这些蛋白多位于质膜, 例如SWEET1、8、9、11、12、15, 高尔基体(SWEET9、15)、液泡膜(SWEET16、17、2)、内质网上也有分布[18-20]。迄今为止, 已发现SWEET家族成员在植物生长发育、胁迫响应和糖代谢等方面发挥了重要的生理作用[21], 包括韧皮部装载、蜜腺分泌、籽粒灌浆、花粉发育、以及病原菌胁迫响应等[8,17,22-24]。番茄() SlSWEET15以及拟南芥() AtSWEET11和AtSWEET12通过调节韧皮部细胞蔗糖的外流介导韧皮部装载[17,25]。拟南芥、白菜()、渐狭叶烟草()蜜腺中特异表达的SWEET9蛋白影响了花蜜的产生与分泌[23]。矮牵牛花()蜜腺中(SWEET9的同源物)的表达水平与蜜腺淀粉含量负相关, 其编码蛋白也可能参与蜜腺分泌[26]。水稻()中,、、和可能不同程度的影响着植株生长和发育进程, 并在籽粒灌浆方面发挥了重要作用[27]。通过在种子发育早期介导蔗糖从胚乳向胚胎的输出, 从而影响大豆()的胚胎发育[28]。茉莉()花期转录组数据表明,可能调控茉莉的开花和繁殖过程[29]。此外,可以被根结线虫诱导, 在侵染早期发挥重要作用[30]。水稻品种中花11中基因的破坏, 使得植株对非洲水稻白叶枯病菌(pv.)菌株AXO1947和亚洲水稻白叶枯病菌菌株PXO86的抗性增强[31]。
目前已报道了基因可以增强甘薯对尖孢镰刀菌()的抗性[32], 但更多SWEET在甘薯中的作用尚不明确, 有待进一步研究。前期通过转录组分析, 从不同淀粉和糖性状甘薯块根中筛选获得一个差异表达的SWEET编码基因[4], 本研究拟克隆该基因, 对其编码蛋白进行功能鉴定, 并分析其在糖转运和淀粉积累方面的作用, 为进一步揭示甘薯淀粉与糖代谢的调控机制, 以及利用SWEET开展甘薯重要品质性状分子改良奠定基础。
1 材料与方法
1.1 试验材料与菌株
甘薯品种徐薯22 ((L.) Lam. cv. XS22)、哥伦比亚生态型(Col-0)拟南芥和本氏烟草()均由薯类生物学与遗传育种重庆市重点实验室提供。甘薯种植于本实验室歇马试验基地, 其余植物材料均种植于本实验室长日照植物生长间, 生长条件为22~25℃, 相对湿度70%。大肠杆菌() DH5α感受态细胞、农杆菌() GV3101感受态细胞和pEASY-T5 Zero Cloning Kit试剂盒购自北京全式金生物技术股份有限公司。酵母菌株SEY2102和EBY.VW4000、载体pCAMBIA1300-GFP、pDR196、pEarleyGate101均由薯类生物学与遗传育种重庆市重点实验室提供。
1.2 试验方法
1.2.1基因的克隆及测序 利用植物总RNA提取试剂盒(天根生化科技(北京)有限公司)提取甘薯主茎、叶、侧枝、块根总RNA, 通过反转录试剂盒(北京全式金生物技术股份有限公司)合成cDNA。基因全长序列通过SMARTer RACE cDNA Amplification Kit试剂盒(CLONTECH) 采用RACE (rapid-amplification of cDNA end)克隆获得, 反应产物由EasyPure Quick Gel Extraction Kit胶回收试剂盒(北京全式金生物技术股份有限公司)进行胶回收, 连接至pEASY-T5 Zero Cloning载体上, 转化大肠杆菌DH5α感受态细胞, 挑选阳性菌落进行测序(生工生物工程(上海)股份有限公司)。使用Geneious Prime设计本研究所用引物(表1)。

表1 本研究所用引物
1.2.2 生物信息学分析 利用Geneious Prime分析的开放阅读框。通过ProtParam tool (http://web.expasy.org/protparam)计算该基因编码蛋白的分子量和等电点。由SMART (http://smart.embl- heidelberg.de)、TMHMM 2.0 Server (http://www.cbs. dtu.dk/services/TMHMM-2.0)、SignalP (http://www. cbs.dtu.dk/services/SignalP)在线分析软件分别预测IbSWEET15蛋白的保守结构域、跨膜结构域和信号肽。NetPhos 3.1 server (http://www.cbs.dtu.dk/services/ NetPhos)用于蛋白磷酸化位点预测。Plant-mPLoc (http://www.csbio.sjtu.edu.cn/cgi-bin/PlantmPLoc.cgi)用于蛋白亚细胞定位预测。通过ClustalW方法进行蛋白多序列比对后, 采用MEGA 7.0软件的相邻连接法(Neighbor-Joining, NJ), 进行1000次随机抽样重复, 构建系统发育树。
1.2.3 烟草瞬时表达 以I和H I作为双酶切位点, 采取无缝克隆法构建pCAMBIA1300- IbSWEET15-GFP融合表达载体, 转化农杆菌感受态GV3101。将含有pCAMBIA1300-IbSWEET15-GFP载体和pCAMBIA1300-GFP空载体的农杆菌细胞悬浮液分别与融合了mCherry的质膜定位标记基因共注射本氏烟草顶三叶, 黑暗培养2 d后, 在蔡司LSM800激光共聚焦显微镜下观察荧光信号。GFP激发光波长488 nm, 发射光波长505~530 nm[33], mCherry激发光波长561 nm, 发射光波长600~650 nm。
1.2.4 基因表达分析 分别取甘薯品种徐薯22栽插后95 d的块根、主茎、叶和侧枝, 检测基因的组织表达模式。块根取整个薯块切碎后混合; 主茎、侧枝和叶分别取地面以上15 cm的主茎、基部分枝处以外20 cm长的侧枝和整片成熟叶片3片, 分别剪碎后混合, 于液氮中冷冻研磨后, 利用植物总RNA提取试剂盒(天根生化科技(北京)有限公司)提取各组织部位RNA, 采用反转录试剂盒(北京全式金生物技术股份有限公司)合成cDNA。以各组织部位cDNA为模板, 在荧光定量PCR仪(Bio-Rad CFX96 Connect Real-Time PCR Detection System)上进行实时荧光定量PCR (qRT-PCR)检测。内参基因选用甘薯泛素(UBI)和组蛋白(H2B)编码基因[34], 内参引物为IbH2B-QF/R和IbUBI-QF/R (表1)。反应体系参照TransStart Top Green qPCR SuperMix试剂盒(北京全式金生物技术股份有限公司) 配制, 反应程序为95℃ 5 min; 95℃ 10 s, 57℃ 30 s, 40个循环, 熔解曲线60~95℃, 增量0.5℃。由琼脂糖凝胶电泳和熔解曲线确定qRT-PCR产物的特异性。采用2-ΔΔCt法分析[35]基因的相对表达水平。每个组织取3个生物学重复, 并进行3次独立重复试验。
1.2.5 酵母突变体功能互补验证 将构建好的pDR196-IbSWEET15、pDR196空载和pDR196- StSUT1[36]阳性对照载体分别转化酵母转化酶突变株SEY2102[37], 挑选阳性酵母单克隆分别对应点斑于以蔗糖或葡萄糖为唯一碳源的SD/-Ura固体培养基上, 30℃培养3~5 d。将上述载体与pDR196- ScHXT5[38]阳性对照载体分别转化己糖运输缺陷型酵母EBY.VW4000[39]菌株, 验证IbSWEET15是否具有己糖转运功能。
1.2.6 拟南芥的遗传传化 通过Gateway系统(pENTR/D-TOPO Cloning Kit试剂盒和Gateway LR Clonase II Enzyme Mix, Invitrogen)将亚克隆至超量表达载体pEarleyGate101中。采用蘸花法将含有pEarleyGate101-IbSWEET15重组表达载体的农杆菌GV3101细胞悬浮液浸染野生型拟南芥Col-0, 暗处理24 h后, 置于正常条件下培养至种子收获[40]。播种4℃春化处理过的T1代种子, 2~3周后对幼苗叶片喷施0.01% Basta, 并将初步筛选获得的抗性苗移栽至新的花盆中, 待其生长一段时间后, 以十六烷基三甲基溴化铵(CTAB)法提取其基因组DNA, 进行PCR鉴定, 获得独立转化的株系, 并从T2代株系中筛选至少3个纯合株系用于下一步实验。
1.2.7 免疫印迹检测 取拟南芥抽薹前的整株叶片, 用液氮快速研磨成粉末, 称取0.15 g样品加入0.30 mL的缓冲液(50 mmol L–1Tris-HCl (pH 7.5), 150 mmol L–1NaCl, 1 mmol L–1EDTA, 10% glycerol, 10 mmol L–1DTT, 0.5% Triton X-100, 1 mmol L–1PMSF)提取植物总蛋白。利用7.5%的SDS-PAGE凝胶分离蛋白质并转移至PVDF膜(Millipore), 使用兔抗GFP多克隆抗体(生工生物工程(上海)股份有限公司)进行蛋白质印迹检测(WB)。
1.2.8 碳水化合物的测定 参照Kunz等[41]的方法测定拟南芥叶片和种子中淀粉和可溶性糖含量。用Microsoft Excel 2020和OriginPro 2022处理系统分析数据并作图。拟南芥抽薹前, 取材叶片用KI-I2溶液(2% KI, 1% I2)进行碘染, 观察并照相。
2 结果与分析
2.1 甘薯IbSWEET15基因的克隆及其编码蛋白分析
前期转录组分析发现unigene (comp82605_c0_ seq1)在3种不同淀粉和糖含量的甘薯品种块根发育过程中有差异表达, 但表达量均较低[4]。根据序列设计特异性引物(表1), 由RACE克隆获得了全长1126 bp的cDNA序列。该基因开放阅读框为879 bp, 编码292个氨基酸残基组成的IbSWEET15蛋白, 分子量为32.80 kD, 等电点7.74, 属于弱碱性蛋白。在线预测分析表明IbSWEET15无信号肽, 可能存在11个丝氨酸、5个苏氨酸和2个酪氨酸磷酸化位点, 以及同SWEET家族中的OsSWEET15、VvSWEET15和AtSWEET15蛋白类似, 都具有2个典型的MtN3_slv (pfam03083)保守结构域(图1-A)。系统发育分析表明, IbSWEET15蛋白属于SWEET家族第III分支成员, 与AtSWEET15亲缘关系较近(图1-B), 一致性为43.39%, 与IbSWEET10氨基酸序列的一致性为43.18%。根据与拟南芥SWEET成员的同源性, 本研究中将该基因命名为(登录号为OL625669)。SWEET家族第III分支成员多定位于细胞膜, 且在线分析结果表明IbSWEET15属于含7个跨膜结构域的质膜定位蛋白(图1-C)。通过在烟草中瞬时表达pCAMBIA1300-IbSWEET15-GFP发现, 转化对照载体定位于细胞核、细胞膜以及细胞质中(图1-D), 而IbSWEET15与质膜标记蛋白共定位(图1-E), 证明其定位于质膜, 与预测结果一致。
2.2 IbSWEET15的糖转运功能分析
SWEET家族第III分支的蛋白主要转运蔗糖[17], 但SEY2102酿酒酵母蔗糖转运蛋白突变菌株的互补试验表明, 分别转入了pDR196-IbSWEET15载体与空载pDR196的突变菌株在以2%蔗糖为唯一碳源的固体培养基中, 长势均弱于阳性对照pDR196- StSUT1 (图2-A)。分别将转入了pDR196-IbSWEET15载体与空载pDR196的SEY2102菌株接种到以2%蔗糖为唯一碳源的液体培养基中, 待阳性对照菌液明显浑浊时, 阴性对照与试验组菌液仅略微混浊(图2-B)。菌体密度检测结果表明, 转入pDR196-IbSWEET15载体和空载体的菌株间生长菌液浓度(OD600)无显著差异, 但与阳性对照生长菌液浓度存在极显著差异(图2-C), 说明IbSWEET15可能不具有蔗糖转运功能。

(图1)
A: IbSWEET15蛋白保守结构域分析(红色框内代表MtN3_slv保守结构域)。VvSWEET15 (登录号为P0DKJ5.1): 葡萄() SWEET蛋白; AtSWEET15 (登录号为Q9FY94.1): 拟南芥SWEET蛋白; OsSWEET15 (登录号为Q6K602.1): 水稻SWEET蛋白。B: 甘薯IbSWEET15、IbSWEET10蛋白和拟南芥SWEET蛋白家族的系统发育树。C: IbSWEET15蛋白跨膜结构域预测。pCAMBIA1300-GFP (D)和pCAMBIA1300-IbSWEET15-GFP (E)分别与细胞膜标记蛋白(红色荧光)共定位于质膜。标尺为20 μm或10 μm。
A: the analysis of the conserved domain of IbSWEET15 (The red box represents the conserved MtN3_slv structural domain). VvSWEET15 (accession number: P0DKJ5.1): grape () SWEET protein.AtSWEET15 (accession number: Q9FY94.1):SWEET protein. OsSWEET15 (accession number: Q6K602.1): rice SWEET protein. B: phylogenetic tree of sweet potato IbSWEET15 and IbSWEET10 proteins withSWEET protein family. C: the prediction of the transmembrane structural domain of IbSWEET15 protein. pCAMBIA1300-GFP (D) andpCAMBIA1300-IbSWEET15-GFP (E) the co-localized with the plasma membrane-located marker protein (red fluorescence). Bars: 20 μm or 10 μm.

图2 IbSWEET15的蔗糖(A~C)和己糖(D)转运功能鉴定
1、2、3分别表示成功转化pDR196、pDR196-StSUT1和pDR196-IbSWEET15载体的SEY2102菌株。转化的SEY2102菌株在含2%蔗糖的固体SD培养基上(A)和在液体SD培养基中的生长情况(B)及其菌体密度(OD600值) (C)。分别转化了pDR196-ScHXT5 (左), pDR196 (中), pDR196-IbSWEET15 (右)载体的EBY.VW4000菌株在含2%麦芽糖或不同己糖(葡萄糖、果糖、甘露糖、半乳糖)的固体SD培养基中的生长情况(D)。1×、20×、1、10、100、1000分别表示稀释倍数。ns表示无显著差异。***表示在0.001水平差异显著。标尺为0.5 cm。
1, 2, and 3 represent the SEY2102 strains that successfully transformed pDR196, pDR196-StSUT1, and pDR196-IbSWEET15 vectors, respectively. Growth of transformed SEY2102 strains in solid SD medium (A) and liquid (B) SD medium containing 2% sucrose and their cell density (OD600value) (C). Growth of EBY.VW4000 strains transformed with pDR196-ScHXT5 (left), pDR196 (middle), and pDR196-IbSWEET15 (right) vectors on solid SD medium containing 2% maltose or different hexoses (glucose, fructose, mannose, and galactose), respectively. 1×, 20×, 1, 10, 100, and 1000represent dilution times, respectively. ns: no significant difference. *** means significant difference at the 0.001 probability level. Bar: 0.5 cm.
有研究发现, SWEET家族第III分支的AtSWEET13蛋白, 参与花粉发育过程中蔗糖和葡萄糖的跨膜运输[42]。为验证IbSWEET15是否参与单糖运输, 将pDR196-IbSWEET15载体转化酿酒酵母单糖转运蛋白突变体EBY.VW4000, 分别稀释1、10、100和1000倍后点斑发现, 在以麦芽糖为唯一碳源的培养基上, 转化pDR196-IbSWEET15的突变酵母菌株可正常生长; 但是在以葡萄糖、果糖、甘露糖和半乳糖为唯一碳源的培养基中, 转化pDR196- IbSWEET15和空载pDR196的酵母长势一致, 均弱于阳性对照pDR196-ScHXT5 (图2-D)。表明IbSWEET15蛋白可能不具备上述己糖的转运能力。
2.3 IbSWEET15在甘薯各组织器官中的表达
取材移栽后95 d 的徐薯22侧枝、块根、主茎和叶, 采用qRT-PCR检测不同组织部位中的表达水平。结果表明,在甘薯侧枝中的表达量最高, 主茎、叶次之, 均极显著高于块根中的表达量(图3)。侧枝中的表达量高达块根中表达量的1418倍, 而叶和主茎中表达量分别是块根中表达量的31倍和26倍。
2.4 IbSWEET15在转基因拟南芥中的异源表达及其对植株生长发育的影响
以CTAB法提取拟南芥抗性苗的基因组DNA进行阳性鉴定后, 从T2代株系中进一步筛选获得4个T3代纯合转基因株系: IbSWEET15-219、IbSWEET15- 246、IbSWEET15-266和IbSWEET15-270。通过qRT-PCR检测发现, 这4个转基因株系中的表达量均极显著高于野生型拟南芥中的表达量, 其中, 株系IbSWEET15-270中的表达量最高, 是野生型拟南芥中表达量的136倍; 株系IbSWEET15-219和IbSWEET15-246中的表达量次之, 分别是野生型拟南芥中表达量的132倍和46倍; 株系IbSWEET15-266中的表达量最低, 为野生型拟南芥中表达量的24倍(图4-A)。免疫印迹结果表明, 除了不能正常表达外源基因编码蛋白, 其余株系中均能稳定表达(图4-B), 因此, 采用株系IbSWEET15-219、IbSWEET15- 246和IbSWEET15-270进行后续试验。在整个植株生长发育期间对转基因植株与Col-0野生型植株的表型进行观察发现, 转基因植株与对照植株生长发育进程基本一致, 植株及叶片大小等无明显差异, 可见的异源表达未对转基因拟南芥的生长发育造成影响(图4-C)。
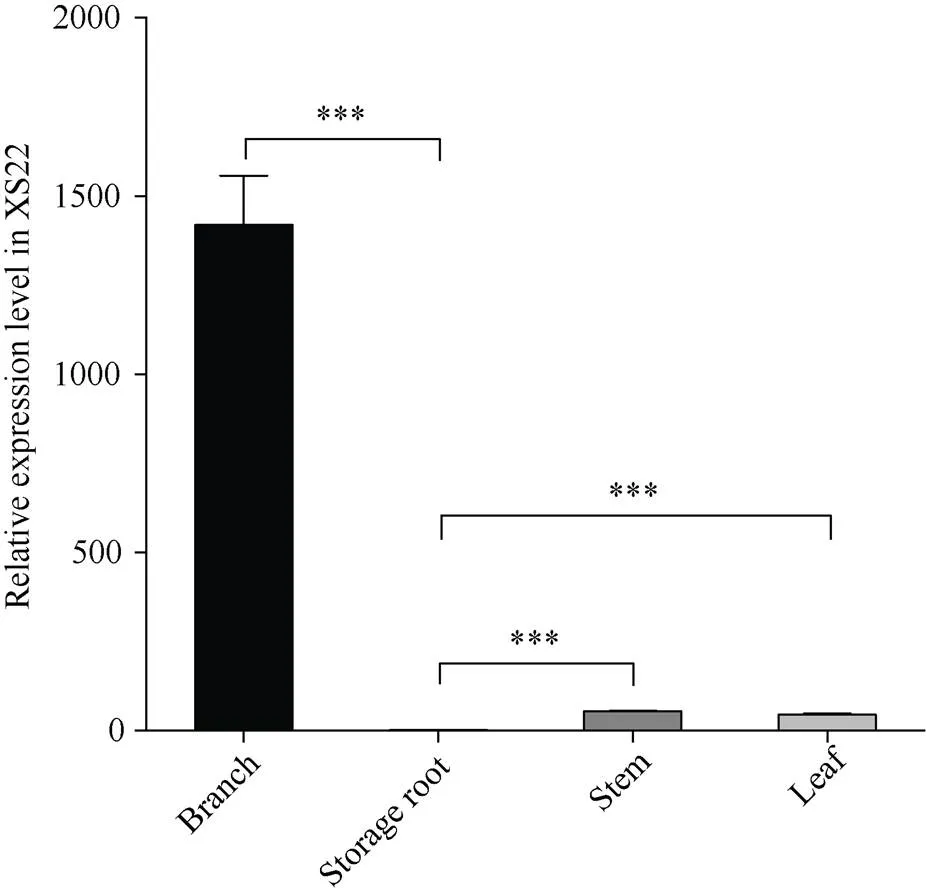
图3 IbSWEET15在甘薯各器官中的表达量
XS22: 徐薯22。***表示在0.001水平差异显著。
XS22: Xushu 22. *** means significant difference at the 0.001 probability level.
2.5 IbSWEET15对拟南芥中碳水化合物代谢的影响
为鉴定对拟南芥植株碳水化合物代谢的影响, 测定了转基因植株叶片和种子中可溶性糖与淀粉含量。结果表明, 异源表达的拟南芥株系IbSWEET15-219和IbSWEET15-270叶片中可溶性糖含量显著低于野生型对照植株(图5-A), 株系IbSWEET15-270种子可溶性糖含量显著高于野生型对照(图5-A)。转基因株系IbSWEET15-270成熟种子中淀粉含量极显著高于对照(图5-B)。KI-I2叶片染色结果显示转基因株系叶片相比野生型对照积累了较多的淀粉(图5-C), 但淀粉含量测定结果表明, 转基因株系叶片中的淀粉含量与对照相比无显著差异(图5-B)。表明的异源表达引起了拟南芥叶片和种子中淀粉和糖含量的变化,可能参与了植物体淀粉积累和糖含量的调控。
3 讨论
蔗糖是植物生长的主要能量物质和信号调节分子[43], 而SWEET蛋白在蔗糖的韧皮部运输过程中具有至关重要的作用。本研究系统发育分析结果表明, IbSWEET15与拟南芥中AtSWEET15的亲缘关系最为接近, 都属于SWEET家族第III分支中具有7TM的质膜定位蛋白[44](图1-B~E)。真核生物的SWEET蛋白由一个TM螺旋连接2个3-TM单元形成3-1-3排列的7TM拓扑结构[14]。编码这些蛋白的基因最初被命名为基因, 后来发现其具备调节蔗糖跨膜运输的功能又命名为SWEET基因家族[16-17]。作为SWEET基因家族成员, 在移栽后95 d的甘薯侧枝中表达量最高, 其次是主茎和叶, 在块根中的表达量最低(图3), 表明可能主要参与甘薯光合产物源库运输过程中韧皮部蔗糖的装载过程。
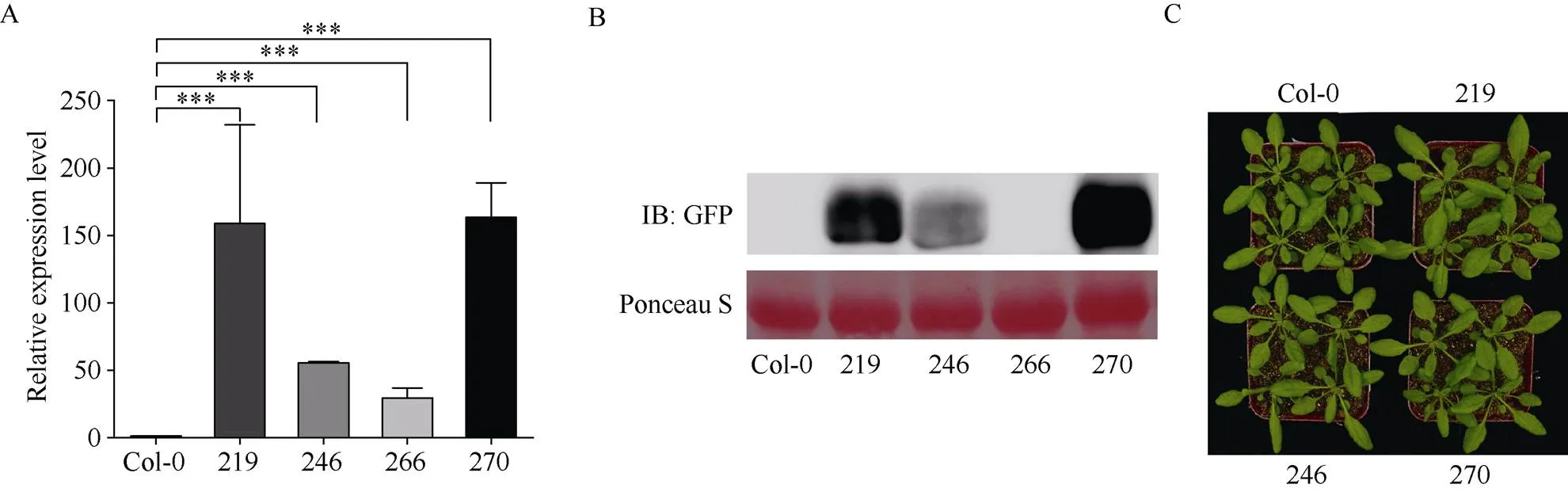
图4 IbSWEET15在拟南芥中的异源表达及转基因植株的形态
A: 转基因拟南芥中的表达量检测; B: 免疫印迹检测转基因植株中IbSWEET15蛋白表达; C: 转基因植株的表型观察。219、246、266、270分别代表转基因株系、、和。***表示在0.001水平差异显著。
A: the detection of the expression ofin transgenic; B: western blot detection of IbSWEET15 protein expression in transgenic plants; C: phenotypic observation of transgenic plants. 219, 246, 266, and 270 represent transgenic lines,,, and, respectively. *** means significant difference at the 0.001 probability level.
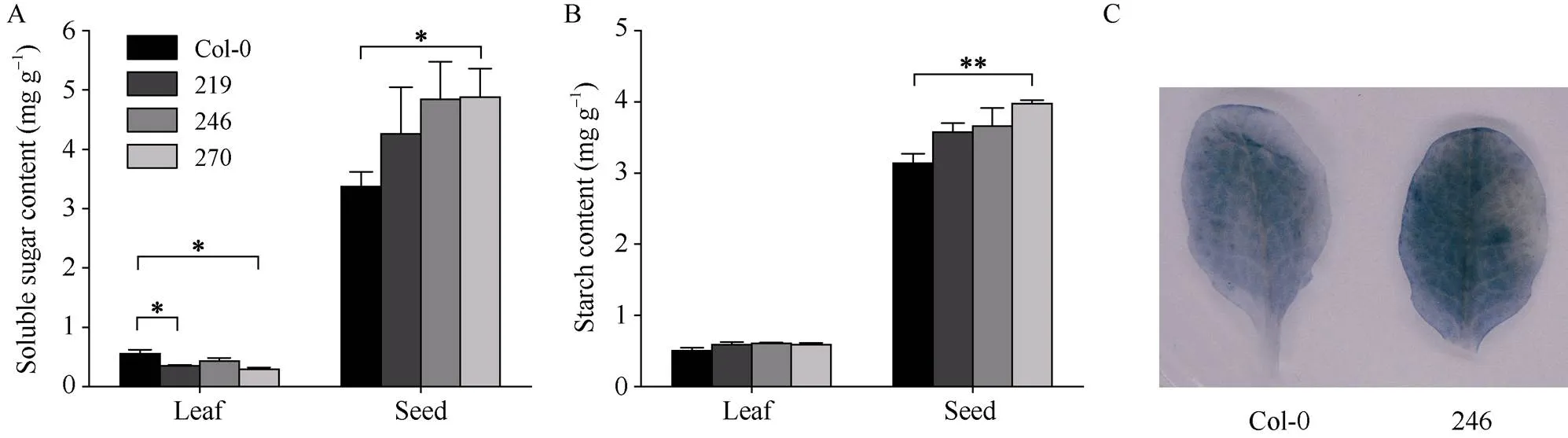
图5 IbSWEET15的异源表达改变了拟南芥淀粉和可溶性糖含量
*、**分别表示在0.05、0.01水平差异显著。219、246、270分别代表转基因株系IbSWEET15-219、IbSWEET15-246和IbSWEET15-270。
* and ** mean significant difference at the 0.05 and 0.01 probability levels, respectively. 219, 246, and 270 represent transgenic lines IbSWEET15-219, IbSWEET15-246, and IbSWEET15-270, respectively.
的编码蛋白含有2个典型的MtN3_ slv结构域(图1-A), 但在SEY2102酿酒酵母蔗糖转运蛋白突变菌株中的表达并不能恢复该菌株的蔗糖转运功能(图2-A~C)。基于已有研究发现, 在酵母突变体中异源表达质膜和液泡膜定位的番茄基因时, 其编码蛋白的蔗糖转运活性较低, 可能是由于该蛋白主要存在于酵母液泡中[25], 导致其糖转运功能受到限制[19], 猜测IbSWEET15除质膜定位外, 可能在其他部位也有表达, 且该转运蛋白对蔗糖的亲和力较低。由于第III分支的AtSWEET13蛋白, 在花粉发育期间, 参与了蔗糖与葡萄糖的跨膜运输[42], 表明III类SWEET蛋白也能转运单糖。因此, 本研究利用酵母突变体, 进一步鉴定了IbSWEET15对多种己糖的转运功能。通过在酵母己糖转运蛋白缺陷菌株EBY.VW4000中异源表达发现, 其编码蛋白并不能恢复该菌株在不同己糖作为碳源培养基中的正常生长(图2-D)。这可能是由于植物蛋白在酵母系统中异源表达, 无法正确结合酵母的细胞膜或者缺乏必要的蛋白修饰[45-46]; 也可能是由于IbSWEET15对除蔗糖和已检测的几种己糖外的其他糖类有转运功能, 或在甘薯植株中存在其他未知功能[47]。
在拟南芥中异源表达基因, 与对照Col-0植株相比, 转基因植株形态未受到影响(图4-C),但基因表达量最高的转基因株系中, 叶片可溶性糖含量显著降低, 而种子可溶性糖含量和淀粉含量分别显著和极显著提高, 表明的异源表达可能促进了拟南芥叶片中的糖转运和淀粉积累, 并通过促进光合产物源-库运输中韧皮部蔗糖的装载, 促进了贮藏器官种子中淀粉和糖的积累(图5-A, B)。表达量相对较低的转基因株系中, 叶片可溶性糖含量显著降低, 但降低程度与相比较低(图5-A)。而表达量最低的转基因株系中, 叶片和种子的可溶性糖和淀粉含量均无显著差异, 表明的异源表达量能够影响转基因株系的糖转运和淀粉积累程度, 但是在正常培养条件下, 其表达量需达到一定水平才能促进光合器官中的糖转运和贮藏器官中的淀粉和糖积累(图5-A, B)。同样, 在拟南芥中异源表达()基因, 植物糖运输也受到影响, 转基因株系相比野生型植株, 蔗糖含量显著下降,果糖和葡萄糖含量显著升高[48]。基因在葡萄开始成熟时强烈表达, 使得果实葡萄糖和果糖含量提高[49]。此外, 植物中基因表达的变化也伴随着植株淀粉含量的变化。拟南芥双突变体和玉米()突变体植株的生长明显受到负调控, 而叶片糖和淀粉含量均增加, 且双突变体从叶柄流出的[14C]放射性示踪剂也减少[17,50]。Li等[51]鉴定了7个水稻基因, 发现它们在种子发育过程中的糖运输以及糖-淀粉的转化方面发挥了重要作用, 其中, 转录组测序结果表明突变体的糖-淀粉代谢途径明显改变。葡萄和番茄转基因株系相比野生型, 其他糖运输相关基因与转化酶基因的表达水平也受到影响[52-53]。
本研究发现, 虽然酵母突变体互补试验显示IbSWEET15在酵母系统中不具有蔗糖与己糖的转运功能, 但是在拟南芥中异源表达后,的表达量增加伴随着淀粉和可溶性糖含量的变化, 表明基因在光合产物源-库运输、淀粉积累和糖代谢过程中具有重要的调控作用, 其功能有待进一步挖掘。此外, 异源表达并未对转基因拟南芥的生长发育造成影响, 但是促进了种子中淀粉积累和糖含量的提高, 也表明了基因在农作物产量和品质改良中具有一定的利用价值。
4 结论
本研究成功克隆获得1个新的甘薯SWEET编码基因。该基因编码了含有292个氨基酸的SWEET蛋白家族第III类蛋白。在酵母系统中不具备蔗糖与己糖转运功能, 但在甘薯侧枝中具有较高的表达水平, 且与对照相比, 异源表达基因的拟南芥植株种子中的淀粉和可溶性糖含量增加, 叶片淀粉含量增加, 而可溶性糖含量减少, 推测该基因在光合产物的源库间运输, 以及淀粉和糖代谢过程中具有重要功能。
[1] Wang Z Y, Fang B P, Chen J Y, Zhang X J, Luo Z X, Huang L F, Chen X L, Li Y J. De novo assembly and characterization of root transcriptome using Illumina paired-end sequencing and development of cSSR markers in sweetpotato ()., 2010, 11: 726.
[2] Wang H L, Yang Q H, Ferdinand U, Gong X W, Qu Y, Gao W C, Ivanistau A, Feng B L, Liu M H. Isolation and characterization of starch from light yellow, orange, and purple sweet potatoes., 2020, 160: 660–668.
[3] Montefusco A, Durante M, Grassi S, Piro G, Dalessandro G, Lenucci M S. Assessment of sweet potato [(L.) Lam] for bioethanol production in southern Italy., 2014, 148: 1117–1126.
[4] Zhang K, Wu Z D, Tang D B, Luo K, Lu H X, Liu Y Y, Dong J, Wang X, Lyu C W, Wang J C, Lu K. Comparative transcriptome analysis reveals critical function of sucrose metabolism related-enzymes in starch accumulation in the storage root of sweet potato., 2017, 8: 914.
[5] Yokoi H, Saitsu A, Uchida H, Hirose J, Hayashi S, Takasaki Y. Microbial hydrogen production from sweet potato starch residue., 2001, 91: 58–63.
[6] 沈升法, 项超, 吴列洪, 李兵, 罗志高. 甘薯块根可溶性糖组分特征及其与食味的关联分析. 中国农业科学, 2021, 54: 34–45.
Shen S F, Xiang C, Wu L H, Li B, Luo Z G. Analysis on the characteristics of soluble sugar components in sweetpotato storage root and its relationship with taste., 2021, 54: 34–45 (in Chinese with English abstract).
[7] Durand M, Mainson D, Porcheron B, Maurousset L, Lemoine R, Pourtau N. Carbon source-sink relationship in: the role of sucrose transporters., 2018, 247: 587–611.
[8] Chen L Q. SWEET sugar transporters for phloem transport and pathogen nutrition., 2014, 201: 1150–1155.
[9] Xu Q Y, Yin S J, Ma Y, Song M, Song Y J, Mu S C, Li Y S, Liu X H, Ren Y J, Gao C, Chen S L, Liesche J. Carbon export from leaves is controlledubiquitination and phosphorylation of sucrose transporter SUC2., 2020, 117: 6223–6230.
[10] Julius B T, Leach K A, Tran T M, Mertz R A, Braun D M. Sugar transporters in plants: new insights and discoveries., 2017, 58: 1442–1460.
[11] Ruan Y L. Sucrose metabolism: gateway to diverse carbon use and sugar signaling., 2014, 65: 33–67.
[12] Fernie A R, Bachem C W B, Helariutta Y, Neuhaus H E, Prat S, Ruan Y L, Stitt M, Sweetlove L J, Tegeder M, Wahl V, Sonnewald S, Sonnewald U. Synchronization of developmental, molecular and metabolic aspects of source-sink interactions., 2020, 6: 55–66.
[13] Keller I, Rodrigues C M, Neuhaus H E, Pommerrenig B. Improved resource allocation and stabilization of yield under abiotic stress., 2021, 257: 153336.
[14] Chen L Q, Hou B H, Lalonde S, Takanaga H, Hartung M L, Qu X Q, Guo W J, Kim J G, Underwood W, Chaudhuri B, Chermak D, Antony G, White F F, Somerville S C, Mudgett M B, Frommer W B. Sugar transporters for intercellular exchange and nutrition of pathogens., 2010, 468: 527–532.
[15] Yuan M, Zhao J, Huang R, Li X, Xiao J, Wang S. Ricegene family: evolution, expression profiling, and sugar transport., 2014, 56: 559–570.
[16] Li X, Si W, Qin Q, Wu H, Jiang H. Deciphering evolutionary dynamics ofgenes in diverse plant lineages., 2018, 8: 13440.
[17] Chen L Q, Qu X Q, Hou B H, Sosso D, Osorio S, Fernie A R, Frommer W B. Sucrose efflux mediated by SWEET proteins as a key step for phloem transport., 2012, 335: 207–211.
[18] Feng L, Frommer W B. Structure and function of semiSWEET and SWEET sugar transporters., 2015, 40: 480–486.
[19] Chen H Y, Huh J H, Yu Y C, Ho L H, Chen L Q, Tholl D, Frommer W B, Guo W J. Thevacuolar sugar transporter SWEET2 limits carbon sequestration from roots and restrictsinfection., 2015, 83: 1046–1058.
[20] Anjali A, Fatima U, Manu M S, Ramasamy S, Senthil-Kumar M. Structure and regulation of SWEET transporters in plants: an update., 2020, 156: 1–6.
[21] Jeena G S, Kumar S, Shukla R K. Structure, evolution and diverse physiological roles of SWEET sugar transporters in plants., 2019, 100: 351–365.
[22] Sun M X, Huang X Y, Yang J, Guan Y F, Yang Z N. Arabidopsis RPG1 is important for primexine deposition and functions redundantly with RPG2 for plant fertility at the late reproductive stage., 2013, 26: 83–91.
[23] Lin I W, Sosso D, Chen L Q, Gase K, Kim S G, Kessler D, Klinkenberg P M, Gorder M K, Hou B H, Qu X Q, Carter C J, Baldwin I T, Frommer W B. Nectar secretion requires sucrose phosphate synthases and the sugar transporter SWEET9., 2014, 508: 546–549.
[24] Sosso D, Luo D P, Li Q B, Sasse J, Yang J L, Gendrot G, Suzuki M, Koch K E, McCarty D R, Chourey P S, Rogowsky P M, Ross-Ibarra J, Yang B, Frommer W B. Seed filling in domesticated maize and rice depends on SWEET-mediated hexose transport., 2015, 47: 1489–1493.
[25] Ko H Y, Ho L H, Neuhaus H E, Guo W J. Transporter SlSWEET15 unloads sucrose from phloem and seed coat for fruit and seed development in tomato., 2021, 187: 2230–2245.
[26] Ge Y X, Angenent G C, Wittich P E, Peters J, Franken J, Busscher M, Zhang L M, Dahlhaus E, Kater M M, Wullems G J, Creemers-Molenaar T., a novel gene, highly expressed in nectary tissue of., 2000, 24: 725–734.
[27] Hu Z, Tang Z, Zhang Y, Niu L, Yang F, Zhang D, Hu Y. Rice SUT and SWEET transporters., 2021, 22: 11198.
[28] Wang S D, Yokosho K, Guo R Z, Whelan J, Ruan Y L, Ma J F, Shou H X. The soybean sugar transporter GmSWEET15 mediates sucrose export from endosperm to early embryo., 2019, 180: 2133–2141.
[29] Wang P P, Wei P N, Niu F F, Liu X F, Zhang H L, Lyu M L, Yuan Y, Wu B H. Cloning and functional assessments of floral- expressedtransporter genes from., 2019, 20: 4001.
[30] Zhao D, You Y, Fan H Y, Zhu X F, Wang Y Y, Duan Y X, Xuan Y H, Chen L J. The role of sugar transporter genes during early infection by root-knot nematodes., 2018, 19: 302.
[31] Zeng X, Luo Y F, Vu N T Q, Shen S J, Xia K F, Zhang M Y. CRISPR/Cas9-mediated mutation ofin rice cv. Zhonghua 11 confers resistance topv.without yield penalty., 2020, 20: 313.
[32] Li Y, Wang Y N, Zhang H, Zhang Q, Zhai H, Liu Q C, He S Z. The plasma membrane-localized sucrose transporter IbSWEET10 contributes to the resistance of sweet potato to., 2017, 8: 197.
[33] Chen L, Liu X, Huang X, Luo W, Long Y, Greiner S, Rausch T, Zhao H. Functional characterization of a drought-responsive invertase inhibitor from maize (L.)., 2019, 20: 4081.
[34] Park S C, Kim Y H, Ji C Y, Park S, Jeong J C, Lee H S, Kwak S S. Stable internal reference genes for the normalization of real-time PCR in different sweetpotato cultivars subjected to abiotic stress conditions., 2012, 7: e51502.
[35] Schmittgen T D, Livak K J. Analyzing real-time PCR data by the comparative C(T) method., 2008, 3: 1101–1108.
[36] Riesmeier J W, Hirner B, Frommer W B. Potato sucrose transporter expression in minor veins indicates a role in phloem loading., 1993, 5: 1591–1598.
[37] 尚璐, 姚远, 王运林, 孙冲, 陆小花, 耿梦婷, 符少萍, 李瑞梅,段瑞军, 刘姣, 胡新文, 郭建春. 木薯碱性/中性转化酶MeNINV4酵母功能互补. 分子植物育种, 2018, 16: 1073–1078.
Shang L, Yao Y, Wang Y L, Sun C, Lu X H, Geng M T, Fu S P, Li R M, Duan R J, Liu J, Hu X W, Guo J C. Functional complementation of cassava alkaline/neutral invertase MeNINV4 in yeast., 2018, 16: 1073–1078 (in Chinese with English abstract).
[38] Verwaal R, Paalman J W G, Hogenkamp A, Verkleij A J, Verrips C T, Boonstra J.expression is determined by growth rates in., 2002, 19: 1029–1038.
[39] Wieczorke R, Krampe S, Weierstall T, Freidel K, Hollenberg C P, Boles E. Concurrent knock-out of at least 20 transporter genes is required to block uptake of hexoses in., 1999, 464: 123–128.
[40] Clough S J, Bent A F. Floral dip: a simplified method for-mediated transformation of., 1998, 16: 735–743.
[41] Kunz H H, Hausler R E, Fettke J, Herbst K, Niewiadomski P, Gierth M, Bell K, Steup M, Flugge U I, Schneider A. The role of plastidial glucose-6-phosphate/phosphate translocators in vegetative tissues ofmutants impaired in starch biosynthesis., 2010, 12: 115–128.
[42] Han L, Zhu Y P, Liu M, Zhou Y, Lu G Y, Lan L, Wang X P, Zhao Y F, Zhang X J C. Molecular mechanism of substrate recognition and transport by the AtSWEET13 sugar transporter., 2017, 114: 10089–10094.
[43] 王丹丹, 柳洪鹃, 王红霞, 张鹏, 史春余. 甘薯蔗糖转运蛋白基因IbSUT3的克隆及功能分析. 作物学报, 2020, 46: 1120–1127.
Wang D D, Liu H J, Wang H X, Zhang P, Shi C Y. Cloning and functional analysis of the sweet potato sucrose transporter IbSUT3., 2020, 46: 1120–1127 (in Chinese with English abstract).
[44] Seo P J, Park J M, Kang S K, Kim S G, Park C M. Ansenescence-associated protein SAG29 regulates cell viability under high salinity., 2011, 233: 189–200.
[45] Barker L, Kuhn C, Weise A, Schulz A, Gebhardt C, Hirner B, Hellmann H, Schulze W, Ward J M, Frommer W B. SUT2, a putative sucrose sensor in sieve elements., 2000, 12: 1153–1164.
[46] Schneider S, Hulpke S, Schulz A, Yaron I, Holl J, Imlau A, Schmitt B, Batz S, Wolf S, Hedrich R, Sauer N. Vacuoles release sucrosetonoplast-localised SUC4-type transporters., 2012, 14: 325–336.
[47] Kanno Y, Oikawa T, Chiba Y, Ishimaru Y, Shimizu T, Sano N, Koshiba T, Kamiya Y, Ueda M, Seo M. AtSWEET13 and AtSWEET14 regulate gibberellin-mediated physiological processes., 2016, 7: 13245.
[48] Zhou A, Ma H, Feng S, Gong S, Wang J. A novel sugar transporter from,, affects sugar metabolism and confers osmotic and oxidative stress tolerance in., 2018, 19: 497.
[49] Ren R H, Yue X F, Li J N, Xie S, Guo S H, Zhang Z W. Coexpression of sucrose synthase and the SWEET transporter, which are associated with sugar hydrolysis and transport, respectively, increases the hexose content inL. grape berries., 2020, 11: 321.
[50] Bezrutczyk M, Hartwig T, Horschman M, Char S N, Yang J, Yang B, Frommer W B, Sosso D. Impaired phloem loading insucrose transporter triple knock-out mutants in., 2018, 218: 594–603.
[51] Li P, Wang L H, Liu H B, Yuan M. Impaired-mediated sugar transportation impacts starch metabolism in developing rice seeds., 2022, 10: 98–108.
[52] Zhang Z, Zou L M, Ren C, Ren F R, Wang Y, Fan P G, Li S H, Liang Z C.mediates sugar accumulation in grapes., 2019, 10: 255.
[53] Zhang X S, Feng C Y, Wang M N, Li T L, Liu X, Jiang J. Plasma membrane-localized SlSWEET7a and SlSWEET14 regulate sugar transport and storage in tomato fruits., 2021, 8: 186.
Functional identification of sucrose transporter protein IbSWEET15 in sweet potato
WU Xu-Li1,2,**, WU Zheng-Dan1,2,4,**, WAN Chuan-Fang1,2, DU Ye1,2, GAO Yan1,2, LI Ze-Xuan1, WANG Zhi-Qian1, TANG Dao-Bin1,2,3, WANG Ji-Chun1,2,3, and ZHANG Kai1,2,3,*
1College of Agronomy and Biotechnology, Southwest University, Chongqing 400715, China;2Chongqing Key Laboratory of Biology and Genetic Breeding for Tuber and Root Crops, Chongqing 400715, China;3Engineering Research Center of South Upland Agriculture, Ministry of Education, Chongqing 400715, China;4Cash Crops Research Institute, Guangxi Academy of Agricultural Sciences, Nanning 530007, Guangxi, China
SWEET proteins play important regulatory roles in plant growth and development, stress response and sugar metabolism, but few research has been reported on SWEET proteins in sweet potato. It is of great theoretical and practical significance to carry out functional studies on sweet potato SWEET proteins to reveal their functions in sugar transport and starch and sugar metabolism. Based on the transcripts of SWEET encoding gene differentially expressed in sweet potato storage roots with different starch-related traits, specific primers were designed and the full-length cDNA sequence ofwas cloned using RACE method.bioinformatics was performed using online software, and its classification was clarified by phylogenetic tree analysis. The subcellular localization of the protein encoded bygene was identified by transient expression of IbSWEET15-GFP fusion protein in, while yeast mutant complementation experiments were carried out to identify the sugar transport function of IbSWEET15 in yeast. The relative expression pattern ofgenes in various organs of sweet potato were analyzed by qRT-PCR.expression vector was constructed and transformed intowild-type Col-0 by floral dip method to obtainheterologously expressedlines, and the starch and sugar contents of the transgenic plants were measured and compared with those of wild-typeplants, and the function ofin starch and sugar metabolism was identified., with an open reading frame of 879 bp, encoded a 292 amino acid sucrose transporter protein with two MtN3_slv conserved structural domains and seven transmembrane structural domains, and was a member of clade III of the SWEET protein family. The protein encoded bylocalized at the plasma membrane and did not transport sucrose and hexose in yeast mutant.gene had the highest expression in sweet potato branches, followed by stems and leaves, and the lowest expression in storage roots. The leaf soluble sugar contents of theheterologously expressedlines were significantly decreased, while the seed soluble sugar and starch contents were higher than wild type. We proposed thatplayed an important role in phloem loading during the source to sink transport of photosynthetic product as well as sugar and starch accumulation. This study provides the critical information for understanding the function ofin starch and sugar metabolism, and formation of important quality traits in sweet potato.
sweet potato;; soluble sugar; starch
10.3724/SP.J.1006.2023.24023
本研究由国家重点研发计划项目(2018YFD1000705, 2018YFD1000700), 中央高校基本科研业务费专项资金(XDJK2020B032, XDJK2021F001), 重庆市技术创新与应用发展专项重点项目(cstc2021jscx-gksbX0022)和西南大学种质创制专项研究项目。
This study was supported by the National Key Research and Development Program of China (2018YFD1000705, 2018YFD1000700), the Fundamental Research Funds for the Central Universities (XDJK2020B032, XDJK2021F001), the Key Project of Chongqing Technology Innovation and Application Development (cstc2021jscx-gksbX0022), and the Germplasm Creation Research Program of Southwest University.
通信作者(Corresponding author):张凯, E-mail: zhangkai2010s@163.com
**同等贡献(Contributed equally to this work)
吴旭莉, E-mail: shirleyswu@163.com; 吴正丹, E-mail: wudandan0905@163.com
2022-01-18;
2022-05-05;
2022-05-24.
URL: https://kns.cnki.net/kcms/detail/11.1809.S.20220523.1743.010.html
This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/).
