双金属MOF-74(Mgx Ni 1-x )的制备及其对CO2/N2的吸附分离性能研究
2023-01-12杨萍李有喜蔡武锋梁文博段林海
杨萍,李有喜,蔡武锋,梁文博,段林海
(广东石油化工学院 化学工程学院,广东 茂名 525000)
众所周知,CO2是造成温室效应的主要元凶之一。自第一次工业革命以来,工业废气排放量呈爆发式增长,尤以CO2居于首位;自20世纪开始,全球工业化进程迅速发展,预计全球CO2的排放量还会继续增加。因此,减少工业CO2排放成为当下环境保护问题中亟需解决的一环[1-10]。
CO2排放过多是导致全球气候变暖的主要原因之一。作为我国节能减排政策的重要举措,CO2捕获是解决排放问题最重要的环节之一。目前,从烟道气(主要成分为CO2和N2)中吸附CO2的手段主要有低温蒸馏法、化学试剂吸收法、膜分离法和变压吸附法等[11]。其中,变压吸附法具有设备要求低、能耗低、吸附剂可循环利用、生产的成本比较低的优势。但是,这种方法的弊端是对吸附剂的要求较高。传统的吸附剂主要有活性炭、沸石、分子筛和多孔氧化铝等,其特点是比表面积较小,导致其对CO2的吸附量和吸附选择性也较低。近十年来,金属-有机框架(MOF)材料在捕获CO2方面展现出独特优势。相对于传统的多孔材料,MOF材料具有较高的比表面积和孔容、丰富的空间结构、可控的孔隙大小,而且其表面可化学修饰[4]。这些优势使其在吸附分离领域拥有很强的竞争力。MOFs材料对CO2的吸附位点主要有路易斯碱位点、开放性金属位点和其他功能基团,因此成为吸附CO2的理想材料之一[12]。
1998年,MOF-74材料首次用于捕捉CO2,直到2005年才逐渐引起研究者们的广泛关注。在低压条件下,具有许多不饱和金属位点的小孔径单金属MOF材料(M-MOF-74)的CO2吸附量较大,其对N2、CO2的标准吸附焓分别为-21、-47 kJ/mol,表明MOF材料用于捕获CO2有巨大潜力。研究发现,在298 K、100 kPa的条件下,Mg-MOF-74在已知的MOF材料中CO2吸附量最高,达到8.37 mmol/g,吸附选择性为10.35;氨基的引入使Mg-MOF-74的CO2吸附量与改性前相比提高了42%,分离比增加了5.67倍[13]。然而,高的吸附量/选择性和低的再生能耗通常互为竞争关系,取得两者之间的平衡一直是具有挑战性的科学问题。此外,MOFs材料的化学稳定性差,且不耐酸碱,部分MOFs材料在水汽存在下结构容易坍塌,这些缺陷都影响了MOFs材料的发展。段崇雄[14]采用模板法、长配体法、混合配体法和离子液体法等方法对其进行了改性。结果表明,模板法制备的材料具有连续分布的介孔和大孔结构,且合成过程简单,对环境基本无污染;通过改变模板剂的量可控制介孔的大小。
本文以十二烷基苯磺酸钠为模板剂,采用水热法合成多级孔双金属HP-MOF-74(MgxNi1-x)(x=0.25、0.50、0.75)系列样品,并用于吸附分离CO2/N2。在273 K和298 K的条件下,利用静态容量法测定材料的CO2/N2吸附等温线,采用双位点Langmuir-Freundlich(DSLF)和单位点Langmuir-Freundlich(SSLF)模型对HP-MOF-74(MgxNi1-x)的CO2/N2吸附等温线进行拟合,通过Clausius-Clapeyron(克-克)方程计算HP-MOF-74(MgxNi1-x)吸附等温热,基于IAST计算样品对CO2/N2(体积比为15∶85)的吸附选择性。
1 实验部分
1.1 试剂与仪器
试剂:六水合硝酸镁(Mg(NO3)2·6H2O)、六水合硝酸镍(Ni(NO3)2·6H2O)、甲醇、乙醇,分析纯,西陇科学股份有限公司;2,5-二羟基对苯二甲酸(DHTA,纯度98.00%),上海麦克林生化科技有限公司;十二烷基苯磺酸纳(SDBS,分析纯)、N,N-二甲基甲酰胺(DMF,纯度99.99%),上海阿拉丁生化科技股份有限公司;去离子水,实验室自制。
仪器:SHZ-D(Ⅲ)循环水式真空泵,巩义宇翔仪器有限公司;040S型超声波清洗机,常州德意生机械科技有限公司;DZF-6032、DZF6021真空干燥箱,上海一恒科学仪器有限公司;JJ224BC电子天平,常熟市双杰测试仪器厂;85-2磁力搅拌反应器,鄄城华鲁电热电器有限公司;D/max-2500型X-射线衍射分析仪,日本理学株式会社;NEXUS912A0446傅里叶红外光谱仪,Thermo-NicoLet公司;STA449F3热重(TG)分析仪,德国耐驰公司;2460ASAP表面积及孔径分析仪,美国ASAP公司;2020HD ASAP全自动比表面积和孔径分析仪,麦克默瑞提克(上海)仪器有限公司;Regulus8220扫描电子显微镜,日本日立公司。
1.2 HP-MOF-74(MgxNi1-x)样品的制备
以HP-MOF-74(Mg0.25Ni0.75)为例,对样品的制备过程进行说明。分别依次称取0.920 mmol Mg(NO3)2·6H2O、2.760 mmol Ni(NO3)2·6H2O、1.085 mmol DHTA和1.288 mmol阴离子模板剂SDBS,将其溶解于33.0 mL DMF、23.2 mL乙醇及23.2 mL去离子水中;将上述溶液超声搅拌30 min,直至溶液澄清,然后将混合物转移到100 mL的高压反应釜中;将高压反应釜放至真空干燥箱中,以1℃/min的升温速率加热至125℃,并保持24 h,再以1℃/min的降温速率降温至30℃;反应结束后,取出反应釜冷却至室温,抽滤,用DMF洗涤,去除配体;采用新鲜甲醇浸泡3 d,每天更换一次新鲜甲醇,过滤并在150℃下真空干燥5 h,得到绿色HP-MOF-74(Mg0.25Ni0.75)。
另外,保持金属离子总量、反应温度、时间以及溶剂交换过程不变,改变Mg、Ni的物质的量,制备不同物质的量比的样品,分别命名为HP-MOF-74(Mg0.50Ni0.50)和HP-MOF-74(Mg0.75Ni0.25)。三组样品的组成见表1。
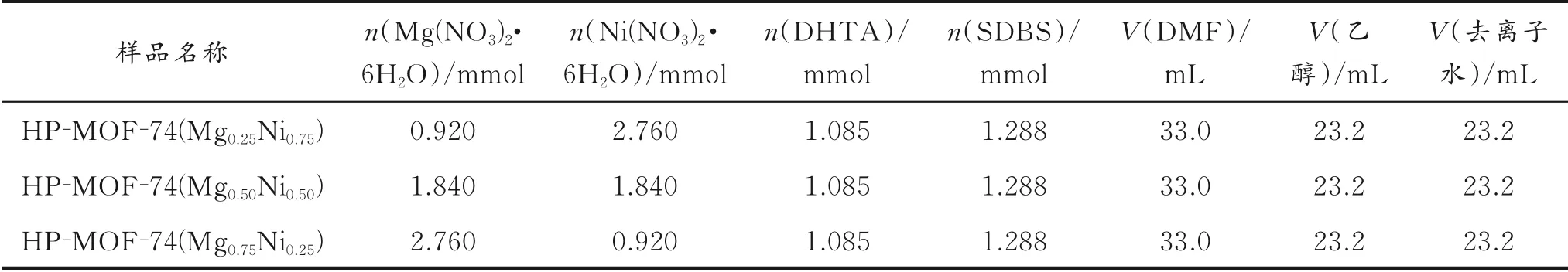
表1 三组样品的组成
1.3 表征方法
1.3.1 X射线衍射(XRD) 对HP-MOF-74(MgxNi1-x)进行XRD分析,通过对比样品衍射峰与标准衍射峰确定晶体的物相结构,同时获得样品的结晶度、最高峰半宽、空间点群类型等重要参数。在室温下Cu靶-Kα射线辐射,射线波长为0.154 nm,管电压为40 kV,管电流为40 mA,扫描范围2θ为5°~75°,扫描速率为5(°)/min,步长为0.02°。每次测量前,样品在423 K下脱气5 h。
1.3.2 傅里叶变换红外光谱(FT-IR) 通过FTIR分析HP-MOF-74(MgxNi1-x)的空间结构及官能团,进一步确定不同配比的Mg、Ni金属合成的差异并辨别官能团。在空气气氛下,采用溴化钾压片法对合成的材料进行红外测试,扫描波数范围为400~4 000 cm-1。
1.3.3 热重分析(TG) 通过TG测定HP-MOF-74(MgxNi1-x)样品的热稳定性和组分。实验条件:N2气氛,温度为25~600℃,升温速率为5℃/min。
1.4 CO2/N2吸附性能测试
在273 K和298 K下,通过吸附仪分别测定HP-MOF-74(MgxNi1-x)样品的CO2和N2吸附等温线。测试前将样品进行预处理,称取100~200 mg的HP-MOF-74(MgxNi1-x)样品置于样品管中,并置于真空脱气装置进行脱气。在363 K下预脱附60 min,随后升高温度至423 K并保持6 h,目的是为了除去吸附在材料孔道中的溶剂分子或者水分子。测试过程中采用恒温循环水浴进行控温,测试压力为0~100 kPa。
2 结果与讨论
2.1 XRD分析
图1为HP-MOF-74(MgxNi1-x)样品 的XRD谱图。从图1可以看出,三组样品与MOF-74标准谱图具有一致的晶体结构和较好的结晶度;随着样品中Mg的比例增加,样品的峰强度变得更高且更尖锐,HP-MOF-74(Mg0.75Ni0.25)样品的峰最高且最尖锐,说明此样品的晶体结构较好;在2θ为6.0°~7.5°和11.0°~12.5°出现两个最强衍射峰,与文献[15]的结果相同。
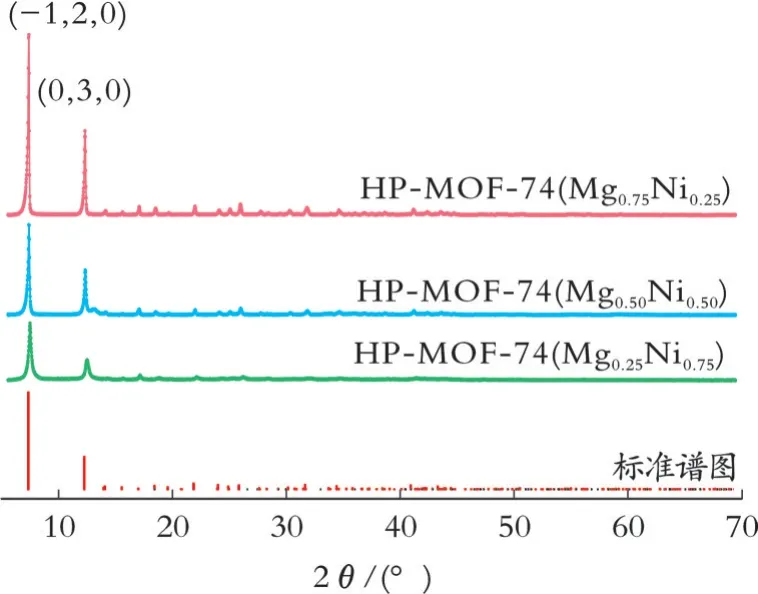
图1 HP-MOF-74(MgxNi1-x)样品的XRD谱图
2.2 FT-IR分析
图2为HP-MOF-74(MgxNi1-x)样品的FT-IR谱图。从图2可以看出,3 410 cm-1处对应的是缔合羟基或水分子的伸缩振动峰,这是因为多孔材料表面或通道中吸附的水;1 670 cm-1处对应的是羧基的伸缩振动峰,1 570 cm-1处对应的是配体2,5-二羟基对苯二甲酸中苯环上C=O的吸收峰;1 420 cm-1处对应的是苯环的骨架振动吸收峰;1 230 cm-1和1 200 cm-1处对应的是苯环上C-H和C-O的伸缩振动峰;891 cm-1和831 cm-1处对应的是苯环CH键面外弯曲振动与环弯曲振动峰;598 cm-1和499 cm-1处对应的是Ni-O和Mg-O的振动峰。

图2 HP-MOF-74(MgxNi1-x)样品的FT-IR谱图
2.3 热重分析(TG)
在25~600℃下,对HP-MOF-74(MgxNi1-x)样品进行了热重分析,结果见图3。
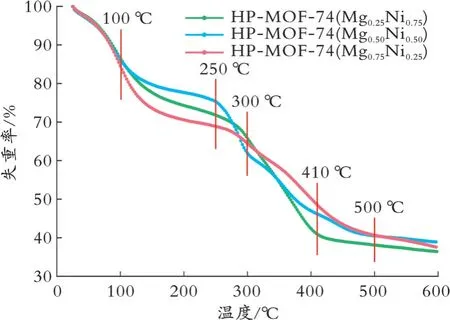
图3 HP-MOF-74(MgxNi1-x)样品的TG谱图
从图3可以看出,三组样品在0~100℃均出现了第一次失重,HP-MOF-74(Mg0.25Ni0.75)和HPMOF-74(Mg0.50Ni0.50)失重率约为13.7%,HP-MOF-74(Mg0.75Ni0.25)失重率约为16.0%,这归因于水分子的蒸发;三组样品在100~300℃均略微失重,这归因于样品中的有机溶剂吸热挥发;HP-MOF-74(Mg0.25Ni0.75)样品在300~410℃失重率较大(约为24.8%),410℃后样品质量几乎不再损失,因此推测HP-MOF-74(Mg0.25Ni0.75)样品在300℃时配体开始分解,发生骨架结构的坍塌;HP-MOF-74(Mg0.25Ni0.75)和HP-MOF-74(Mg0.50Ni0.50)样品失重率趋势相近,但HP-MOF-74(Mg0.50Ni0.50)样品在250~300℃失重明显,失重率约为14.3%,这是由于样品中的结晶水吸热被蒸发导致的。综上所述,HP-MOF-74(MgxNi1-x)样品主要失重的温度区间相似,推测它们具有相似的稳定性,在300℃时发生金属骨架坍塌。
2.4 CO2和N2的吸附等温线
图4为HP-MOF-74(MgxNi1-x)样 品 在273 K和298 K下的吸附等温线。从图4可以看出,HP-MOF-74(MgxNi1-x)样品对CO2和N2吸附趋势相近,随着压力的增加,CO2、N2吸附量均增加;在等温、等压的条件下,随着样品中Mg的比例增加,CO2的吸附量先增加后减小;在相同压力下,同一样品在273 K下的CO2吸附量远高于298 K下的CO2吸附量;在相同的温度条件下,随着样品中Mg的比例增加,达到同一CO2吸附量所需的压力越大。从图4还可以看出,N2吸附等温线反映的规律与之相近,且样品对CO2的吸附量远大于对N2的吸附量。综上所述,低温、高压有利于HPMOF-74(Mg0.50Ni0.50)样品对CO2的吸附。CO2的吸附量峰值出现在HP-MOF-74(Mg0.50Ni0.50)样品的吸附曲线上,对应温度为273 K,压力为100 kPa,CO2吸附量峰值为4.864 mmol/g。在实验过程中发现,模板的加入阻碍了溶剂分子与不饱和Mn+金属位点的配位,产生了更多的不饱和金属位点,增加了材料对CO2的吸附亲和力;HP-MOF-74(MgxNi1-x)样品表面的色散力增加,也有利于增强材料表面对CO2的作用力。

图4 HP-MOF-74(MgxNi1-x)样品在273 K和298 K下的吸附等温线
2.5 吸附拟合模型
通过测定273 K和298 K下的吸附等温线,利用13种吸附模型对CO2和N2在多级孔HP-Cu-BTCs上的吸附平衡实验数据进行拟合,并将拟合结果与实验数据进行对比分析,详细考察了不同吸附模型的拟合精度。结果表明,DSLF和SSLF模型拟合效果最佳,其拟合方程如下:
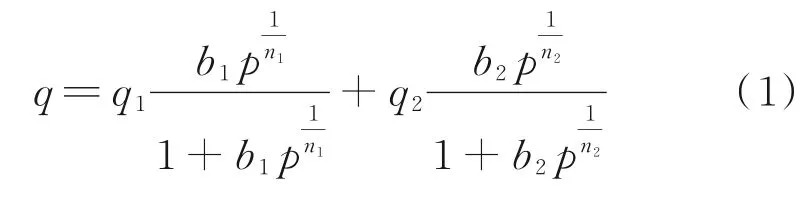

式中,p为平衡时的总压力,kPa;q1、q2分别为理想状态下在吸附点位1、2的饱和吸附量,mmol/g;b1、b2分别为吸附点位1、2的平衡参数,其量纲分别与1/n1、1/n2有 关。表1为CO2的DSLF模 型 和N2的SSLF模型拟合参数。
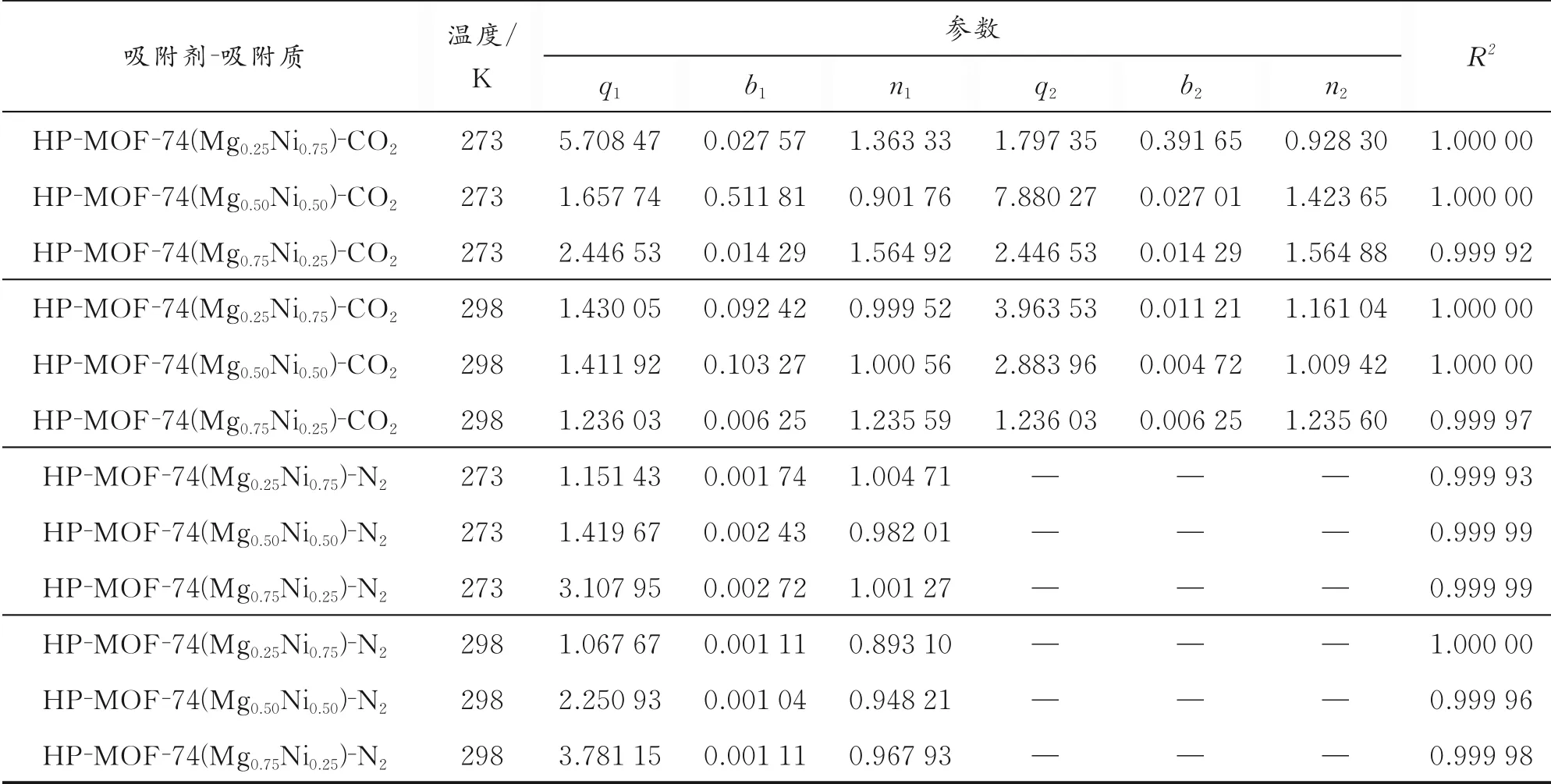
表1 CO2的DSLF模型和N2的SSLF模型拟合参数
从表1可以看出,实验数据与吸附模型拟合数据十分吻合;通过计算可得拟合相关系数R2大于0.999,说明DSLF和SSLF模型均能描述CO2和N2在HP-MOF-74(MgxNi1-x)样品上的吸附行为。
2.6 CO2/N2吸附选择性
IAST模型:在某一温度和压力下,将被吸附的混合气体组分视为理想混合气体,通过对混合气体中不同单组分气体的吸附等温曲线进行拟合计算,得出混合气体组分的平衡吸附选择性。此理论有两个严格前提:(1)在确定温度下,要用准确的单组分气体吸附数据;(2)采用合适的吸附等温线模型拟合吸附数据。
通过将DSLF/SSLF模型和IAST模型组合得到DSLF/SSLF-IAST模型,其表达式如下[16-17]:
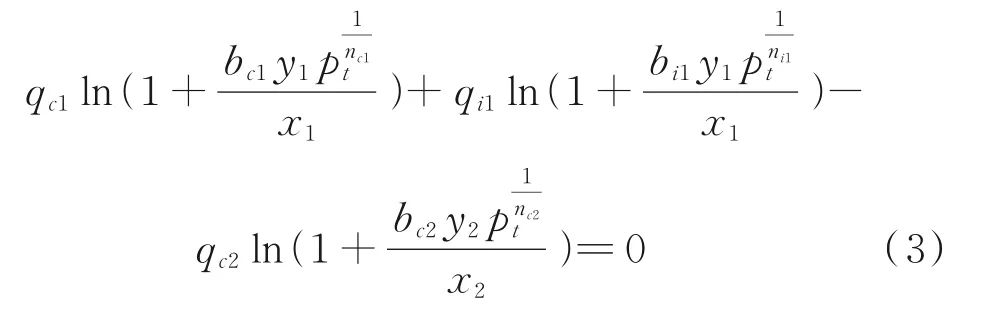
式中,qc1、bc1、nc1、qi1、bi1、ni1均为组分1的DSLF模型参数;qc2、bc2、nc2均为组分2的SSLF模型参数;y1、y2分别为组分1、2在气相中的摩尔分数,%,y1+y2=1;x1、x2分别为组分1、2在吸附相中的摩尔分数,%,x1+x2=1。对于给定的p和y1,通过式(3)计算得出x1,将x1代入式(4)可计算CO2/N2吸附选择性:

在273 K和298 K下,通过IAST计算HP-MOF-74(MgxNi1-x)样品对CO2/N2混合气体的吸附选择性,结果见图5,混合气体中V(CO2)/V(N2)=15∶85。从图5可以看出,随着压力增加,HP-MOF-74(Mg0.25Ni0.75)和HP-MOF-74(Mg0.50Ni0.50)样品的选择性逐渐增加;当压力为100 kPa时,HP-MOF-74(Mg0.25Ni0.75)样品的选择性高达2 263;在273 K下,对应HP-MOF-74(MgxNi1-x)样品的选择性均大于298 K下的选择性,且两个温度下HP-MOF-74(Mg0.25Ni0.75)样品的选择性均大于HP-MOF-74(Mg0.50Ni0.50)和HP-MOF-74(Mg0.75Ni0.25)样品的选择性。由此推断,随着样品中Mg比例增大,样品对CO2/N2的吸附分离选择性降低。
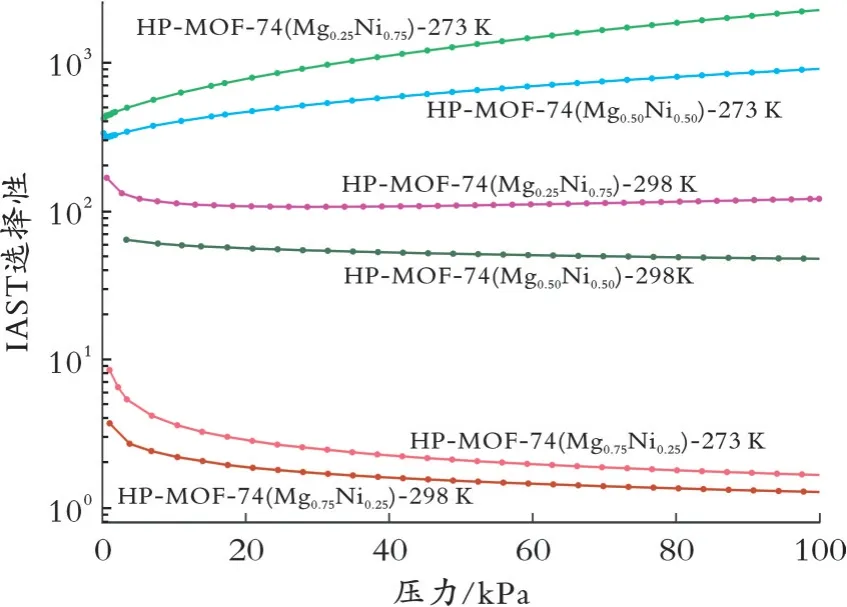
图5 HP-MOF-74(MgxNi1-x)样品对CO2/N2混合气体吸附选择性
2.7 CO2/N2等量吸附热
吸附热是衡量吸附剂和吸附质之间相互作用力强弱的重要参数,同时提供可靠的吸附剂表面能量异质性信息。利用克-克方程分别对273 K和298 K下的CO2和N2吸附等温线进行拟合,计算CO2和N2在HP-MOF-74(MgxNi1-x)样品上的等量吸附热。克-克方程表达式如下[18-19]:
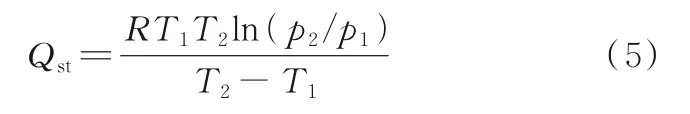
式中,Qst为等量吸附热,kJ/mmol;R为常数,取值8.314 kJ/(mol·K);T1和T2为 两 个 不 同 的 吸 附 温 度,K;p1和p2为不同吸附温度对应的吸附压力,kPa。
图6为HP-MOF-74(MgxNi1-x)样品的等量吸附热。从图6(a)可以看出,HP-MOF-74(Mg0.50Ni0.50)样品的吸附热(54.4~69.2 kJ/mol)均大于其余两组,表明它与CO2的吸附作用力更强;HP-MOF-74(Mg0.75Ni0.25)样品的CO2吸附热范围为35.7~48.1 kJ/mol,而物理吸附的吸附热不超过40.0 kJ/mol,说明HP-MOF-74(Mg0.75Ni0.25)样品存在物理和化学吸附两种吸附行为。文献[20-21]表明,废气中脱除CO2的最佳吸附热为35.0~50.0 kJ/mol,因此从实际应用的角度来说,HP-MOF-74(Mg0.75Ni0.25)样品兼具较优的CO2吸附性能和较低的脱附能耗。从图6(b)可以看出,在同一吸附量下,N2在HP-MOF-74(Mg0.25Ni0.75)样品上的吸附热均大于其余两组,这表明HP-MOF-74(Mg0.25Ni0.75)样品表面存在大量的吸附位点,且此吸附位点与N2有较强的吸附作用;HP-MOF-74(Mg0.50Ni0.50)和HP-MOF-74(Mg0.25Ni0.75)样品的吸附热均随着N2吸附量的增加而迅速增加,这说明样品表面的吸附位点能量并不均匀。HPMOF-74(Mg0.75Ni0.25)样品的吸附热在0.033 mmol/g之前,伴随吸附量的增大,吸附热增加较为缓慢;当吸附量大于0.033 mmol/g时,吸附热随着吸附量的增加而明显增大。
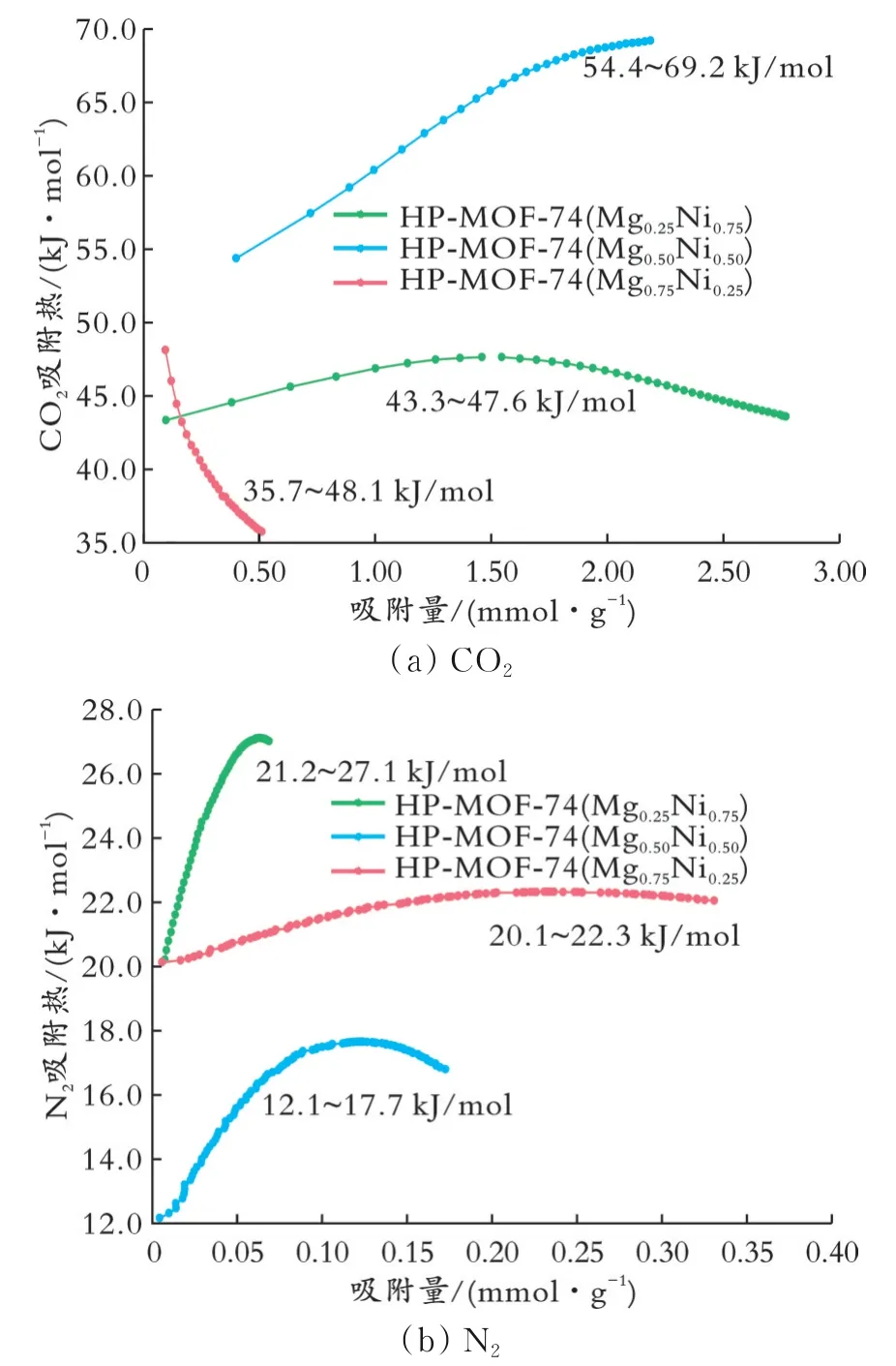
图6 HP-MOF-74(MgxNi1-x)样品的等量吸附热
3 结论
(1)通过XRD、FT-IR、TG等表征手段,综合分析比较三种比例下样品的吸附分离性能。通过吸附性能测试可知,对CO2的吸附量与吸附选择性均达到了理想效果,且样品具有良好的热稳定性。其中,HP-MOF-74(Mg0.50Ni0.50)样品对CO2的吸附量最大,其吸附量为4.864 mmol/g(100 kPa,273 K);在相同的吸附容量下,HP-MOF-74(Mg0.50Ni0.50)样品对CO2的等量吸附热更大。在CO2吸附量为0.40 mmol/g时,HP-MOF-74(Mg0.50Ni0.50)样品的吸附热达到54.4 kJ/mmol;HP-MOF-74(Mg0.25Ni0.75)样品对CO2/N2吸附分离选择性高达2 263(273 K,100 kPa),吸附分离性能优异。
(2)通过吸附模型拟合可知,合成的样品表面均匀,对CO2的吸附属于单分子层吸附,存在化学和物理两种吸附作用,吸附过程中主要靠CO2和吸附剂之间不饱和金属位点结合来控制。
(3)本文仅仅讨论了样品的一次性使用,其再生性能还需进一步探讨。另外,在讨论样品的吸附机理时,不但要通过模型拟合解释吸附过程,还应结合吸附的实际过程进行讨论,实现理论研究与实际相结合。
