黄芪甲苷通过HMGB1/NF-κB通路减轻脓毒症大鼠相关肺损伤
2023-01-11赵雅彬李琨琨张志伟杨宁运苛政孙同文
赵雅彬 李琨琨 张志伟 杨宁 运苛政 孙同文
脓毒症是由病原微生物感染引起的全身炎症反应综合征,是危重症的常见并发症,死亡率高达30%[1]。全球每年约1900万人罹患脓毒症,肺脏是脓毒症导致多脏器功能损伤中较早损伤的脏器,表现为急性肺损伤[2-3]。目前脓毒症临床治疗所使用的抗生素类药物,因毒副作用大且易引起药物依赖性,亟需开发安全高效的新型药物[4]。黄芪甲苷(astragaloside Ⅳ, AS-Ⅳ)是提取自黄芪的主要活性成分之一,具有抗炎消肿、调节免疫功能和镇痛等作用[5]。研究发现,AS-Ⅳ能够有效减轻脓毒症大鼠全身炎症反应,但其作用机制尚不明确[6]。因此,本研究旨在建立脓毒症大鼠肺损伤模型,探讨AS-Ⅳ对肺损伤的改善作用及其可能作用机制,为AS-Ⅳ药物开发及脓毒症临床治疗提供参考。
资料与方法
一、材料
1 实验动物 60只SPF级雄性SD大鼠,体质量220~250 g,由浙江维通利华实验动物技术有限公司提供,合格证号:SCXK(浙)2019-0001。所有实验动物在温度20℃~24℃,相对湿度50%~60%,自然昼夜节律光照的环境中适应性饲养7 d,所有饲养设备均经过高压、高温灭菌,适应期间可自由获取食物和水,垫料每日进行更换(伦理编号:2022-2xyy-008)。
2 药品、主要试剂和仪器 AS-Ⅳ(纯度≥98%,上海吉至生化科技有限公司,货号:A70100);肿瘤坏死因子-α(tumour necrosis factor-α,TNF-α)ELISA试剂盒(深圳科润达生物工程有限公司,货号:ELH-TNF-α);白细胞介素-1β(interleukin-1β, IL-1β)、白细胞介素-6(interleukin-6, IL-6)ELISA试剂盒(深圳海思安生物技术有限公司,货号:HAS-47926,HAS-48678);兔抗大鼠β-actin多克隆抗体、兔抗大鼠高迁移率族蛋白B1(High mobility group proteins B1, HMGB1)、核因子-κB p65(nuclear factor- κB, NF-κB p65)多克隆抗体、山羊抗兔二抗IgG(上海晶抗生物有限公司,货号:JKR18050,JKR6202,JKR19225)。IQ5TM型荧光实时定量PCR仪(美国Bio-Rad公司);石蜡组织切片机(RM2265,德国LEICA公司)。
二、方法
1 脓毒症大鼠模型建立 适应性饲养7 d后,模型组、AS-Ⅳ各剂量组大鼠采用盲肠结扎穿孔法建立脓毒症大鼠模型[7],术前12 h禁食,自由饮水,腹腔注射3%戊巴比妥钠麻醉,固定于手术台上,沿腹中线左侧1 cm作一切口,长约1 cm,找到盲肠末端1.5 cm处,手术线结扎22号针穿刺2次,逐层缝合。对照组大鼠只开腹,不进行盲肠的结扎和穿刺。术后大鼠出现呼吸频率明显加快、腹泻,精神萎靡,毛色失去光泽及抓取时全无抵抗之力等表现提示建模成功。
2 分组与给药 60大鼠随机分为对照组12只、模型组(12只)、AS-Ⅳ低剂量组(12只)、AS-Ⅳ中剂量组(12只)和AS-Ⅳ高剂量组(12只)。参照文献[8-9],AS-Ⅳ低、中、高剂量组灌胃20、40、80 mg/kg AS-Ⅳ混悬液(生理盐水配制),对照组及模型组于相同时间给予等量生理盐水。各组给药1次/d,连续7 d。
三、检测指标
1 标本采集 末次给药后,所有大鼠腹腔注射3%戊巴比妥钠麻醉,翻正反射消失后,开腹。腹主动脉采集血液,于4℃下3000 r/min高速离心机离心15 min,分离血清,-20℃保存。断头法处死大鼠,取出肺组织,使用预冷的生理盐水冲洗肺组织,取部分左肺组织浸入4%多聚甲醛液固定24 h备用,其余左肺组织,-80℃保存备用。
2 肺组织湿干重比(W/D)测定 取出大鼠右肺组织后,滤纸吸取肺组织表面多余血液,天平准确称取右肺组织质量记为湿重,再将肺组织放入80℃烤箱烘烤48 h至恒重,记为干重,计算肺组织W/D。肺组织W/D=肺组织湿重/肺组织干重。
3 炎症因子水平检测 取出血清和试剂盒,恢复至室温后使用,根据TNF-α、IL-1β、IL-6 ELISA试剂盒说明书操作。试剂盒采用双抗体夹心法检测血清TNF-α、IL-1β、IL-6水平,先用标本稀释液1:1稀释标本50 μL加入反应孔。其余各孔加入待测样品,再加入50 μL生物素抗体工作液,盖上膜板,轻轻震荡混匀,37℃孵育30 min。甩去液体,每孔加入洗涤液,震荡30 s,反复操作3次。再加入80 μL亲和链霉素HRP,37℃温育30 min,洗涤液清洗拍干,加入显色液、终止液,使用酶标测定仪于450 nm波长处检测各孔吸光值,计算样品浓度。
4 肺组织HE染色观察 取出固定后的肺组织,浸泡梯度浓度酒精溶液脱水,再使用二甲苯透明,去除透明剂后进行石蜡包埋,使用切片机切成厚度为5 μm的切片。40℃烘箱烘干,过夜。再将切片常规透明、脱水,放入苏木精染色5 min,自来水冲洗,1%盐酸乙醇分化10 s,自来水冲洗,再次脱水透明。使用中性树胶,盖片封固。观察肺组织病理学变化。
5 肺组织病理学评分 光学显微镜下观察肺组织形态变化,并采用改良版肺组织病理学评分标准[7]对各组大鼠肺组织进行评分,从大鼠肺组织肺间隔厚度、炎性细胞浸润程度、肺泡塌陷程度评定肺组织病变程度,各部分数相加为最终得分。评分越高表明肺组织病变程度越严重,详细评定标准(见表1)。

表1 肺组织病理学评定标准
6 HMGB1、NF-κB p65 mRNA表达 取出备用肺组织并剪碎,加入TRIZOL液静置裂解。按照RNA提取试剂盒说明书操作提取总RNA,检测RNA浓度。反转录试剂盒合成cDNA,配制转录反应体系(20 μL):R Nase free ddH2O 10 μL,上、下游引物各0.5 μL,5×g DNA digester Mix 2 μL,4× Hifair Super Mix 5 μL,cDNA 2 μL。反应条件为95℃ 25 s,56℃ 35 s,72℃ 65 s进行40个循环。取样本CT值平均数,以目的基因相对内参的表达量计算各样本之间基因表达差异。引物序列设计为HMGB1-F:5′-GCATCCTGGCTTATCCATTGG-3′、HMGB1-R:5′-GGCTGCTTGTCATCTGCTG-3′;NF-κB p65-F:5′-AGAGGGGATTTCGATTCCGC-3′、NF-κB p65-R:5′-CCTGTGGGTAGGATTTCTTGTTC-3′;β-actin-F:5′-GGCTGTATTCCCCTCCATCG-3′、β-actin-R:5′-CCAGTTGGTAACAATGCCATGT-3′。
7 HMGB1、NF-κB p65蛋白表达 取出备用肺组织加入细胞裂解液,冰上充分研磨匀浆等待完全裂解,4℃下12000 rpm离心机离心10 min,收集上清液。使用BCA蛋白浓度试剂盒,检测蛋白浓度。取40 μL样品蛋白,加入配制好的分离胶与浓缩胶,恒压80 V电泳30 min,恒压120 V电泳至溴酚蓝到达底部。260 mA电流下,转至PVDF膜,加入5%脱脂牛奶摇床封闭2 h,再加入1:1000一抗稀释液,4℃过夜,TBST充分清洗3次,每次10 min。加入1:3000二抗稀释液,室温封闭60 min,TBST清洗,滴加适量显影液放入凝胶图像分析仪进行显影,保存图像,以β-actin为内参,观察并分析条带上相应蛋白表达量。
四、统计学分析
结 果
一、肺组织W/D比较
与对照组比较,模型组大鼠肺组织W/D升高(P<0.05)。与模型组比较,AS-Ⅳ低、中、高剂量组大鼠肺组织W/D均降低(P<0.05)。与AS-Ⅳ低剂量组比,AS-Ⅳ中、高剂量组大鼠肺组织W/D降低(P<0.05)。与AS-Ⅳ中剂量组比,AS-Ⅳ高剂量组肺组织W/D降低(P<0.05)(见表2)。

表2 各组大鼠肺组织W/D比较
二、炎症因子水平比较
与对照组比较,模型组大鼠血清TNF-α、IL-1β、IL-6水平升高(P<0.05)。与模型组比,AS-Ⅳ低、中、高剂量组大鼠血清TNF-α、IL-1β、IL-6水平降低(P<0.05)。与AS-Ⅳ低剂量组比,AS-Ⅳ中、高剂量组大鼠血清TNF-α、IL-1β、IL-6水平降低(P<0.05)。与AS-Ⅳ中剂量组比,AS-Ⅳ高剂量组大鼠血清TNF-α、IL-1β、IL-6水平降低(P<0.05)(见表3)。
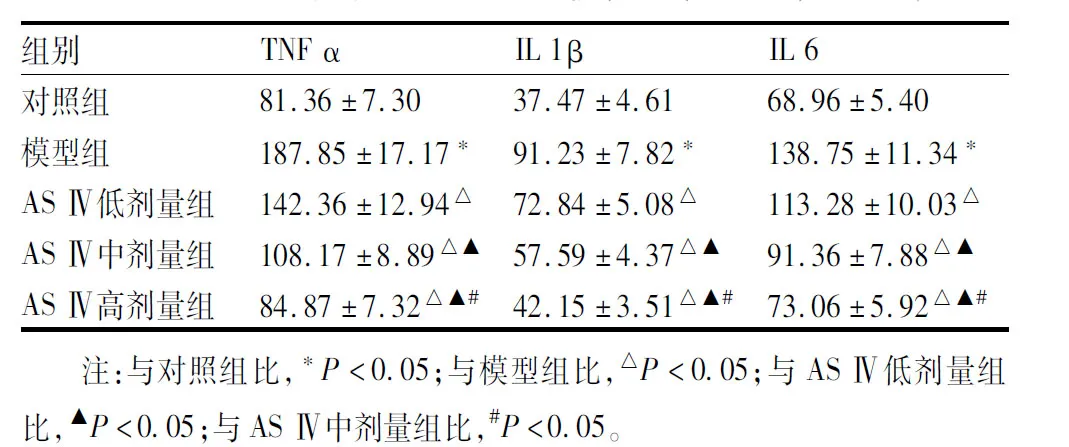
表3 大鼠血清炎症因子水平比较
三、肺组织HE染色比较
结果显示,对照组大鼠肺组织结构完整,形态正常,未见炎性细胞浸润、水肿等现象。模型组大鼠肺组织严重病变,肺泡间隔明显增宽,肺泡壁明显增厚,部分肺泡可见出血、间质水肿现象,存在大量炎性细胞浸润现象。AS-Ⅳ低、中、高剂量组大鼠肺组织结构受损现象得到改善,肺泡间隔减小,肺泡出血和间质水肿现象减轻,炎性细胞浸润现象减少(见图1)。
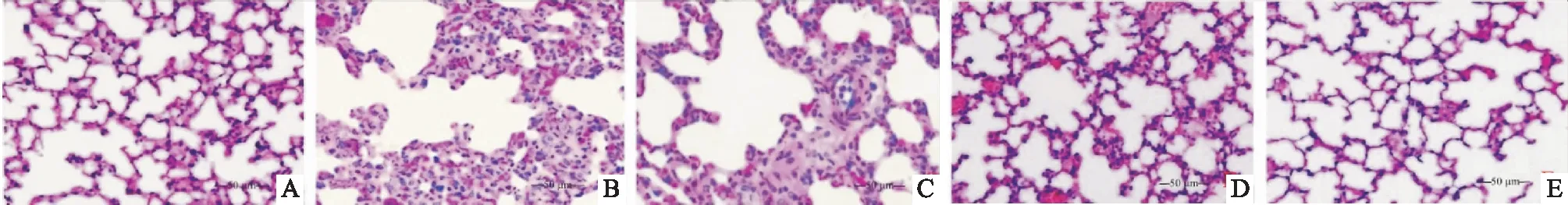
图1 肺组织HE染色结果(×200,标尺=50 μm,A:对照组,B:模型组,C:AS-Ⅳ低剂量组,D:AS-Ⅳ中剂量组,E:AS-Ⅳ高剂量组)
四、肺组织病理学评分比较
与对照组比较,模型组大鼠肺组织病理学评分升高(P<0.05)。与模型组比较,AS-Ⅳ低、中、高剂量组大鼠肺组织病理学评分均降低(P<0.05)。与AS-Ⅳ低剂量组比,AS-Ⅳ中、高剂量组大鼠肺组织病理学评分降低(P<0.05)。与AS-Ⅳ中剂量组比,AS-Ⅳ高剂量组肺组织病理学评分降低(P<0.05)(见表4)。
表4 各组大鼠肺组织病理学评分比较 分)
五、HMGB1、NF-κB p65 mRNA水平比较
与对照组比较,模型组大鼠肺组织HMGB1、NF-κB p65 mRNA表达水平升高(P<0.05)。与模型组比,AS-Ⅳ低、中、高剂量组大鼠肺组织HMGB1、NF-κB p65 mRNA表达水平降低(P<0.05)。与AS-Ⅳ低剂量组比较,AS-Ⅳ中、高剂量组大鼠肺组织HMGB1、NF-κB p65 mRNA表达水平降低(P<0.05)。与AS-Ⅳ中剂量组比,AS-Ⅳ高剂量组大鼠肺组织HMGB1、NF-κB p65 mRNA表达水平降低(P<0.05)(见表5)。

表5 大鼠HMGB1、NF-κB p65 mRNA水平比较
六、HMGB1、p-NF-κB p65/NF-κB p65蛋白水平比较
与对照组比较,模型组大鼠肺组织HMGB1、p-NF-κB p65/NF-κB p65蛋白表达水平升高(P<0.05)。与模型组比,AS-Ⅳ低、中、高剂量组大鼠肺组织HMGB1、p-NF-κB p65/NF-κB p65蛋白表达水平降低(P<0.05)。与AS-Ⅳ低剂量组比较,AS-Ⅳ中、高剂量组大鼠肺组织HMGB1、p-NF-κB p65/NF-κB p65蛋白表达水平降低(P<0.05)。与AS-Ⅳ中剂量组比,AS-Ⅳ高剂量组大鼠肺组织HMGB1、p-NF-κB p65/NF-κB p65蛋白表达水平降低(P<0.05)(见表6,图2)。

表6 大鼠HMGB1、p-NF-κB p65/NF-κB p65蛋白水平比较

图2 肺组织蛋白检测
讨 论
脓毒症患者由于体内感染的病原体毒素持续释放,机体的免疫系统受到过度激活,炎性因子高度表达,导致细胞、组织器官和免疫系统均会受到不可逆的损伤[8]。多达70%的脓毒症患者会出现严重的肺损伤,表现出呼吸困难等表症[9]。针对脓毒症肺损伤的治疗集中在控制感染源、液体治疗、血管活性药物的应用和调节免疫系统。近年来研究发现,一些针对炎症信号通路的靶向药物在脓毒症的治疗中取得良好效用[10]。
黄芪是豆科植物蒙古黄芪或膜荚黄芪的干燥根,是一种传统的补气中草药,其主要成分包括AS-Ⅳ、黄芪苷、异黄芪苷、三萜皂苷、黄酮及多糖等[11]。AS-Ⅳ作为黄芪的标志成分之一,因其抗炎、活血化瘀的药效临床常用于炎症介质的靶向治疗[12]。本研究采用盲肠结扎穿孔法建立脓毒症大鼠模型,从分子机制上探讨AS-Ⅳ对脓毒症大鼠肺脏损伤的修复作用。结果显示,模型组大鼠肺组织W/D比值、肺组织病理学评分、TNF-α、IL-1β、IL-6均升高,表明脓毒症模型建立成功且模型组大鼠肺组织受到严重损伤,大鼠体内伴有严重的炎症反应。给予不同剂量的AS-Ⅳ治疗后大鼠均表现肺组织W/D比值、肺组织病理学评分、TNF-α、IL-1β、IL-6降低,提示大鼠肺组织损伤得到修复,体内的炎症反应也明显减轻。此外,大鼠肺组织HE染色结果也表明肺泡间隔缩小,肺泡出血和间质水肿现象减轻,细胞肿胀、炎性细胞浸润现象减少。以上结果均证实AS-Ⅳ对脓毒症大鼠肺组织损伤具有修复作用。
在本研究中,与模型组比较,AS-Ⅳ各剂量组大鼠肺组织HMGB1和NF-κB p65 mRNA水平降低,且HMGB1和p-NF-κB p65蛋白表达水平也呈现降低趋势。HMGB1作为下游炎症重要参与因子,在脓毒症的发生、发展中均起到关键作用[13]。在细胞内,HMGB1参与核小体内DNA复制、修复,细胞分化等多种生理过程;释放至细胞外时,HMGB1可介导炎症反应、促进肿瘤生长等,参与更广泛的生物学行为[14]。炎症反应是脓毒症引起脏器损伤的重要机制之一,在脓毒症病程发展中,外周的炎性因子集中在组织已受到破坏的脏器,激活HMGB1/NF-κB通路释放更多的促炎因子从而进一步加强炎症反应,加剧脏器损伤[15]。HMGB1分泌到细胞外发挥促炎作用时,通过与受体结合,激活下游NF-κB信号通路,在脓毒症发展过程中,活化的NF-κB通路能够释放大量TNF-α、IL-1β、IL-6等促炎因子,促进炎症级联反应[16]。结合血清TNF-α、IL-1β、IL-6水平变化,可见AS-Ⅳ能够抑制HMGB1/NF-κB通路,减少NF-κB p65磷酸化,减轻炎症反应,对大鼠肺组织损伤有积极影响。
综上所述,AS-Ⅳ能够改善脓毒症大鼠肺组织损伤,减轻炎症反应,可能是通过抑制HMGB1/NF-κB通路,减少NF-κB p65磷酸化蛋白表达发挥作用,为临床治疗脓毒症提供实验依据。
