籽用美洲南瓜离体快繁技术研究
2023-01-11李石恒
李石恒,王 萍
(内蒙古农业大学园艺与植物保护学院,内蒙古 呼和浩特 010011)
籽用美洲南瓜为葫芦科南瓜属一年生草本植物,原产于北美洲南部,19世纪中叶从欧洲引入中国,世界各地均有分布。籽用美洲南瓜籽粒不仅含有丰富的脂肪、蛋白质、矿物质及维生素等营养成分[1],还含有丰富的葫芦巴碱和钾、磷,具有防癌、降脂、降糖、止痒、润肤的功效。《本草纲目》对南瓜籽也有记载:南瓜籽能驱虫、消肿,可治疗蛔虫、百日咳、痔疮等[2]。此外,南瓜籽还富含锌元素,是优良的保健食品[3]。
近年来,关于南瓜作物离体快繁技术的报道较多。研究表明,中国南瓜不定芽再生率低,再生周期长,为70 d左右[4];印度南瓜子叶节离体再生不定芽诱导率在56.1%左右,诱导率较低,但在MS、MS+NAA(1 mg/L)及MS+活性炭(2 g/L)培养基中,生根率极高,为90.7%~97.6%[5];中国南瓜贝粟灰、永安2号和永安5号子叶节离体再生效果较好,不定芽诱导率较高,为88.89%,当NAA浓度为0.1 mg/L时,生根率最高,达到83.33%[6];中国南瓜大果蜜本子叶节离体再生不定芽诱导率为58.33%,成苗率为85.00%[7]。
籽用美洲南瓜叶片容易受到白粉病[8]、病毒病[9]、蔓枯病等不同程度的病害影响。但南瓜抗病材料匮乏,遭受病害蔓延迅速,周年侵染,药剂防治效果往往不佳,极易造成叶片早衰减产,且长期使用化学杀菌剂易使病原菌产生抗药性,同时给食用带来安全隐患,并加剧环境污染。因此,研究一种籽用美洲南瓜高效离体快速繁殖方法,探究组培苗的抗病性,对缩短组培苗繁育周期、减少籽用美洲南瓜病害具有十分重要的意义。本试验以籽用美洲南瓜品种弘昌211子叶为供试材料,进行离体快繁技术研究,旨在缩短籽用美洲南瓜再生周期,获得抗病性较强的组培苗。
1 材料和方法
1.1 材料
供试材料为京成7091、金苹果、金丰光板、弘昌211、金丰八号、晶莹118、瑞丰九号、希望骄子、金地1号,均由内蒙古农业大学籽用美洲南瓜课题组提供。
1.2 试验方法
1.2.1 萌发培养
50℃温水浸泡籽用美洲南瓜种子30 min,去壳后将种子置于75%乙醇中表面消毒15 s,无菌水冲洗3次,再用4%NaClO消毒15 min,无菌水冲洗6次。将种子接种于MS培养基(30.0 g/L蔗糖和6.5 g/L琼脂)中,黑暗环境下萌发培养(培养温度为25℃),每个培养瓶接种5~7粒种子。种子萌发3~5 d后,进行萌发率、污染率、芽长的测定。
1.2.2 离体快繁试验
1.2.2 .1 外植体制备
萌发培养后,以弘昌211为组培材料于超净工作台内移去无污染幼苗的下胚轴,以子叶为外植体,切取不同的部位及大小。A:用解剖刀横切子叶,制成近下胚轴的1/2子叶外植体;B:用解剖刀横切子叶,制成远下胚轴的1/2子叶外植体;C:用解剖刀横切子叶,取近下胚轴的1/2子叶,并将其竖切,制成1/4子叶外植体;D:用解剖刀横切子叶,取近下胚轴的1/2子叶,并将2片1/2子叶沿中间缝隙切开,制成单片1/2子叶外植体;E:用解剖刀横切子叶,取近下胚轴的1/2子叶,先竖切,制成1/4子叶,再将2片1/4子叶沿中间缝隙切开,制成1/8子叶外植体。
近下胚轴的外植体均带有部分生长点,每种制备方式提供90粒种子,观察记录不同制备方式外植体诱导出芽、成苗及繁殖系数。外植体制备见图1。
1.2.2 .2 初代培养
将外植体接种于添加不同浓度6-BA及TDZ的MS培养基中,置于温度25℃、14 h光照/10 h黑暗条件下培养,并设置13组激素浓度配比(表1)。初代培养14 d后,测定株高与株幅。

表1 初代培养培养基中激素浓度配比
1.2.2 .3 生根培养
初代培养14~28 d后,进行生根培养10~20 d。将初代组培苗接种于添加不同浓度6-BA、NAA的MS培养基,置于温度25℃、14 h光照/10 h黑暗条件下培养,并设置13组激素浓度配比(表2)。生根培养15 d后,测量根长、根重。

表2 生根培养培养基中激素浓度配比
1.2.2 .4 炼苗
选择生长健壮的植株进行炼苗及移栽。当植株真叶数为3叶、5叶、7叶时,采用不同的炼苗方式:(1)人工气候室中培养瓶全打开1 d后移栽;(2)人工气候室中培养瓶全打开2 d后移栽;(3)人工气候室中培养瓶半打开1 d、全打开1 d后移栽。
1.2.2 .5 组培苗移栽后生长状况观察
待5叶1心炼苗完成后,以催芽播种的普通苗为对照,选择5叶1心的普通苗和组培苗同时定植于内蒙古农业大学农场教学实践基地温室中,分别于定植后10、35、60 d观察组培苗与普通苗的植株长势、叶片颜色及发病情况。
1.2.2.6白粉病、病毒病病情指数
白粉病、病毒病分别参照马双武[10]、付洪冰等[11]的调查方法与评价标准。
1.3 数据计算及处理


采用Excel 2020软件作图,SPSS 18.0统计学软件进行方差分析。
2 结果与分析
2.1 不同籽用美洲南瓜品种种子萌发比较
由表3可知,不同籽用美洲南瓜品种种子萌发情况差异显著(P<0.05)。希望骄子、弘昌211、金丰八号、瑞丰九号、金地1号的萌发率较高、污染率较低、芽长>3 cm的萌发种子数较多;金丰光板、京成7091种子萌发率较低、污染率较高,不宜进行种子萌发培养及离体快繁培养。其中弘昌211萌发率较高、污染率最低(1.01%),适宜进行籽用美洲南瓜离体再生快繁体系的研究。
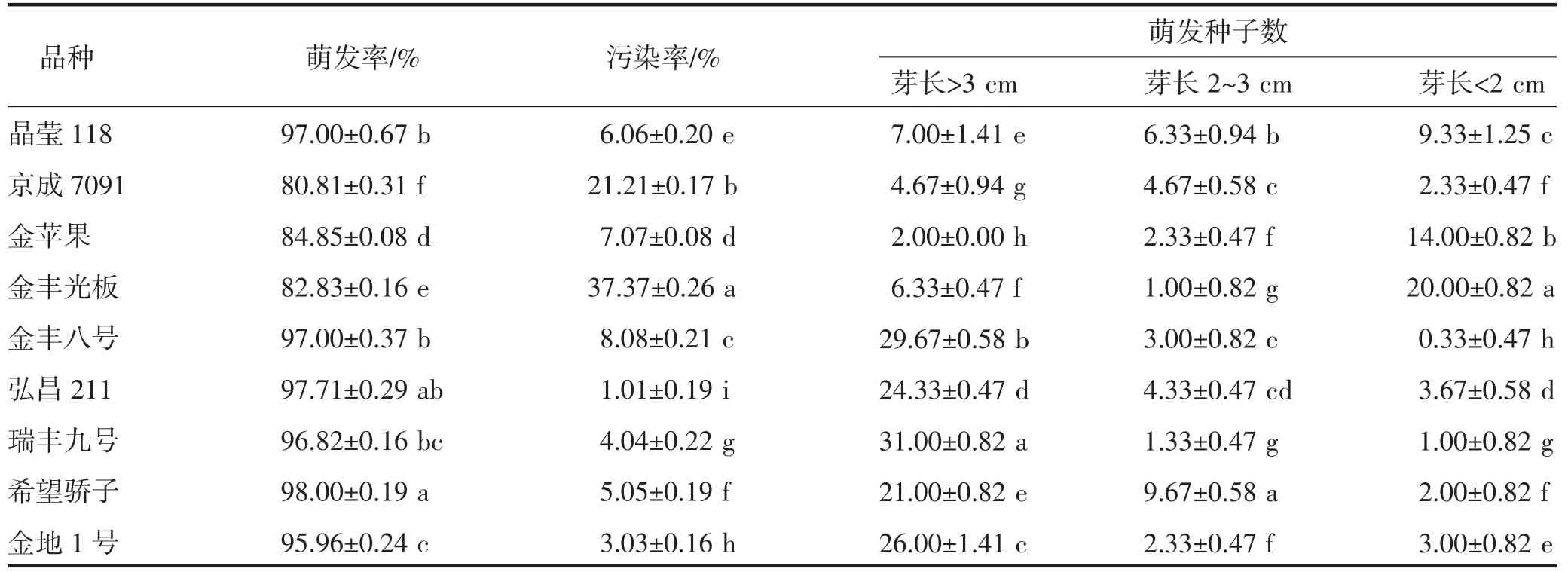
表3 不同籽用美洲南瓜品种种子萌发测定指标
2.2 弘昌211不同制备方式外植体诱导成苗分析
由表4可知,不同制备方式外植体对弘昌211组培苗诱导差异显著(P<0.05)。近下胚轴的1/2子叶为外植体时,组培苗不定芽诱导率、成苗率及繁殖系数最高,分别为98.99%、96.67%、0.97,诱导效果最好;远下胚轴的1/2子叶为外植体时,诱导效果最差,不定芽诱导率虽有35.55%,但成苗率极低,为5.56%。
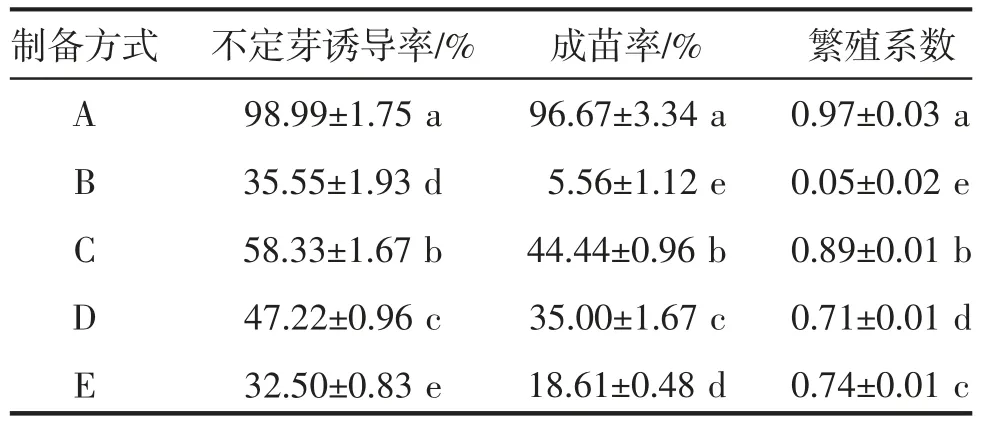
表4 弘昌211不同制备方式外植体诱导成苗情况
2.3 不同激素配比培养基对弘昌211组培苗初代培养的影响
由图2可知,不同激素配比对弘昌211组培苗初代培养株高及株幅的影响差异显著(P<0.05)。初代培养14 d,各处理均能产生组培苗,以T7处理的株高最高,为3.423 cm;株幅最大,为4.565 cm,且与其他处理相比差异显著(P<0.05)。由此可见,初代培养的最优激素配比组合为2.0 mg/L 6-BA+0.5 mg/L TDZ。

图2 初代培养14 d后弘昌211组培苗株高及株幅
2.4 不同激素配比对弘昌211组培苗生根培养的影响
由图3可知,不同激素配比对弘昌211组培苗根长影响差异显著(P<0.05)。Z2、Z5、Z7、Z8首先诱导成苗,生根培养15 d后根长表现为Z7>Z8>Z9>Z5>H3>Z6>Z2>Z3>Z1>H2>H1>CK。Z7处理的根长最长,为5.72 cm,且与其他处理相比差异显著(P<0.05)。

图3 生根培养15 d后弘昌211组培苗根长
由图4可知,不同激素配比对弘昌211组培苗根重影响差异显著(P<0.05)。生根培养15 d后根重表现为Z7>Z8>Z9>Z5>H3>Z6>Z2>Z3>Z1>H2>H1>CK。Z7处理的根重最重,为0.602 g,且与其他处理相比差异显著(P<0.05)。
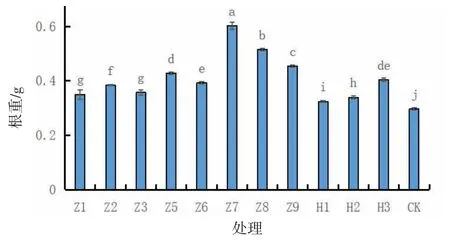
图4 生根培养15 d后弘昌211组培苗根重
由表5可知,弘昌211组培苗生根培养15 d后,Z7处理的平均根数最多,为5.62条;生根率最高,为100%,且植株健壮,根系粗长,无愈伤化及玻璃化现象。结合图3、图4结果可知,生根培养最优激素浓度配比为2.0 mg/L 6-BA+0.5 mg/L NAA。

表5 生根培养15 d后弘昌211组培苗生长状况
2.5 不同炼苗方式对弘昌211组培苗成活率的影响
由表6可知,不同炼苗方式对弘昌211组培苗移栽成活率影响差异显著(P<0.05)。人工气候室中培养瓶半打开1 d、全打开1 d后移栽成活率最高,3片真叶、5片真叶、7片真叶时移栽,成活率分别为82.27%、97.75%、88.24%,其中以5片真叶时移栽成活率最高。3片真叶、人工气候室中培养瓶全打开炼苗2 d,部分组培苗出现枯萎现象,最终植株死亡。
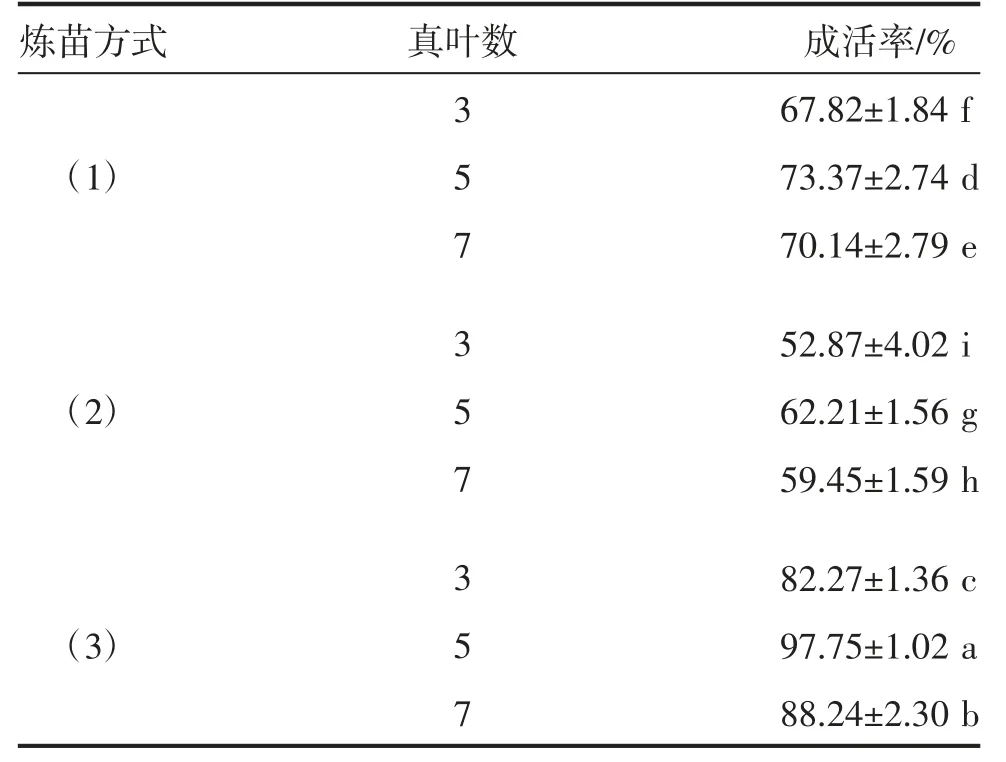
表6 不同炼苗方式弘昌211组培苗移栽成活率
2.6 弘昌211组培苗再生周期
由图5可知,弘昌211种子萌发3 d后,取近下胚轴的1/2子叶,在含有2.0 mg/L 6-BA+0.5 mg/L TDZ的MS培养基上进行初代芽诱导培养14~28 d,在含有2.0 mg/L 6-BA+0.5 mg/L NAA的MS培养基上生根培养10~20 d,人工气候室炼苗2 d、移栽5 d后定植于温室,再生周期为45 d左右。

图5 弘昌211组培苗再生周期
2.7 弘昌211组培苗移栽后生长状况
由图6可知,弘昌211移栽后10 d普通苗感染白粉病,且病情重于组培苗;移栽后35 d,普通苗与组培苗均开花,但普通苗白粉病及病毒病发病严重,且植株矮小;组培苗白粉病发病轻,无病毒病发生,植株长势明显优于普通苗。移栽后60 d,普通苗白粉病及病毒病发病严重,出现蔓枯病,叶片黄白相间;组培苗叶片无蔓枯病,白粉病及病毒病发病极轻,叶片鲜绿。

图6 弘昌211组培苗与普通苗移栽后生长状况
2.8 弘昌211组培苗与普通苗病情指数分析
2.8.1 组培苗与普通苗白粉病病情指数分析
由图7可知,组培苗与普通苗在定植后10、35、60 d白粉病病情指数差异显著(P<0.05)。定植后10 d,组培苗未出现白粉病,而普通苗病情指数为8.27;定植后35 d,普通苗病情指数为35.21(感),组培苗病情指数为2.40(高抗);定植后60 d,普通苗病情指数为57.24(中感),组培苗病情指数为5.21(高抗)。
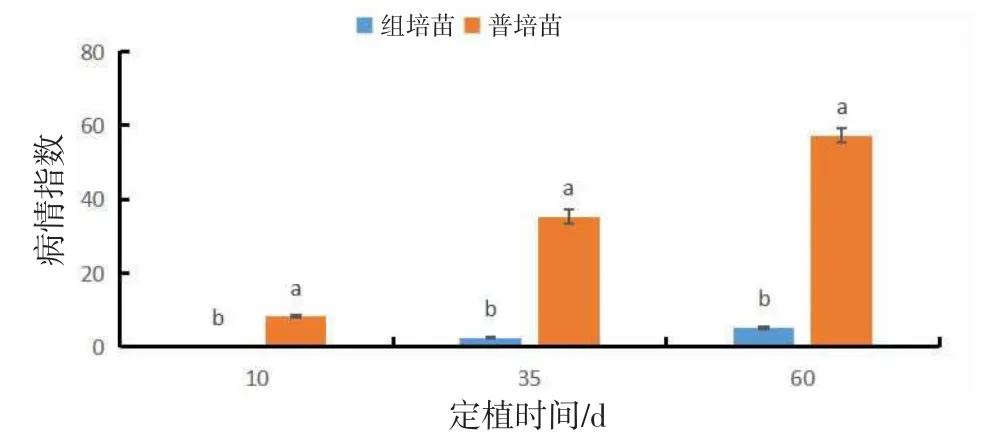
图7 组培苗与普通苗白粉病病情指数
2.8.2 组培苗与普通苗病毒病病情指数分析
由图8可知,组培苗与普通苗在定植后35、60 d病毒病病情指数差异显著(P<0.05)。定植后10 d,组培苗与普通苗均未出现病毒病;定植后35 d,普通苗病情指数为20.14,组培苗未出现病毒病;定植后60 d,普通苗病情指数为62.41(感),组培苗病情指数为8.52(抗)。
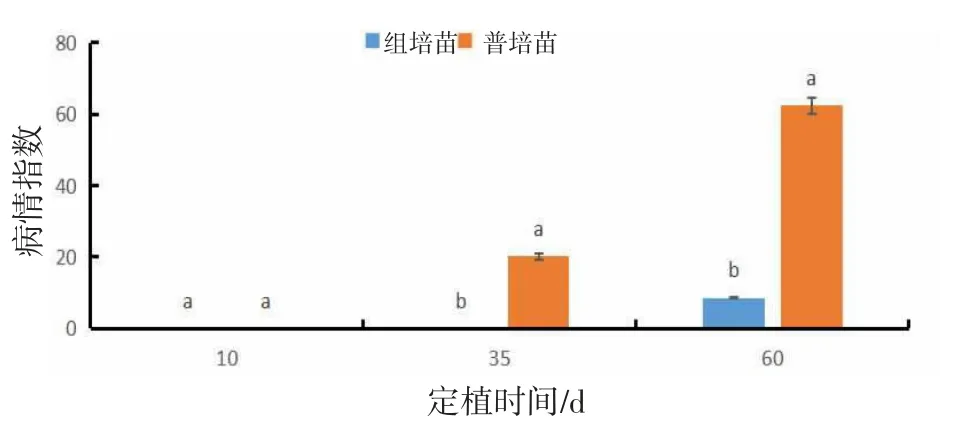
图8 组培苗与普通苗病毒病病情指数
3 讨论与结论
现有的籽用美洲南瓜从子叶接种到苗再生需要70 d左右,周期较长。本试验籽用美洲南瓜品种弘昌211从子叶接种到苗再生周期为45 d左右,较中国南瓜高效再生体系的建立试验获得再生苗周期缩短25 d左右[4],较印度南瓜离体再生与遗传转化体系的优化试验获得再生苗周期缩短20 d左右[12]。本试验选择籽用美洲南瓜品种弘昌211近下胚轴的1/2子叶为外植体,不定芽诱导率为98.99%、成苗率为96.67%,较印度南瓜[5]子叶节离体再生不定芽诱导率提高43.79%,较中国南瓜[6]贝粟灰子叶节离体再生不定芽诱导率提高10.10%,较中国南瓜[7]大果蜜本子叶节离体再生不定芽诱导率提高40.66%、成苗率提高11.67%。本试验籽用美洲南瓜品种弘昌211组培苗离体再生诱导效果好,成苗时间短。
本试验初代培养设置不同浓度6-BA与TDZ组合,发现两种激素组合具有促进籽用美洲南瓜分裂分化及生根的双重作用。不同浓度6-BA与TDZ组合在红纹凤仙花[13]、月季[14]、大豆[15]、草莓[16]等植物离体培养中已有报道,本试验适当地加大了TDZ激素的用量,与TDZ在卷丹百合[17]、苹果[18]、金叶复叶槭[19]、蝴蝶兰[20]等植物上的应用相比效果更好,表现为籽用美洲南瓜组培苗不定芽诱导率较高,且部分再生苗直接诱导出发达的根系,再生植株叶片鲜绿,无褐化现象,炼苗移栽后植株高大、健壮。生根培养设置不同浓度6-BA与NAA,获得了根系发达、移栽易成活的籽用美洲南瓜组培苗。
本试验籽用美洲南瓜品种弘昌211组培苗不定芽诱导率、成苗率较高,组培苗再生周期短,与普通苗相比,表现出对白粉病、病毒病较强的抗性,减轻了种传病害对籽用美洲南瓜的危害。
