多西他赛联合阿帕替尼二线治疗晚期非小细胞肺癌的疗效与安全性研究
2023-01-11朱宏财岳丽娟薛玲张晶晶侯新丽
朱宏财,岳丽娟,薛玲,张晶晶,侯新丽
汉中市中心医院肿瘤内科,陕西 汉中 723000
非小细胞肺癌(non-small cell lung cancer,NSCLC)是起源于支气管黏膜、支气管腺体和肺泡上皮的一类肺恶性肿瘤,显微镜下特点是胞浆丰富、核异形及细胞较大[1]。NSCLC包括鳞状细胞癌、腺癌及大细胞癌等,多数患者在早期无特异性症状,等到确诊时已发展至中晚期,使患者错过最佳治疗时机无法进行手术切除[2-3],严重影响患者生命安全和生活质量。目前化疗仍为治疗NSCLC 的有效方案,但该疗法具有较大的毒副反应,导致患者耐受性较差,无法完成治疗[4]。为提高患者治疗疗效,寻找更为安全的治疗措施现已成为临床重点关注热点。多西他赛是一种紫杉醇类抗肿瘤药,具有较强的抗肿瘤活性,但其单一用于治疗NSCLC疗效欠佳[5]。阿帕替尼作为小分子靶向药,通过恶性肿瘤供血血管的受体不同来抑制肿瘤血管的生成,导致恶性肿瘤的坏死,抑制恶性肿瘤的生长,现已在胃癌中得到广泛应用并取得了较好效果[6-7]。鉴于此,本文将观察多西他赛联合阿帕替尼二线治疗晚期NSCLC 的临床疗效和安全性,并探讨其对患者肿瘤标志物和生存期的影响。
1 资料与方法
1.1 一般资料 选取2018 年3 月至2020 年2 月在汉中市中心医院肿瘤内科收治的94 例一线治疗后进展Ⅲ~Ⅳ期NSCLC 患者作为研究对象。纳入标准:①符合NSCLC诊断标准[8]且所有患者预计生存时间>6个月;②配合研究者;③所有患者在入组前均接受过一线治疗方案使用间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)抑制剂治疗后病情仍继续进展,且无T790M突变。排除标准:①存在严重免疫系统疾病者;②存在其他恶性肿瘤者;③存在重要脏器病变者;④存在精神疾病者。采用随机数表法将患者分为观察组和对照组,每组47 例。两组患者的年龄、性别及病理类型等一般资料比较差异均无统计学意义(P>0.05),见表1。本研究经医院伦理委员会审核批准,所有患者及家属均知情并签署知情同意书。
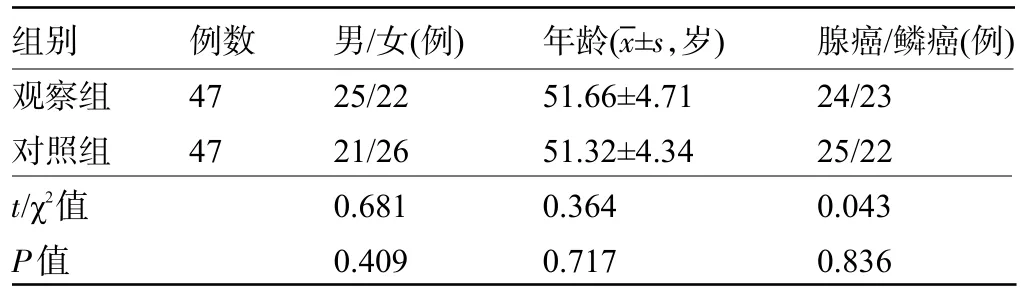
表1 两组患者的一般资料比较
1.2 治疗方法 所有患者于开始化疗前1 d给予醋酸地塞米松(生产厂家:遂成药业股份有限公司,批准文号:国药准字H37021898,规格:0.75 mg×100 片)治疗,0.75~3.00 mg/次,2~4 次/d,共服用3 d。对照组患者在此治疗基础上予以多西他赛(生产厂家:江苏奥赛康药业有限公司,批准文号:国药准字H20184140,规格:1 mL:20 mg)治疗。静脉滴注70~75 mg/m2,每3 周重复一次,滴注1 h/次。以3 周为一个治疗周期,持续用药2个周期。观察组患者在对照组治疗的基础上联合阿帕替尼(生产厂家:江苏恒瑞医药股份有限公司,批准文号:国药准字H20140103,规格:0.25 g×30片)治疗,于餐后 30 min 口服,850 mg/次,1 次/d。以 3 周为一个治疗周期,持续用药2个周期。
1.3 观察指标与评价(检测)方法
1.3.1 临床疗效 在治疗2个周期后根据世界卫生组织(World Health Organization,WHO)实体瘤评价标准[9]对患者的疗效进行评估。完全缓解(complete remission,CR):所有病灶完全消失,肿瘤标志物水平下降至正常;部分缓解(partial remission,PR):患者临床症状完全改善,病灶直径减少一半;稳定(stabilization disease,SD):患者临床症状有改善,病灶直径增大<25%或缩小<50%;进展(progress disease,PD):患者临床症状没有好转甚至加重,有新的病灶出现。总有效率=CR率+PR率+SD率。
1.3.2 肿瘤标志物 在治疗前1 d及治疗结束时,采集患者清晨空腹肘静脉血3 固后进行离心分离血清(8 cm离心半径,3 000 r/min 离心10 min)。取上层清液采用电化学发光法(仪器:BPCL电化学发光检测仪,雷迪美特中国有限公司)检测细胞角蛋白19 片段抗原21-1(cytokeratin 19 fragment antigen,CYFRA21-1)、癌胚抗原(carcino-embryonic antigen,CEA)、糖蛋白抗原125 (glycoprotein antigen,CA125)及鳞状上皮细胞癌抗原(squamous cell carcinoma antigen,SCC)。试剂和试剂盒为仪器所配套。
1.3.3 免疫功能 在治疗前1 d 及治疗结束时,采集患者清晨空腹肘静脉血3 mL,离心分离取上清液,置于离心管中,加入CD3+、CD4+、CD8+混合抗体(APC标记CD3+、PE标记CD4+、FITC标记CD8+),于振荡器混合均匀,室温条件下避光孵育30 min,加入2 mL 磷酸盐缓冲液(phosphate buffer saline,PBS)溶液,混合均匀,离心取上清液,加入0.5 mL PBS 溶液,混合均匀。采用流式细胞仪(美国贝克曼FC500)检测血清T 淋巴细胞亚群CD3+、CD4+、CD8+并计算CD4+/CD8+比值。
1.3.4 不良反应 在治疗期间,观察两组患者不良反应发生情况,包括白细胞减少、恶心呕吐及腹泻等。
1.3.5 生存率 完成治疗后进入2 年的随访期,要求返院复查及进行生存随访,患者死亡或失访时结束,最后一次随访时间为2022 年2月。比较两组患者生存情况。
1.4 统计学方法 应用SPSS22.0 统计学软件进行数据统计学分析。计数资料比较采用χ2检验;计量资料符合正态分布,以均数±标准差()表示,组间比较采用成组t 检验,治疗前后比较采用配对t检验;采用Kaplan-Meier 生存曲线法分析不同治疗方法对患者生存率的影响。以P<0.05 表示差异有统计学意义。
2 结果
2.1 两组患者的临床疗效比较 观察组患者的临床治疗总有效率为48.94%,明显高于对照组的27.66%,差异有统计学意义(χ2=4.502,P=0.034<0.05),见表2。

表2 两组患者的临床疗效比较(例)
2.2 两组患者治疗前后的肿瘤标志物水平比较 治疗前,两组患者的CYFRA21-1、CEA、CA125及SCC 水平比较差异均无统计学意义(P>0.05);治疗后,两组患者的 CYFRA21-1、CEA、CA125 及 SCC 水平均较治疗前显著降低,且观察组明显低于对照组,差异均有统计学意义(P<0.05),见表3。
表3 两组患者治疗前后的肿瘤标志物水平比较()
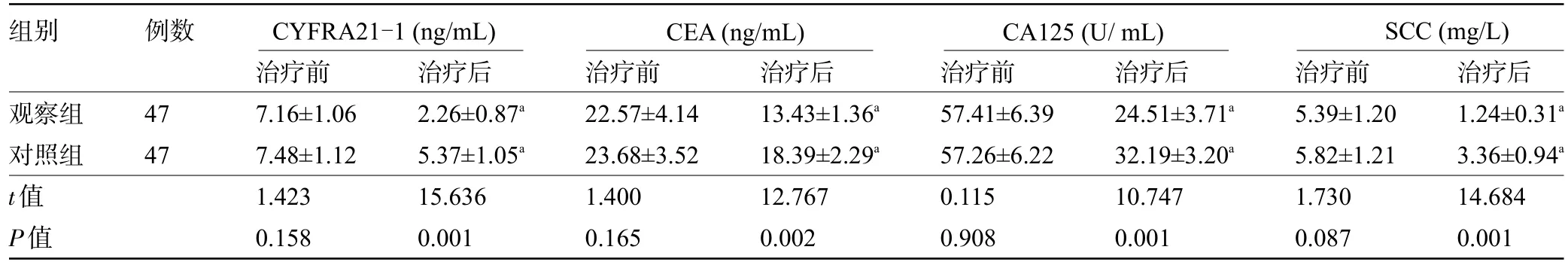
表3 两组患者治疗前后的肿瘤标志物水平比较()
注:与同组治疗前比较,aP<0.05。
组别 例数CYFRA21-1(ng/mL) CEA(ng/mL) CA125(U/mL) SCC(mg/L)观察组对照组t值P值47 47治疗前7.16±1.06 7.48±1.12 1.423 0.158治疗后2.26±0.87a 5.37±1.05a 15.636 0.001治疗前22.57±4.14 23.68±3.52 1.400 0.165治疗后13.43±1.36a 18.39±2.29a 12.767 0.002治疗前57.41±6.39 57.26±6.22 0.115 0.908治疗后24.51±3.71a 32.19±3.20a 10.747 0.001治疗前5.39±1.20 5.82±1.21 1.730 0.087治疗后1.24±0.31a 3.36±0.94a 14.684 0.001
2.3 两组患者治疗前后的免疫功能比较 治疗前,两组患者的CD3+、CD4+、CD8+及CD4+/CD8+水平比较差异无统计学意义(P>0.05);治疗后,观察组患者的CD3+、CD4+及CD4+/CD8+均较治疗前显著上升,且观察组明显高于对照组,CD8+较治疗前显著降低,且观察组明显低于对照组,差异均有统计学意义(P<0.05),见表4。
表4 两组患者治疗前后的免疫功能比较()

表4 两组患者治疗前后的免疫功能比较()
注:与同组治疗前比较,aP<0.05。
组别 例数CD3+(%) CD4+(%) CD8+(%) CD4+/CD8+观察组对照组t值P值47 47治疗前54.83±4.34 55.21±4.01 0.365 0.716治疗后59.62±4.15a 56.94±5.25a 2.552 0.013治疗前32.78±5.01 33.17±4.52 0.368 0.714治疗后38.12±4.88a 35.25±4.34a 2.795 0.007治疗前29.38±4.33 30.36±3.79 1.083 0.282治疗后20.54±2.58a 23.76±2.73a 5.457 0.001治疗前1.10±0.21 1.09±0.17 0.235 0.815治疗后1.61±0.27a 1.32±0.24a 5.105 0.001
2.4 两组患者的不良反应比较 观察组患者治疗期间的不良反应总发生率为21.28%,略高于对照组的17.02%,但差异无统计学意义(χ2=0.275,P=0.600>0.05),见表5。
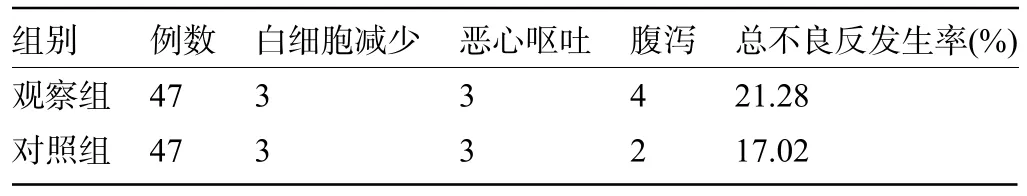
表5 两组患者的不良反应比较(例)
2.5 两组患者的2 年生存情况比较 两组患者均无失访情况。观察组患者的2 年生存率及无病生存率分别为40.43%及25.53%,明显高于对照组的27.66%及17.02%,差异具有统计学意义(Log rankχ2=5.830、9.259,P=0.016、0.002<0.05)。详见表 6、图 1 和图2。
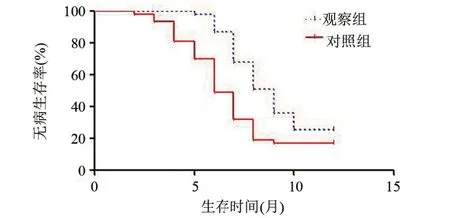
图2 两组患者2年的无病生存曲线

表6 两组患者的2年生存情况比较[例(%)]

图1 两组患者2年的生存曲线
3 讨论
NSCLC为我国最常见的肿瘤之一,约占所有肺癌的80%,主要是由于吸烟、致癌因素及空气污染等引起的。其发病率和死亡率均为恶性肿瘤首位[10],具有生长快、扩散和转移早等特点。目前临床常采用一线化疗药物如多西他赛、紫杉醇等进行治疗,但因患者个体的差异性及病情的不同,导致部分患者无法获得预期疗效,且部分二线化疗药物治疗NSCLC 毒副反应较大[11]。故需不断探索研究更为安全、有效的多线治疗药物。
多西他赛通过加强微管蛋白聚合作用和抑制微管解聚作用,使非功能性维管束形成,破坏肿瘤细胞的有丝分裂,进而抑制肿瘤细胞的增殖和分化[12]。但有学者认为,单一使用多西他赛对肿瘤的缓解率较低,再加之毒副反应较多,导致疗效欠佳[13]。本研究结果显示,观察组患者的临床总有效率及生存率均高于对照组,这与徐芹等[14]研究结果类似,提示多西他赛联合阿帕替尼治疗可提高NSCLC 患者的临床疗效,延长患者生存期。究其原因,可能是由于阿帕替尼是新一代小分子血管内皮生长因子受体-2 酪氨酸激酶抑制剂,主要成分为甲磺酸阿帕替尼,具有抗血管生成的作用,可高度选择性竞争细胞内血管内皮生长因子受体-2 的ATP 结合位点,阻断下游信号转导,抑制肿瘤组织新血管的生成[15-16]。此外,阿帕替尼还具有逆转耐药基因的效应,可缓解患者耐药作用[17],与多西他赛联用后,不仅可抑制肿瘤细胞的有丝分裂,还可阻止肿瘤血管的生成,对提高患者临床疗效,延长生存期均具有积极作用。
CYFRA211可在所有上皮细胞和上皮来源的肿瘤细胞中表达,当其被恶性肿瘤细胞激活时呈现异常高表达,对NSCLC的诊断、治疗和预后均有重要临床意义[18]。CEA 作为一种广谱性肿瘤标志物,在多种肿瘤疾病中呈现高表达。CA125 为糖蛋白性的肿瘤相关抗原,在正常情况下,其仅在细胞内合成,当机体发生异常病变时导致CA125 集中在细胞边缘并逐渐消除细胞膜从而进入血液中,导致CA125 水平异常升高[19]。SCC 作为肺癌患者重要的肿瘤标志物之一,其水平与肿瘤恶变程度呈现正相关关系。本研究中,观察组CYFRA21-1、CEA、CA125 及SCC水平均低于对照组,这与尚可等[20]研究部分类似,多西他赛联合阿帕替尼治疗后,肿瘤标志物降低更明显,提示对肿瘤细胞的杀伤力更强,也与观察组总生存率和无病生存率更高的结果相吻合。究其原因,可能是由于两种药物联用使药物的抗肿瘤作用得以增加。通过多西他赛的延缓肿瘤细胞增殖速度作用及阿帕替尼的降低血管内皮生长因子活性作用,有效抑制肿瘤生长、增殖及分化,促进肿瘤细胞凋亡,达到降低血清肿瘤标志物水平的目的。肿瘤患者机体免疫功能受到明显抑制,CD3+为成熟的T淋巴细胞,CD4+为辅助淋巴细胞,其水平下降表示免疫功能较低,CD8+为T淋巴抑制细胞,其水平升高可能会发生较强的免疫反应。本研究中,观察组CD3+、CD4+及CD4+/CD8+水平高于对照组,CD8+水平低于对照组,说明多西他赛联合阿帕替尼二线治疗晚期NSCLC可增强患者免疫功能。可能是由于阿帕替尼的阻止肿瘤新血管生成作用有利于改善肿瘤内的微环境,进而使患者机体内的免疫细胞构成改变,在一定程度上可缓解免疫抑制作用[21],使CD8+水平明显降低。联合多西他赛治疗后,可使患者机体的辅助T细胞增多,分泌大量的细胞因子,发挥协同抗肿瘤作用进而提高患者免疫功能,增加CD3+、CD4+及CD4+/CD8+水平。
综上所述,多西他赛联合阿帕替尼二线治疗晚期NSCLC可提高患者临床疗效,降低血清肿瘤标志物水平,增强免疫功能,延长生存期。本研究不足之处在于纳入样本量偏少,结果可能存在选择性偏倚。临床应扩大样本量进行深入研究加以验证。
