SHP2作为抗肿瘤治疗靶点的价值及其在肿瘤免疫治疗中的应用
2023-01-11张玥汪越综述魏嘉审校
张玥 汪越 综述 魏嘉 审校
包含Src同源2结构域的蛋白酪氨酸磷酸酶2(Src homology region 2-containing protein tyrosine phosphatase 2,SHP2)的激活突变与肿瘤的发生发展密切相关,还有研究证明SHP2可以促进乳腺癌[1]、胃癌[2]、肺癌[3]和宫颈癌[4]等肿瘤的发生发展,作为抗肿瘤治疗的靶点展现出极高的潜在价值。近年来,至少有9种靶向SHP2的抑制剂已进入临床试验阶段,用于治疗多种恶性肿瘤。肿瘤免疫治疗通过调节肿瘤免疫微环境(Tumor immune microenvironment,TIME)、调控免疫检查点信号通路和过继免疫细胞等方式增强自体免疫细胞对肿瘤的自然防御[5],SHP2可以通过调节多种免疫检查点下游信号通路,调控TIME中的T淋巴细胞和巨噬细胞等免疫细胞[6]。因而靶向抑制SHP2可以激活免疫细胞功能,起到免疫与靶向双重治疗的效果。
1 SHP2结构
SHP2是一种非受体型蛋白酪氨酸磷酸酶(Protein tyrosine phosphatase,PTP),由PTPN11基因编码,包含1个PTP催化结构域、2个位于N末端的SH2以及1个C-末端尾部。SHP2的N末端有2个串联排列的SH2结构域,分别为N-SH2和C-SH2。N-SH2在SHP2的激活中起关键作用,在非活性状态下,N-SH2通过结合PTP结构域直接抑制磷酸酶的活性,而一旦N-SH2与特定的磷酸酪氨酸蛋白结合,SHP2转为活性状态。相比较而言,C-SH2并不直接促进SHP2的激活,但也有助于提高底物结合特异性[7-9]。Tyr542和Tyr580是位于SHP2的C端尾部的2个磷酸化酪氨酸位点,可在细胞外刺激下发生磷酸化,激活下游的RAS/ERK信号[10],其磷酸化还有助于解除N-SH2对PTP的抑制,促进PTP的激活[11]。
2 SHP2的下游信号通路及其在肿瘤靶向治疗中的作用
2.1 RAS/ERK通路
RAS/ERK通路的激活对肿瘤细胞增殖和分化至关重要,几乎所有受体酪氨酸激酶(Receptor tyrosine kinase,RTK)都以激活SHP2为主要甚至是唯一途径来激活下游的RAS/ERK通路[12]。因而,SHP2抑制剂相关的治疗性研究大多聚焦于RAS/ERK通路。SHP2激活RAS/ERK通路的机制主要分为三个方面:首先,SHP2被激活后可以通过招募RTK质膜表面的GRB2/SOS1复合物激活RAS/ERK信号;其次,SHP2可以使Gab1上的RasGAP结合位点去磷酸化,增强RAS与RAF的结合,使增殖性RAS/ERK通路持续激活;最后,SHP2还可以解除RAS的负调节因子SPRY对GRB2/SOS1的抑制,从而激活RAS[6,13]。
变构SHP2抑制剂在RTK突变的肿瘤细胞系中主要抑制RAS/ERK通路[14]。RMC-4630是一种变构SHP2抑制剂,其Ⅰ期临床试验初步结果显示,RMC-4630对于KRASG12C突变的非小细胞肺癌有较好的临床治疗效果,并且能够成功抑制RAS/ERK通路[15]。同时,由于最近新发现的变构SHP2抑制剂能够同时抑制多种RTK及其介导的RAS/ERK通路,SHP2抑制剂可以作为一种较通用的方式用于治疗RTK及MAPK驱动的肿瘤,并且通过联用增强各种RTK抑制剂及RAS/ERK抑制剂的疗效[14]。Fedele等[16]研究发现,在KRASG12C突变的胰腺导管腺癌和非小细胞肺癌模型中,SHP2抑制剂SHP099可以增强G12C抑制剂的疗效,同时还可以克服G12C抑制剂的耐药性,两者联用不仅可以直接抑制肿瘤,激活T细胞抗肿瘤免疫,甚至还有一定的抗肿瘤血管生成作用,证实了SHP2抑制剂可以多方面促进RAS/ERK抑制剂的疗效。
2.2 PI3K/Akt通路
对于大部分RTK突变的肿瘤,SHP2都可以通过与RTK质膜表面的GAB1结合从而激活其下游的PI3K/Akt通路,发挥致癌作用[6]。有研究表明,乳腺癌中高表达的SHP2可以通过激活PI3K/Akt信号使GSK3β磷酸化,从而促进乳腺癌细胞的增殖[17]。然而,SHP2在某些情况下也可以抑制PI3K/Akt信号通路。在EGFR信号通路中,SHP2可以使GAB1上的PI3K结合位点去磷酸化,下调GAB1介导的PI3K/Akt激活。此外,SHP2还可以与p85结合,形成GAB2/SHP2/p85复合物从而抑制PI3K/Akt通路[13]。以上研究表明,SHP2在不同的情况下对PI3K/AKT通路可以表现出截然不同的作用,其对PI3K/Akt通路或许还存在未知的复杂调控机制,有待进一步研究。
2.3 JAK/STAT通路
SHP2对JAK/STAT通路的影响与其对PI3K/Akt通路类似,根据底物的不同兼具激活与抑制的作用。JAK/STAT信号是Ⅰ/Ⅱ型干扰素、转化生长因子β(TGF-β)、IL-6等细胞因子的主要下游信号。既往研究表明,SHP2可以抑制IL-6介导的gp130通路,使STAT3去磷酸化,从而负调控JAK/STAT3通路,并最终导致青少年骨髓单核细胞白血病[18-19]。同时,SHP2可以下调由γ干扰素诱导的STAT1,负性调控JAK/STAT1通路,最终导致人巨细胞病毒的免疫逃逸[20]。但最新研究表明,SHP2在某些情况下也可以激活JAK/STAT通路。在TGF-β刺激下,SHP2可以使JAK2中的Tyr570去磷酸化,进而激活JAK2/SATA3通路[21]。
3 SHP2作为免疫治疗靶点在抗肿瘤治疗中的潜力
3.1 SHP2活性对TIME中各种免疫细胞的影响
3.1.1 T细胞 T细胞是攻击肿瘤细胞的主力军,然而由于肿瘤微环境中存在多种抑制信号,肿瘤内的T细胞往往表现为功能失调的状态[22]。SHP2对T细胞的功能有重要的抑制作用,已有研究表明,敲除SHP2基因的小鼠对于炎症相关结肠癌表现出了CD8+T细胞浸润以及细胞毒性T淋巴细胞激活[23],证实了抑制SHP2可以激活T细胞促进抗肿瘤免疫。
SHP2可以通过调控多种关键的抑制性免疫检查点信号通路抑制T细胞,包括程序性死亡受体1(Programmed cell death protein-1,PD-1)、细胞毒性T淋巴细胞相关蛋白4(Cytotoxic T lymphocyte-associated antigen-4,CTLA-4)、B和T淋巴细胞衰减因子(B and the T lymphocyte attenuator,BTLA)、T细胞免疫球蛋白和免疫受体酪氨酸抑制性基序结构域(T cell immunoglobulin and immunoreceptor tyrosine-based inhibitory motif domain,TIGIT)等。SHP2对其他免疫检查点的作用尚待进一步探索,淋巴细胞活化基因3(LAG-3)、T细胞免疫球蛋白粘液素3(TIM-3)和T细胞活化的V结构域Ig抑制因子(VISTA)都是潜在的靶点[6]。
PD-1是免疫检查点阻断疗法中非常关键的靶点[24],其高表达于活化的T细胞。PD-1/PD-L1阻断疗法已在多种肿瘤中取得了良好的治疗效果,包括非小细胞肺癌[25]和黑色素瘤[26]等,但并非所有患者都能对PD-1/PD-L1阻断疗法产生应答。目前研究普遍认为,PD-1信号主要通过招募SHP2调控下游的一系列通路,抑制T细胞的功能[27]。有研究发现,PD-1选择性地招募SHP2,而并不招募同为PTP的SHP1[28],因而PD-1对SHP2的招募具有一定的特异性。PD-1尾部的免疫受体酪氨酸抑制基序(ITIM)以及免疫受体酪氨酸转换基序(ITSM)可以与SHP2的2个SH2结构域结合从而招募SHP2(图1)。一方面,SHP2被招募后可以通过抑制ZAP70磷酸化直接抑制TCR/CD3信号,并且抑制下游的RAS/ERK以及PI3K/Akt信号,进而抑制T细胞的激活[28-29];另一方面,SHP2可以抑制CD28的磷酸化,从而抑制下游的PI3K/Akt通路,抑制T细胞的活化[29]。基于抑制SHP2可以在PD-1信号中同时解除TCR/CD3信号及CD28信号对T细胞的抑制,SHP2抑制剂在促进PD-1抗体疗效以及克服PD-1抗体耐药性方面具有极高的潜能。Zhao等[30]发现,SHP099与PD-1抗体联用在小鼠结肠癌模型中展现出了较好的联合抗肿瘤疗效,明显高于单药疗效,提示了SHP2抑制剂与免疫检查点阻断疗法的联用有望成为未来SHP2研究的重要方向。
对于其他的免疫抑制性受体,已有研究证明,CTLA-4可以通过胞质域的基于酪氨酸的YVKM基序招募SHP2[31],进而抑制CD28信号,抑制T细胞的活化。也有报道表示,BTLA和TIGIT也可以通过ITIM结构招募SHP2[32-33],从而抑制T细胞(图1),更具体的内在机制有待进一步研究。
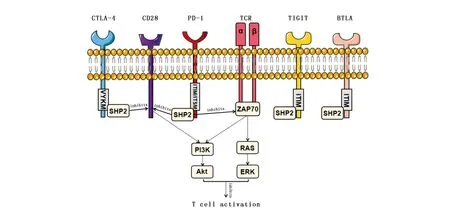
图1 SHP2对T细胞的调控机制示意图
3.1.2 巨噬细胞 巨噬细胞分为M1型和M2型。M1型巨噬细胞具有促炎抗癌的功能,而M2型具有抗炎促癌的功能[34]。SHP2在巨噬细胞的调控中具有重要的作用。Wang等[35]发现,SHP2可以与集落刺激因子-1(CSF-1)诱发的GRB2/GAB2蛋白复合物结合,从而激活RAS/ERK信号通路,促进巨噬细胞的增殖与M2极化(图2)。因而,SHP2可以通过激活巨噬细胞的CSF-1/CSF-1R轴促进肿瘤生长。
除此之外,SHP2还可以通过调控巨噬细胞介导肿瘤免疫逃逸。以往的研究表明,SHP2可以被巨噬细胞表面的信号调节蛋白(SIRP)以及唾液酸结合免疫球蛋白样凝集素-10(Siglec-10)通过ITIM所招募,通过减少巨噬细胞对肿瘤细胞的吞噬进而导致肿瘤免疫逃逸[6]。最新的研究中,Li等[36]还发现巨噬细胞上的淋巴细胞活化信号分子(SLAM)家族受体也可以通过招募SHP2抑制巨噬细胞的吞噬功能,通过阻断特定的SLAMF3及SLAMF4成功促进了巨噬细胞对造血系统肿瘤细胞的吞噬。同时,Gao等[37]还在结肠癌中发现了SHP2在巨噬细胞中所介导的新的肿瘤逃逸机制,即通过抑制STING-TBK1-IRF3通路下调I型干扰素,从而介导肿瘤免疫逃逸(图2)。
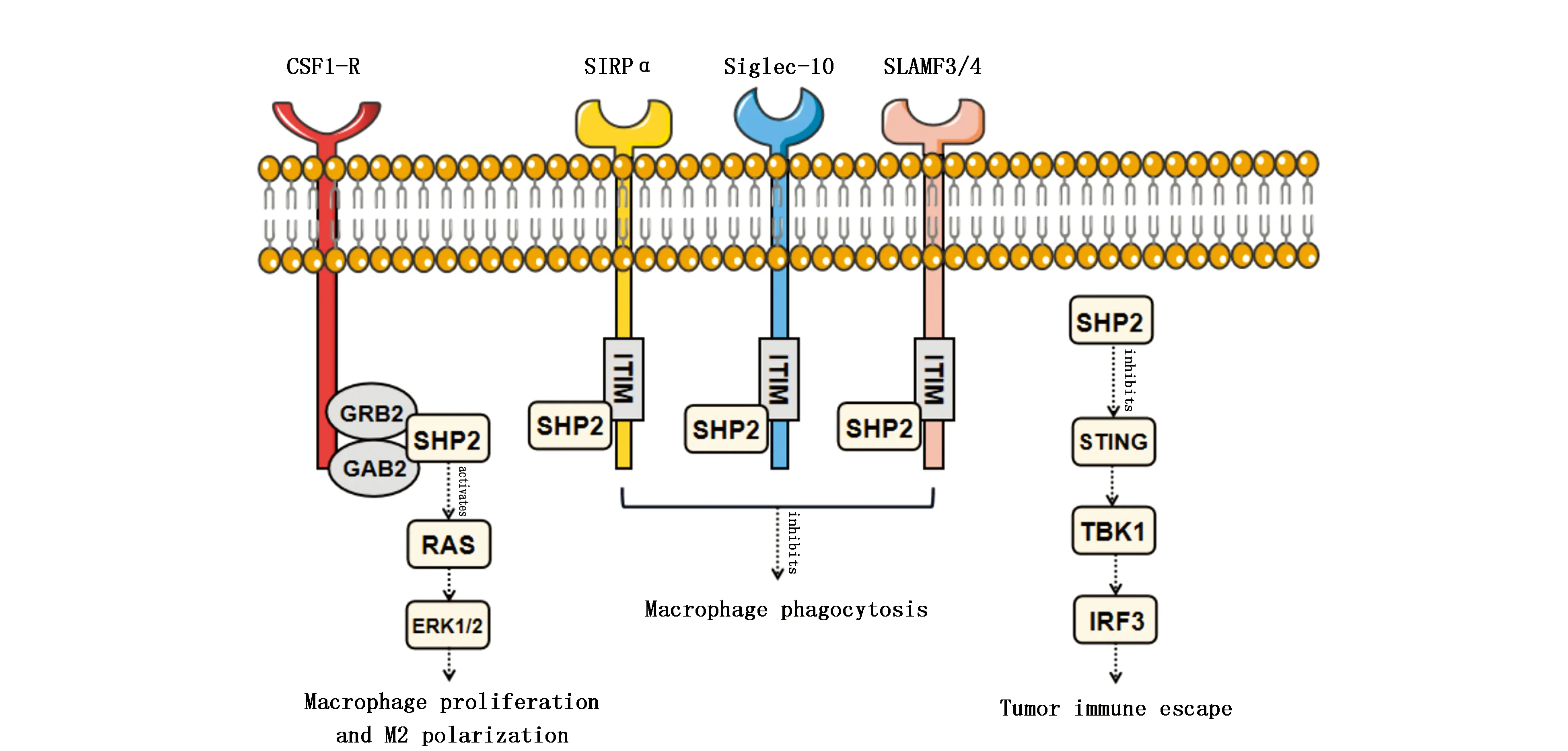
图2 SHP2对巨噬细胞的调控机制示意图
综上所述,SHP2通过调控巨噬细胞在促进肿瘤生长以及介导肿瘤免疫逃逸方面具有重要的作用,靶向抑制SHP2有望通过调控巨噬细胞达到抗肿瘤目的。
3.1.3 其他免疫细胞 目前SHP2对TIME的研究主要集中在T细胞和巨噬细胞上,然而也有研究表明,SHP2对其他免疫细胞也可能存在调节作用。最近的研究中,Song等[38]发现SHP2可以作为METTL3的下游信号,通过激活RAS/ERK通路促进NK细胞的增殖和分化,预示着SHP2可以正向调节NK细胞促进抗肿瘤免疫。另外,SHP2还被认为可以正向调节B细胞。有研究发现,在大量IL-6刺激下,SHP2的激活可以促进前B细胞的增殖,但SHP2对于肿瘤微环境中的B细胞是否有促进作用尚无明确的报道[39]。Tang等[40]还发现,SHP099可以通过趋化因子CXCL1/5介导的NF-κB通路上调肿瘤微环境中的gMDSC,从而抑制了SHP099的抗肿瘤功能。
以上研究表明,SHP2抑制剂可以通过激活T细胞以及巨噬细胞发挥抗肿瘤作用,但是有可能由于同时抑制了NK细胞、B细胞或上调了gMDSC而使抗肿瘤功能受到限制。因此,通过深入研究SHP2对不同免疫细胞的作用机制,联合不同的调控手段,或许可以有效提高SHP2抑制剂抗肿瘤疗效。
3.2 免疫联合靶向双重治疗功能
通过抑制SHP2,一方面可以通过抑制其下游的RAS/ERK、PI3K/Akt和JAK/STAT等通路直接抑制肿瘤,另一方面,SHP2抑制剂还可以通过激活T细胞和促进巨噬细胞吞噬等抑制肿瘤,因而SHP2是免疫与靶向双重治疗的靶点。
目前有多种SHP2抑制剂已进入临床试验阶段,诺华公司开发的TNO155是第一个进入临床试验阶段的变构SHP2抑制剂,其公布的 Ⅰ 期临床试验结果显示,TNO155单药治疗实体瘤疗效较为有限。因而诺华公司正在积极尝试TNO155的联用方案,TNO155联合PD-1抗体、CDK4/6抑制剂等临床试验都正在进行,预示着SHP2抑制剂的联用或许会成为未来SHP2抑制剂开发的重点方向。一方面,SHP2抑制剂可联药用于治疗RTK驱动的肿瘤;另一方面,随着越来越多的研究揭示出SHP2抑制剂在TIME中的重要作用,SHP2抑制剂在联用免疫卡控点阻断疗法上展现出极高的潜能。目前,多种SHP2抑制剂都已正式启动联用RTK抑制、RAS/ERK抑制剂或PD-1抗体的临床试验,尽管试验尚无初步的结论,但临床前数据表明,在体内外合适的肿瘤模型中,TNO155联用EGFR抑制剂、CDK4/6抑制剂和PD-1抗体等都具有良好的联合疗效[41]。
随着越来越多有关SHP2的临床试验正式启动,SHP2正逐步展现出免疫联合靶向双重治疗靶点的功能,表1列出了大部分目前已经正式启动的SHP2抑制剂相关临床试验。
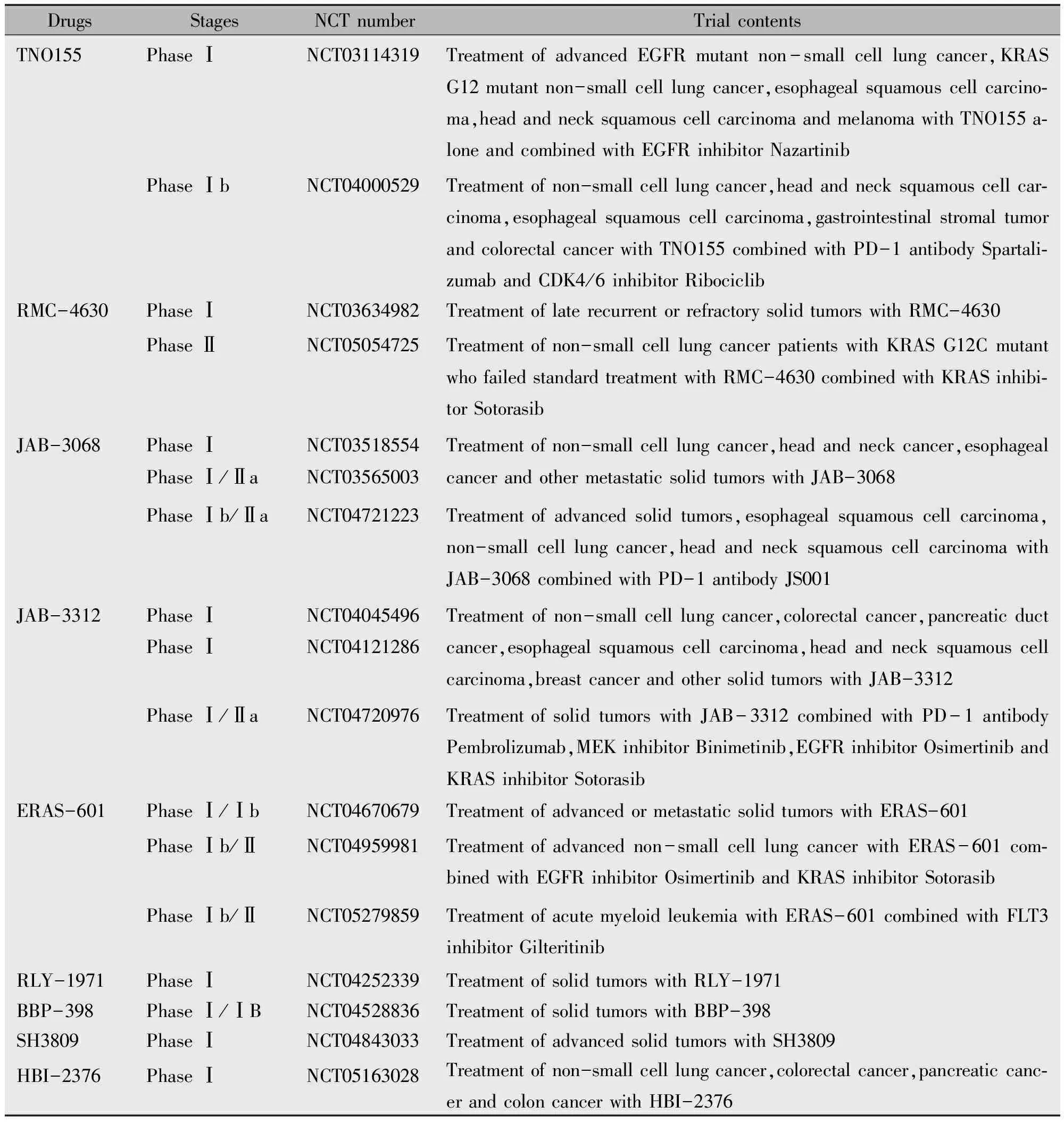
表1 临床试验阶段的SHP2抑制剂
4 SHP2的两面性
尽管SHP2是公认的致癌因子,但在一些情况下,SHP2也有抑癌的功能。目前大多数研究表明,SHP2基因的突变或过表达会通过调控下游多种信号通路直接促进肿瘤发生发展,最新的研究还发现,SHP2可以通过上调血管内皮细胞中的SOX7促进肿瘤血管生成[42]。但也有研究表明,SHP2基因存在一定的抗肿瘤作用,比如肝细胞中SHP2的缺失会通过激活STAT3导致肝细胞的癌变[43];在食管鳞状细胞癌中,SHP2也可以通过抑制STAT3抑制肿瘤[44];SHP2在结肠癌中可以通过抑制PARP1介导的肿瘤细胞DNA修复激活STING信号通路,增强抗肿瘤免疫,同时提高化疗的疗效[45]。SHP2的两面性还可以在同种肿瘤发展的不同阶段体现。Chen等[46]发现抑制SHP2可以在肝细胞癌发生的早期阶段抑制肿瘤生长,而在疾病后期促进肿瘤进展。
5 小结与展望
SHP2在成为抗肿瘤治疗理想靶点的道路上仍存在许多亟待解决的问题,例如SHP2在癌症中的两面性以及SHP2抑制剂的副作用等。但我们并不能忽视SHP2优越的抗肿瘤潜力,目前SHP2在多种携带RTK突变的实体瘤中都显示出较高的抗肿瘤活性,包括非小细胞肺癌[16]、胰腺癌[16,47]和胃癌[48]等,国内自主研发的JAB-3312、JAB-3068都已获得美国FDA用于食道癌(包括食管鳞状细胞癌)治疗的孤儿药认定。而SHP2抑制剂的联药,特别是与PD-1抗体联用的临床试验正受到广泛关注,我们期待看到更多SHP2抑制剂在肿瘤靶向与免疫治疗中联合应用的研究,充分发挥该明星靶点“靶免双效”的特点,为肿瘤治疗带来新的曙光。
