基于网络药理学探讨芎归六君子汤治疗慢性阻塞性肺疾病作用机制
2023-01-11郑杭彬许光兰李愿玲郑曼莉马浩挺
郑杭彬,许光兰,李愿玲,郑曼莉,马浩挺
(1.广西中医药大学研究生学院,南宁 530001;2.广西中医药大学第一附属医院,南宁 530023)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种常见的、可以预防和治疗的疾病,其特征是持续存在的呼吸系统症状和气流受限,其发病机制与慢性炎性反应、蛋白酶-抗蛋白酶失衡、氧化应激反应机制等有关。在2012年,全球超过300 万人死于COPD。2021年COPD 全球倡议预计,由于持续暴露于COPD危险因素及人口老龄化的到来,未来几十年COPD负担将增加[1]。
芎归六君子汤源于清代医家汪昂编写的《医方集解》下卷二十一,由川芎、当归、人参、白术、茯苓、炙甘草、陈皮、法半夏组成。以上诸药如《医方集解》所言,入足太阴、足厥阴药也。川芎为血中气药,能行气活血;当归补血活血;人参、茯苓、白术补气健脾祛湿;陈皮理气化痰;法半夏燥湿化痰;炙甘草调和诸药。法半夏、陈皮治痰滞,人参、白术补气虚,川芎、当归活血瘀。中医学将COPD 归属为“肺胀”范畴,病机可归纳为肺脾肾虚,痰淤阻肺[2]。具体来讲,其病位在肺,继则影响脾、肾,病性多属本虚标实,本虚主要为肺、脾、肾三脏虚损,标实主要指痰浊、水饮、瘀血3 种病理产物。因此,芎归六君子汤方义与COPD 病理环环相扣。有研究[3-4]表明,芎归六君子汤能抑制COPD 大鼠模型气道黏液高分泌状态。
网络药理学基于系统生物学构建药物有效成分、靶点、通路之间的网络拓扑关系,阐释中药复方“多成分-多靶点-多通路”治疗疾病作用的潜在机制。本研究运用网络药理学构建芎归六君子汤的药物-有效成分-治疗靶点网络,通过富集分析和分子对接,探讨芎归六君子汤治疗COPD的作用机制。
1 资料与方法
1.1 芎归六君子汤有效成分与靶标蛋白获取
在中药系统药理学数据库与分析平台TCMSP(https://tcmspw.com/tcmsp.php)中搜索芎归六君子汤组成中药(川芎、当归、人参、白术、茯苓、炙甘草、陈皮、法半夏)的化学成分,设定口服生物利用度(oral bioavailability,OB)≥30%、类药性(drug-likeness,DL)≥0.18,筛选出该方有效成分及有效成分对应靶标蛋白,利用UniProt(https://www.uniprot.org/)知识数据库Swiss-Prot对获得的靶标蛋白进行规范化注释,去除未能成功注释的靶标蛋白,得到各靶标蛋白对应的编码基因。
1.2 COPD 疾病基因靶点获取
以“chronic obstructive pulmonary disease”为关键词,在GeneCards(https://www.genecards.org/)数据库搜索得到COPD 疾病基因靶点。
1.3 中药-有效成分-靶点网络构建
对1.1 和1.2 步骤得到的有效成分靶标蛋白与COPD 疾病基因靶点在R 语言环境下取交集。在Cytoscape 3.8.0 软件中构建“中药-有效成分-靶点”复杂映射网络,进行可视化;利用工具Analyze Network,以degree 为参数值,筛选排名前10 的有效成分作为核心成分。
1.4 蛋白互作网络(PPI)构建
利用R 语言VeenDiagram 包绘制韦恩图,并将交集基因导入String(https://string-db.org/)数据库中,Organism 设定为Homo sapiens,设置最小要求交互分数为0.9(高可信度),隐藏网络离散点,得到PPI 网络拓扑及相应的文件。
1.5 PPI 网络核心靶点获取
为进一步筛选PPI 网络中的核心靶点,利用Cytoscape 3.8.0 的插件Cytohubba 对步骤1.4 中获得的PPI 网络进行分析。MCC、度中心性(degree)、接近中心性(closeness)、中介中心性(betweenness)参数可以有效地评估PPI 网络中的核心靶点[5]。本研究通过计算各靶点MCC、degree、closeness、betweenness 拓扑参数值,并求出各参数均值,以4 个参数的均值作为过滤条件,选取4 个参数值均大于各参数均值的靶点作为核心靶点。
1.6 核心靶点富集分析
将获得的核心靶点,利用R 语言中的cluster-Profiler 包,进行GO 生物过程(biological process,BP)、细胞组成(cellular component,CC)、分子功能(molecular function,MF)富集分析与KEGG 富集分析,设置pvalue Cutoff 为0.01,P 值校正方式为bonferroni,得到核心靶点GO 与KEGG 富集分析结果。
1.7 分子对接
通过PDB 数据库(https://www.rcsb.org/)与PubChem(https://pubchem.ncbi.nlm.nih.gov/)下载核心成分与核心靶点分子结构,使用AutoDock Tools 对接软件对关键靶点进行去水、加氢、加电子处理,对核心成分进行配体化处理,利用AutoDock Vina 1.1.2 进行分子对接,能量范围(energy range)设置为4,穷尽性(exhaustiveness)设置为10,预测复方中有效治疗COPD 的关键靶点与潜在药效物质的亲和力,最后利用PyMOL 软件对结果进行可视化。
2 结果
2.1 芎归六君子汤潜在有效成分及靶标蛋白获取结果
TCMSP 数据库的中药组成成分均有对应的药代动力学参数(ADME),确保有效成分的真实与可控性,基于OB≥30%,DL≥0.18 的过滤条件,通过TCMSP 数据库获取芎归六君子汤有效成分154 个,有效成分对应靶标蛋白共计284 个(不重复计数各中药共有的有效成分与靶标蛋白)。其中川芎有效成分7 个,当归有效成分2 个,党参有效成分21 个,白术有效成分7 个,茯苓有效成分15 个,甘草有效成分92 个,法半夏有效成分13 个,陈皮有效成分5 个。有多个成分存在于多个中药中,其中,川芎哚(perlolyrine)存在于川芎、党参中;谷甾醇(sitosterol)存在于川芎、甘草、陈皮中;β-谷甾醇(β-sitosterol)存在于当归、法半夏中;豆甾醇(stigmasterol)存在于当归、党参、法半夏中;7-甲氧基-2-甲基异黄酮(7-methoxy-2-methyl isoflavone)存在于党参、甘草中;柚皮素(naringenin)存在于甘草、陈皮中。利用Uniprot 知识数据库Swiss-Prot 规范化注释靶标蛋白241个,获取相应的编码基因,43 个靶标蛋白未能成功注释。
2.2 疾病靶点获取结果
以“chronic obstructive pulmonary disease”为关键词,在GeneCards 搜索得到COPD 疾病基因靶点3 854 个。
2.3 中药-有效成分-靶点网络分析
在R 语言环境下,将241 个芎归六君子汤有效成分对应的靶标蛋白编码基因与3 854 个COPD 疾病基因靶点取交集,得到交集基因163 个,即芎归六君子汤治疗COPD 的潜在治疗靶点,绘制韦恩图,见图1。将中药、有效成分及163 个潜在治疗靶点导入Cytoscape,得到中药-有效成分-靶点网络拓扑,见图2;因为“中药-有效成分-靶点”网络是一个存在层次的、单向的网络,且成分与成分的关系没有体现,因此仅基于degree 值,利用Analyze Network 对该拓扑中的有效成分进行筛选,得到排名前10 的核心成分,见表1。

表1 有效核心成分详细信息

图1 有效成分靶标蛋白与COPD 疾病基因交集韦恩图
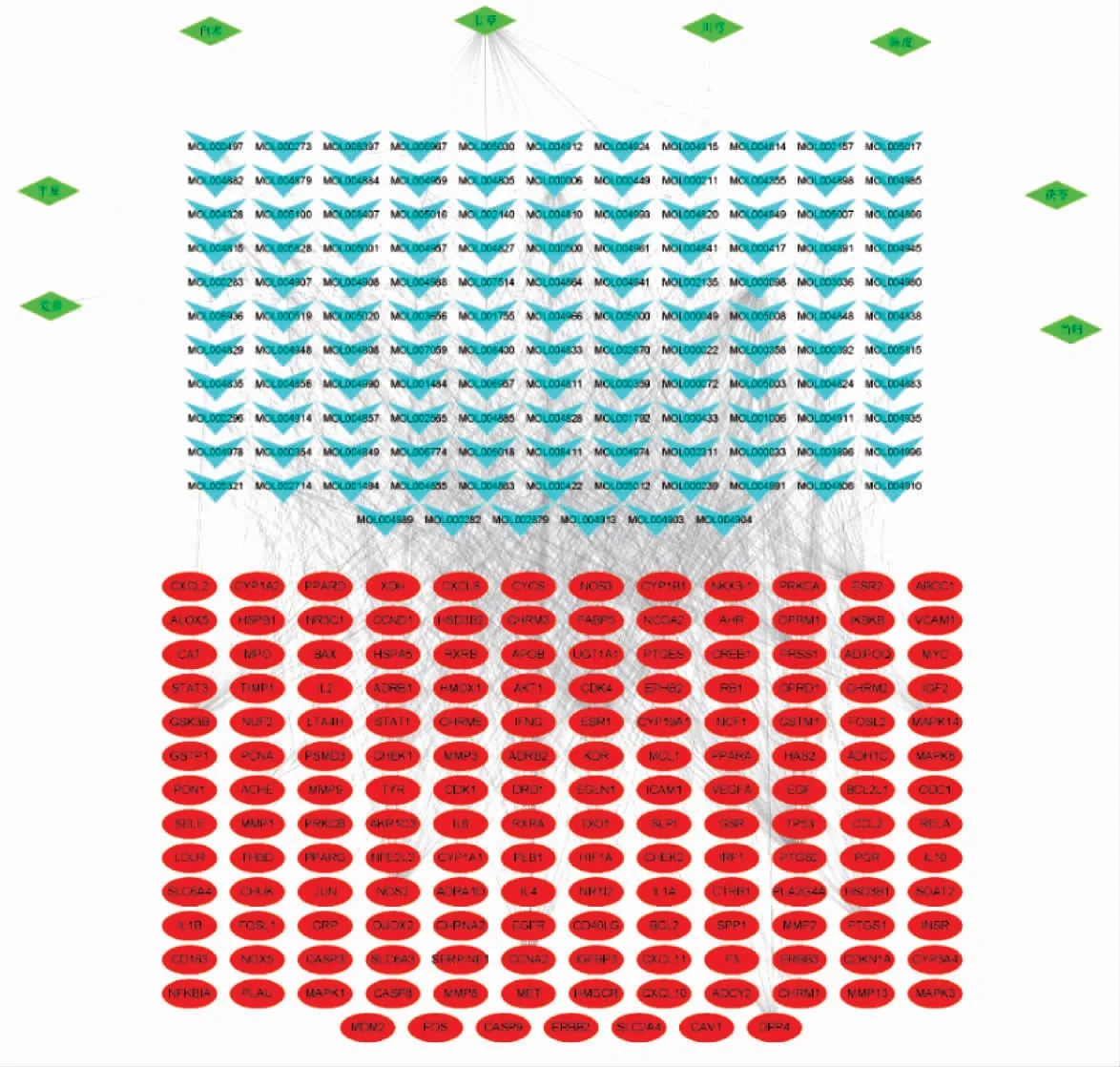
图2 中药-有效成分-靶点网络拓扑
2.4 PPI 网络分析
将163 个交集基因导入String 中,根据1.3 步骤设置的参数,得到PPI 网络拓扑及拓扑文件,拓扑见图3。String 统计显示,该PPI 网络中节点边数718 条,平均节点度值8.81。

图3 潜在治疗靶点PPI 网络
2.5 核心靶点富集分析结果
为获取PPI 网络中核心靶点,将PPI 拓扑文件导入Cytoscape 3.8.0 的插件Cytohubba 中,计算各靶点MCC、degree、closeness、betweenness 拓扑参数,求出该PPI 网络中MMC 均数为2 166.78,degree 均数为10.04,closeness 均数为58.04,betweenness 均数为267.43。以上述4 个拓扑参数均数作为过滤条件,筛选出该PPI 网络中核心靶点14 个,见表2。14 个核心靶点分别为MAPK14、ESR1、MAPK3、IL-4、CXCL8、MAPK1、IL-6、STAT3、RELA、FOS、JUN、MAPK8、TP53、AKT1。将核心靶点导入R 语言环境中,进行KEGG 富集分析得到关键通路126 条,选取前30 条可视化,见图4。结果中包括IL-17 信号通路(IL-17 signaling pathway)、TOLL 样受体信号通路(Toll-like receptor signaling pathway)、辅助性T 细胞17 分化(Th17 cell differentiation)、T 细胞受体信号通路(T cell receptor signaling pathway)、TNF 信号通路(TNF signaling pathway)、辅助性T1 与T2 细胞分化(Th1 and Th2 cell differentiation)、NOD 样受体信号通路(NOD-like receptor signaling pathway)、MAPK信号通路(MAPK signaling pathway)等关键通路。GO 富集分析合计得到635 条结果,各选取前20条可视化,见图5。包括MAP 激酶活性(MAP kinase activity)、激活转录因子结合(activating transcription factor binding)、细胞因子受体结合(cytokine receptor binding)、细胞因子活性(cytokine activity)、趋化因子受体结合(chemokine receptor binding)等结果。

图4 14 个核心靶点KEGG 富集分析
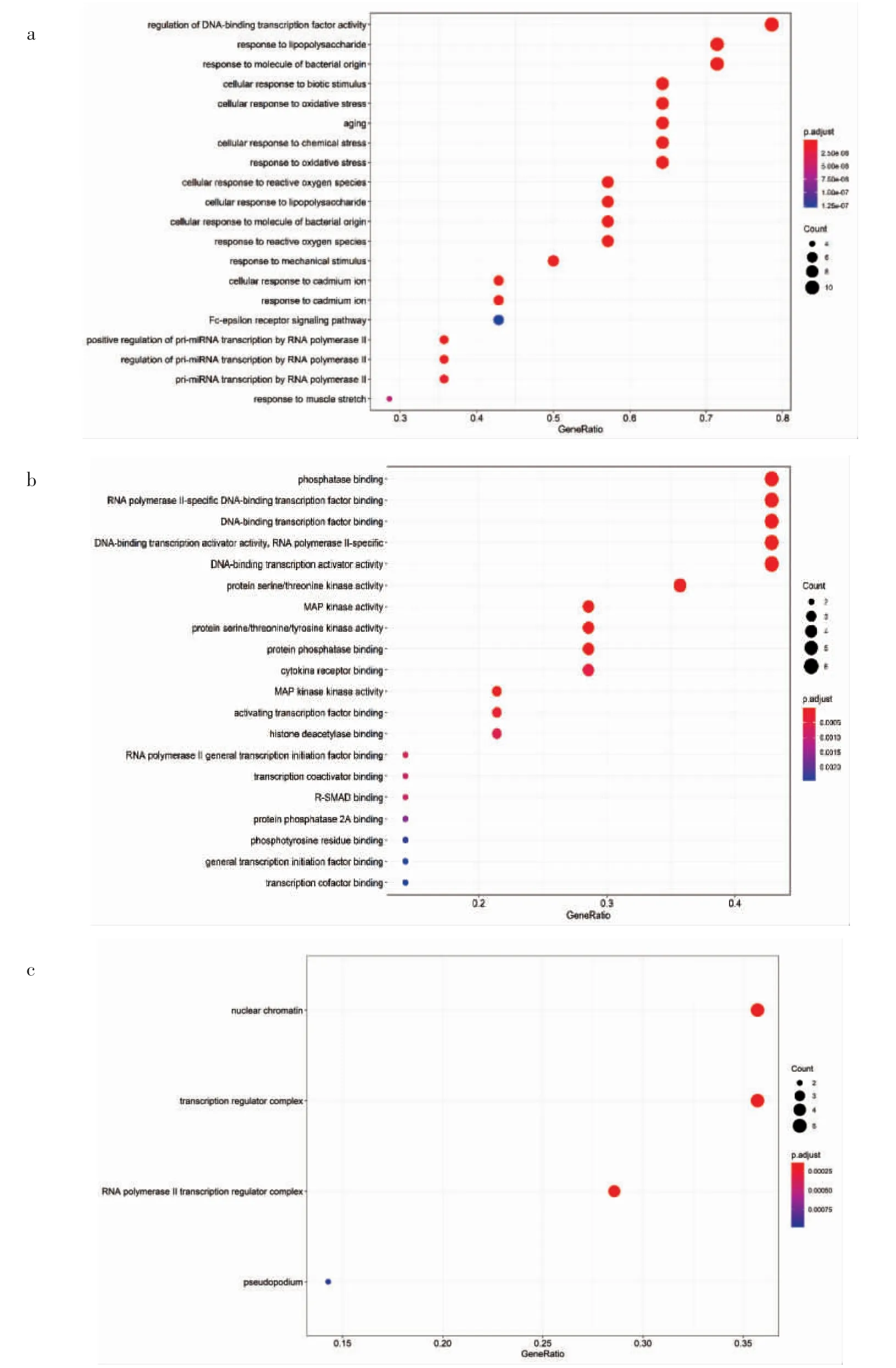
图5 14 个核心靶点GO 富集分析
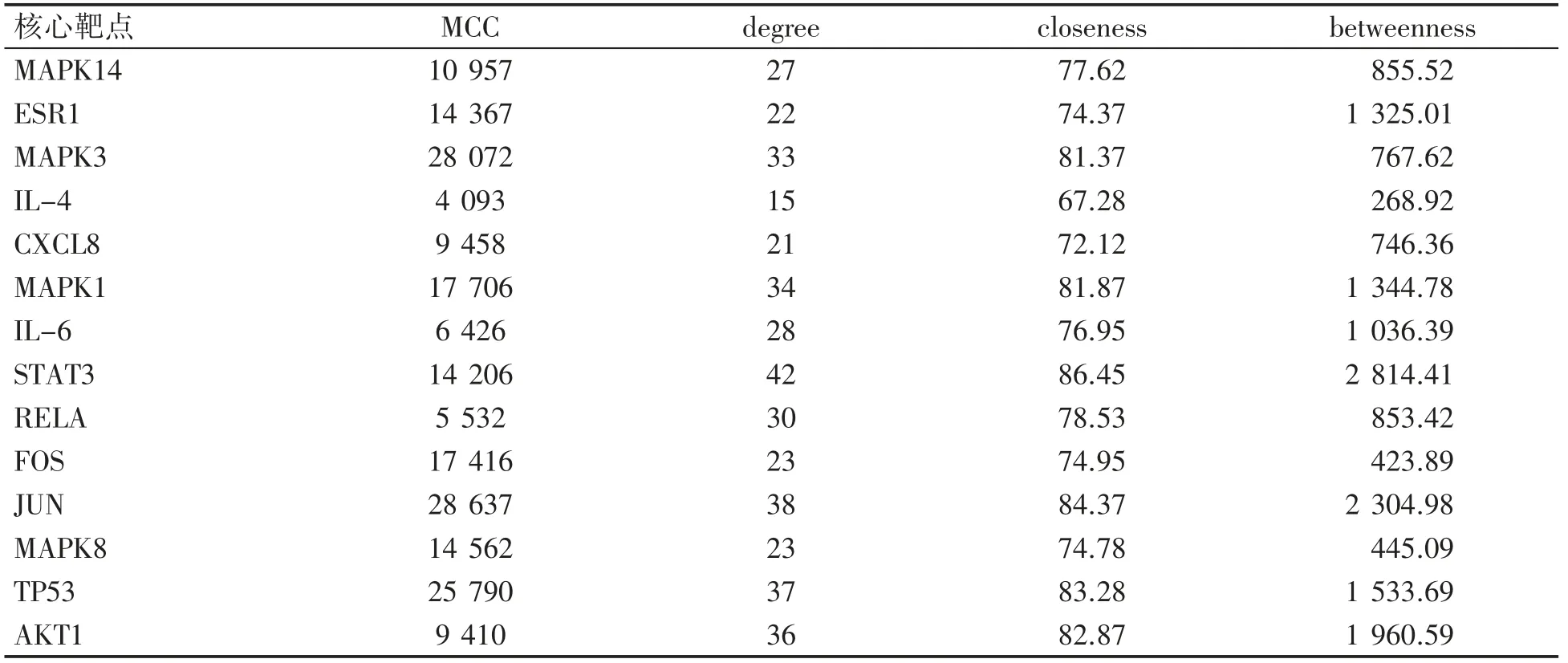
表2 核心靶点详细信息
2.6 分子对接
本研究选取9 个核心成分(除7-甲氧基-2-甲基异黄酮外)与核心靶点相关通路中的关键蛋白进行分子对接。通过查阅文献与富集分析结果,选取NOD1(PDB 编号: 2nz7)、TLR4(PDB 编号: 5nao)、IL-17RA(PDB 编号: 4nux)、IL-17(PDB编号: 4hr9)与核心成分对接。以核心成分和关键蛋白对接得到的结合能作热图,见表3。若最低结合能≤-5.0 kcal·mol-1,即表明核心成分与核心靶点对接效果良好,结合能越低,表明分子与蛋白结合越佳。对接热图结果显示,9 个核心成分与NOD1、IL-17RA、IL-17 均能较好地对接,其中9 个核心成分与IL-17 对接最佳;TLR4 与槲皮素、山柰酚、川陈皮素能较好对接。选取结合能绝对值最大的前6 个对接姿势进行可视化,见图6。
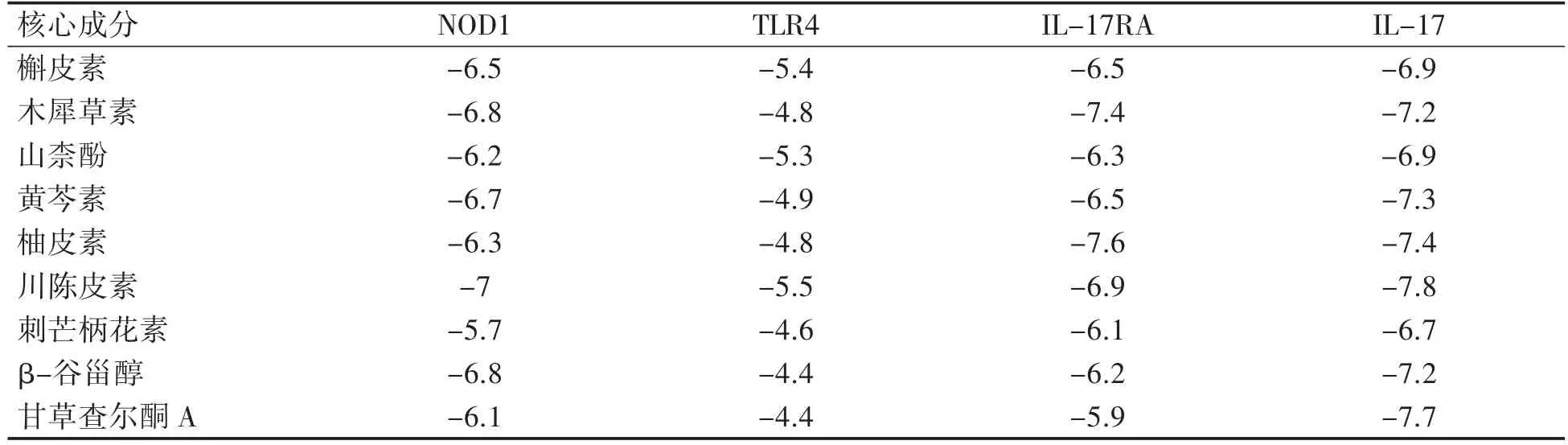
表3 核心成分和核心靶点分子结合能热图(kcal·mol-1)
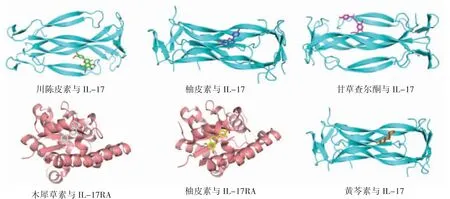
图6 6 个结合能绝对值较大的对接姿势
3 讨论
3.1 芎归六君子汤有效成分
基于TCMSP 数据库,本研究得到芎归六君子汤有效成分154 个,进一步通过对“中药-有效成分-靶点”网络分析得到槲皮素、木犀草素、山柰酚、7-甲氧基-2-甲基异黄酮、黄芩素、柚皮素、川陈皮素、刺芒柄花素、β-谷甾醇、甘草查尔酮A 10 个核心有效成分。研究中得到核心成分槲皮素、木犀草素、山柰酚代表性较低,可能与它们广泛存在于中草药中有关,且国内外对其开展的研究较多,对以上成分认识较深,故而得到较多的已知作用靶点。除β-谷甾醇外,其余9 个核心有效成分皆属黄酮类,其广泛存在于植物与中草药中,皆有抗炎作用[6]。槲皮素可通过降低转化生长因子-β1(TGF-β1)、肿瘤坏死因子-α(TNF-α)和α 平滑肌肌动蛋白(α-SMA)活性来降低细胞炎症因子释放及抑制细胞凋亡,降低COPD 大鼠肺组织炎症和纤维化损伤[7]。有研究[8-10]发现,以木犀草素为主要成分的膏片可降低COPD 患者TNFα、IL-6、IL-12 水平,改善肺通气功能。山柰酚可抑制TLR4 受体[11],抗氧化应激反应[12],抑制炎症因子IL-6、IL-1β、IL-8、TNF-α 释放[13],抑制由TLR4/MyD88 介导的核因子(NF)-κB 与MAPK信号通路激活而引起的肺损伤[14];分子对接结果也提示,山柰酚与TLR4、IL-17、IL-17RA、NOD1 能良好地对接。黄芩素可通过抑制硫氧还蛋白系统来抑制NF-κB 依赖性的炎性反应[15]。甘草与陈皮中的柚皮素可通过下调促炎性因子、超氧化物歧化酶(SOD)保护大鼠胃黏膜[16]。检索知网与PubMed未见川陈皮素、刺芒柄花素关于COPD 的专题研究,但有研究[17]显示,川陈皮素在前列腺癌细胞中可下调TLR4 和TLR9 依赖信号通路。法半夏与当归中的β-谷甾醇可以缓解中性粒细胞的趋化作用,从而延缓肺损伤的发展[18-19]。甘草中的甘草查尔酮A 能降低吸烟诱导急性肺损伤小鼠肺内炎性细胞数量及浸润程度,这可能是通过阻断ERK1/2/NF-κB 途径来抑制TNF-α、IL-8等炎性介质的高表达、调节氧化/抗氧化失衡、下调MMP-9 的表达[20]。
除上述核心有效成分外,一些药对及中药成分也在治疗COPD 中发挥重要作用。在烟熏加滴脂多糖COPD 大鼠模型中,川芎-当归药对通过降低大鼠TGF-β1、血管内皮生长因子(VEGF)的含量,调节MMP-9/TIMP-1 的平衡,抑制成纤维细胞与内皮细胞的过度增生,延缓或阻止COPD气道重塑[21];甘草混悬液可减轻猪胰蛋白酶和脂多糖滴注COPD 小鼠模型的肺组织病理学改变,降低细支气管黏膜损害,减少肺泡扩张[22]。党参多糖能抑制TNF-α、IL-6 等炎症因子的生成与释放,具有一定的抗炎活性[23];白术内酯Ⅲ能抑制LPS 诱导的小鼠巨噬细胞的炎性反应,其机制可能与抑制NF-κB和MAPK 信号通路,进而抑制NO、前列腺素E2(PGE2)、TNF-α 和IL-6 的释放有关[24]。持续的炎性细胞及多种炎症因子刺激,会使气道黏膜下的腺体增生,并伴有杯状细胞增生,从而表现为黏液的量和黏稠度明显增加。综上,本研究涉及的成分可为芎归六君子汤“多成分、多靶点、多通路”治疗COPD 提供物质基础,其可能通过抑制炎性因子的水平及趋化作用,从而抑制气道黏液高分泌状态,延缓肺损伤,最终延缓COPD 患者的病情进展。
3.2 生物学富集分析
本研究基于对PPI 网络的进一步分析得到核心靶点,利用核心靶点进行生物学富集分析得到与COPD 病情进展密切相关的通路。
模式识别受体(pattern-recognition receptors,PRRs)能感知感染、无菌性组织损害、宿主细胞与组织的完整性,其包括NOD 样受体(nucleotidebinding oligomerization domain-like receptors,NLRs)与TOLL 样受体(Toll-like receptors,TLRs)[25]。NOD1 与NOD2 是NLRs 中的两个关键蛋白;NOD1和NOD2 引发的受体识别通过Rips2 激酶引起下游MAPK 和转录因子NF-κB 的激活,致使编码趋化因子、不同的促炎性细胞因子(包括IL-1β、TNF-α、IL-8、IL-6)基因激活,最终导致不同程度的慢性炎症浸润,促使气道重塑[26]。NLRs 是一类重要的1 型跨膜受体蛋白,负责识别与病原体有关的分子模式;NLRs 的病原体识别通过促炎症因子的产生和协同刺激分子的上调能快速引起先天免疫应答[27]。TLR4 是NLRs 中的一种,TLR4在重度与极重度COPD 患者中表达升高,且与CD4+、CD8+T 细胞数、气道阻塞程度、铜绿假单胞菌载量呈正相关,揭示其在COPD 进展中可能起关键作用[28]。另外,TLR4 可导致气道黏蛋白基因Muc5ac mRNA 的高表达和黏蛋白Muc5ac 的高分泌,抑制肺组织TLR4 mRNA及其蛋白的表达,从而有效缓解气道炎症和气道黏液高分泌[29]。气道黏液高分泌是COPD 的重要生理病理特征[30],其与TNF-α 介导的信号通路、IL-1β/COX-2信号通路密切相关[31]。COPD 急性加重以革兰阴性菌感染为主,病原菌以铜绿假单胞菌、肺炎克雷伯菌、不动杆菌、流感嗜血杆菌为主[32]。结合以上研究,可推测COPD 患者感染铜绿假单胞菌后,促使TLR4 的表达升高,导致下游的炎症因子合成与释放,加重气道阻塞和气道高分泌状态,从而促使患者病情恶化。TLR4 在COPD进展中的关键作用,使其有望成为COPD 治疗的潜在靶点。
在COPD 患者中,TLR2 水平在单核细胞中显著升高,并且与年龄、痰液中性粒细胞数、金属基质蛋白MMP-9 水平有关[33],而中性粒细胞被认为在COPD 发病过程中起到重要作用,其能通过释放弹性蛋白酶介导肺组织的破坏[34]。此外,中性粒细胞百分比也与COPD 患者炎性程度及炎症因子水平呈正相关[35]。IL-17 信号通路也在COPD发病过程中起重要作用。在COPD 进展初期,IL-17A 的升高可导致慢性炎症、气道阻塞、肺气肿[36]。IL-17A 是IL-17 家族中的一员,其与表达在肺支气管上皮细胞的IL-17 受体(IL-17RA)结合,引起粒细胞集落因子、中性粒细胞趋化因子CXCL8、IL-6 的分泌[37]。已有研究报道,阻止老鼠模型中IL-17A 的生成可以在不削弱控制细菌感染的能力下,减少肺损伤[38]。这提示芎归六君子汤可通过调控IL-17 信号通路或对IL-17A、IL-17RA 的抑制,抑制炎性因子的趋化,起到缓解肺损伤的作用。分子对接实验也表明芎归六君子汤中的核心有效成分可以有效地与IL-17A、IL-17RA 结合。在GO 生物过程中,MAP 激酶活性、激活转录因子结合、细胞因子受体结合、细胞因子活性、趋化因子受体结合也皆可反映在以上讨论的通路中。结合以上分析,芎归六君子汤可能通过调控NOD 样受体信号通路、TLRs 信号通路、IL-17 信号通路关键通路从而抑制促炎性因子及炎症因子形成、炎症因子趋化作用、缓解气道黏液高分泌状态,延缓肺损伤及气道阻塞程度等途径,起到治疗COPD 的作用。
综上所述,芎归六君子汤通过多成分、多靶点、多通路之间的相互作用,从而起到治疗COPD的作用,体现了中药复方在治疗疾病上的整体观特点。基于网络药理学与分子对接相结合的技术可初步探讨芎归六君子汤治疗COPD 的作用机制,然而具体机制尚需更完善的实验予以支撑,本研究旨在为进一步深入探究其作用机制及实验设计思路奠定基础。
