复合亚氯酸钠泡腾胶囊的制备及质量研究
2023-01-11林翠董静文王田田
林翠,董静文,王田田
(河北科技大学化学与制药工程学院,河北 石家庄 050018)
0 引言
亚氯酸钠与酸性活化剂作用得到的有效成分二氧化氯,是国际上公认的高效、安全、广谱的强力杀菌剂,可以杀灭一切微生物。奶牛子宫内膜炎在奶牛养殖生产期间属常见多发病之一,是导致奶牛不孕的主要原因,使奶牛生产性能大幅度降低,造成严重的经济损失。目前出现的治疗药物很多,可通过注射、口服和局部给药等方式对患病奶牛进行治疗,但注射、口服给药后药物全身分布,局部药物浓度不高,疗效不理想。
而复合亚氯酸钠泡腾胶囊通过局部给药,有效提高生物利用度,胶囊外壳与奶牛体内积液溶解完成后,泡腾颗粒将会在子宫内生成泡沫和二氧化氯气体,泡腾所产生的泡沫有助于药物与子宫粘膜褶皱的充分接触,达到局部杀菌、抗炎的作用,治疗效果显著。较泡腾片相比,胶囊壳溶解后能够增加药物与子宫粘膜的接触面积,避免局部药物浓度过高,减少对子宫粘膜的刺激,具有发泡迅速、药物释放迅速、刺激性小等优点。
本实验对复合亚氯酸钠泡腾胶囊的处方制备和质量控制进行研究,为其今后的应用提供理论依据。
1 实验仪器及材料
1.1 实验仪器
电子天平,AL204 型,瑞士梅特勒托利多公司生产。
胶囊填充板,SD100K 型,义乌市楷旭进出口有限公司生产。
干法制粒机,GL1-25 型,张家港市开创机械制造有限公司生产。
智能崩解仪,JB-II 型,天津市鑫洲科技有限公司生产。
高压蒸汽灭菌器,KT-S770 型,厦门科立泰精密仪器有限公司生产。
电热恒温培养箱,DNP-9052 型,上海精其仪器有限公司生产。
1.2 实验材料
亚氯酸钠、酒石酸、无水四硼酸钠、十二烷基硫酸钠、碳酸氢钠、甲基纤维素、硬脂酸镁、无水硫酸镁,分析纯,天津市大茂化学试剂有限公司生产。
大肠杆菌(ATCC 8099)、金黄色葡萄球菌(ACTT 6538),生物试剂,北京保藏生物科技有限公司生产。
健康成年新西兰兔8 只,雌雄各半,体质量1.7~2.5 kg,望都县彤辉养殖公司提供,动物合格证号:210905。
2 实验部分
处方确定泡腾胶囊的主要赋形剂为酸源、碱源构成的泡腾剂及表面活性剂组成的稳泡剂。以ClO2含量、崩解时限为评价指标设计L9(34) 正交试验。经方差分析泡腾胶囊最佳处方为A2B1C3,即复合亚氯酸钠泡腾胶囊处方为(每100 粒) 亚氯酸钠9.0 g、酒石酸20.5 g、无水四硼酸钠2.5 g、十二烷基硫酸钠2.5 g、碳酸氢钠7.0 g、甲基纤维素2.0 g、硬脂酸镁0.5 g、无水硫酸镁6.0 g。本试验的应用浓度定为100 mg/L,处方量为4 粒。正交试验因素水平表见表1。

表1 正交试验因素水平表Table 1 Factor level of orthogonal test
3 结果与讨论
3.1 质量研究
3.1.1 性状
外观整洁,无黏连、变形、渗漏、囊壳破裂现象。
3.1.2 发泡量
取具塞刻度试管,加蒸馏水2.0 mL,于37 ℃水浴中5 min,各管中分别投入泡腾胶囊1 粒,20 min 内泡腾过程中最大发泡体积均在16.0~18.0 mL,符合2020年版中国兽药典规定。
3.1.3 崩解时限
抽取泡腾胶囊6 粒,于装有200 mL 加热至20 ℃蒸馏水的烧杯中进行崩解时限检测,泡腾胶囊均在15 min 内崩解完成,符合2020年版中国兽药典规定。
3.1.4 水分
称取泡腾颗粒5 g,平铺于干燥恒重的扁形称量瓶中,在105 ℃下干燥5 h 后移置干燥器中,冷却后精密称定,再在上述温度下干燥1 h,放冷,称重,直至连续2 次称重差异不超过5 mg 为止。三批泡腾胶囊的含水量均小于4.0%,符合要求。
3.1.5 流动性
测量泡腾颗粒休止角以确定其流动性。试验重复3 次,取其平均值,测定结果均<40 ℃,该泡腾颗粒流动性良好。
3.1.6 含量测定
随机抽取泡腾胶囊4 粒,分别放于装有37 ℃蒸馏水的棕色广口瓶中,待溶解完成后,按照五步碘量法对溶液中二氧化氯含量进行测定。样品溶液中二氧化氯含量均在(100±2) mg/L 范围内,二氧化氯含量准确,符合要求。
3.2 体外杀菌性能研究
本试验选用革兰氏阴性代表菌大肠杆菌和阳性代表菌金黄色葡萄球菌进行体外杀菌性能研究。
随机抽三批取样品胶囊,使用无菌硬水配制试验所需浓度的样品溶液,置20 ℃水浴保温备用。移取试验用菌悬液和有机干扰物各0.5 mL 于无菌试管中,再加入4.0 mL 样品溶液,待两者作用至预定时间,吸取0.5 mL 混合液于装有4.5 mL 中和剂的无菌试管中,计时10 min,取1.0 mL 样液接种于平皿上,同时用稀释液代替样品溶液进行平行试验,作为阳性对照。由表2可以看出,当样品溶液浓度为100 mg/L 时,对大肠杆菌和金黄色葡萄球菌作用3 min 后杀灭对数值均大于5.00,杀菌性能良好。悬液定量杀菌试验结果见表2。

表2 悬液定量杀菌试验结果Table 2 Suspension quantitative germicidal test results
3.3 安全性能研究
3.3.1 完整皮肤刺激试验
准备4 只健康的新西兰兔,在试验前24 h,对其背部两侧进行脱毛,去毛范围约3 cm ×3 cm。24 h 后将泡腾胶囊溶解为实际应用浓度5 倍的溶液,直接滴于兔子一侧的去毛皮肤上,另一侧滴加生理盐水作为空白对照。4 h 后,用温水对兔子皮肤进行冲洗,于1、24 和48 h 观察皮肤局部反应。结果表明,兔子背部两侧皮肤均未出现红斑和水肿现象,该泡腾胶囊对兔子皮肤无刺激性,安全性能良好,完整皮肤刺激试验结果如图1所示。
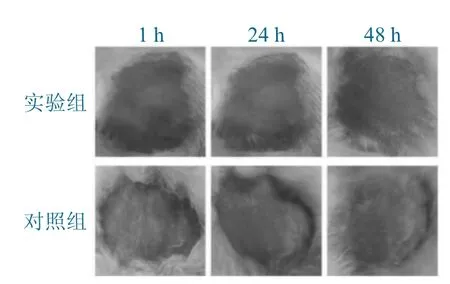
图1 完整皮肤刺激试验结果Fig.1 Results of a complete skin irritation test
3.3.2 破损皮肤刺激试验
准备4 只健康的新西兰兔,同上述操作方式进行去毛处理,24 h 后,使用75%酒精对兔子皮肤进行消毒,并用灭菌刀片在去皮区内划一个“井”形破损伤口,在该破损皮肤区内滴加相同浓度的样品溶液。另一侧滴加生理盐水作为空白对照。4 h后用温水对兔子皮肤进行冲洗,于1、24 和48 h观察皮肤局部反应。结果表明,兔子背部两侧伤口均未出现红斑和水肿现象,该泡腾胶囊对兔子皮肤无刺激性,安全性能良好,破损皮肤刺激试验结果如图2所示。

图2 破损皮肤刺激试验结果Fig.2 Results of a damaged skin irritation test
3.4 稳定性试验
3.4.1 影响因素试验
取除去外包装的样品胶囊若干粒,置于开口棕色广口瓶内,在高温(60 ℃)、高湿(25 ℃、RH 75%)、强光(4 500 lx) 环境中放置10 d,分别于第0 d、第5 d、第10 d 进行取样,对稳定性考察项目进行检测。影响因素试验结果见表3。
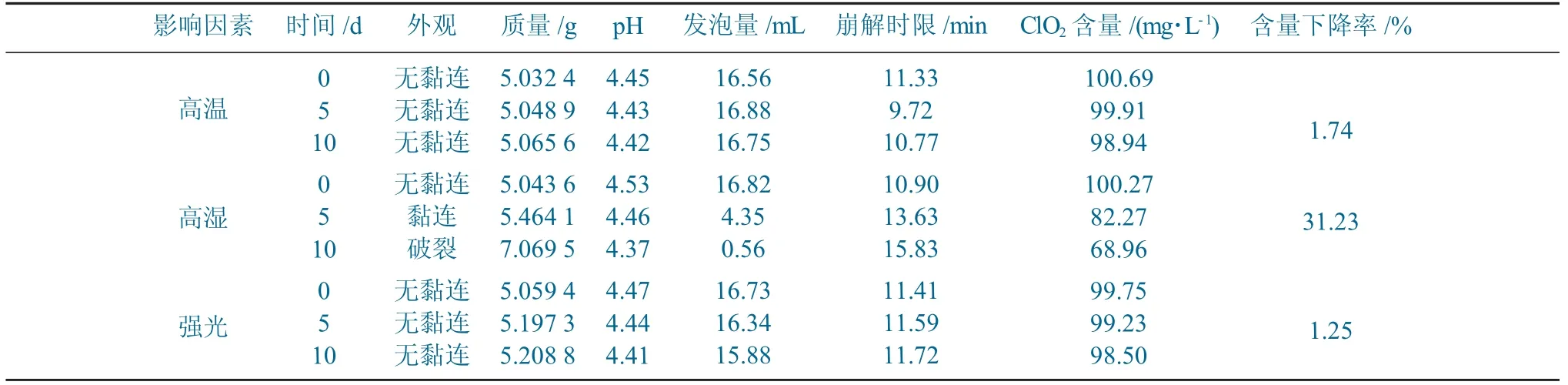
表3 影响因素试验结果Table 3 Test results of influencing factors
由表3可以看出,在高温、强光照射环境下各项试验指标基本不变,在高湿环境下胶囊外壳发生破裂现象,泡腾颗粒吸湿增重较大,二氧化氯含量下降率为31.23%。因此说明高湿环境对样品胶囊影响较大,应使用密封防潮包装。
3.4.2 加速试验
取3 批市售包装的样品胶囊,置于温度40 ℃、RH 75%的恒温恒湿箱中6 个月,分别于第1、2、3 和6 个月取样对稳定性考察项目进行检测。加速试验结果见表4。
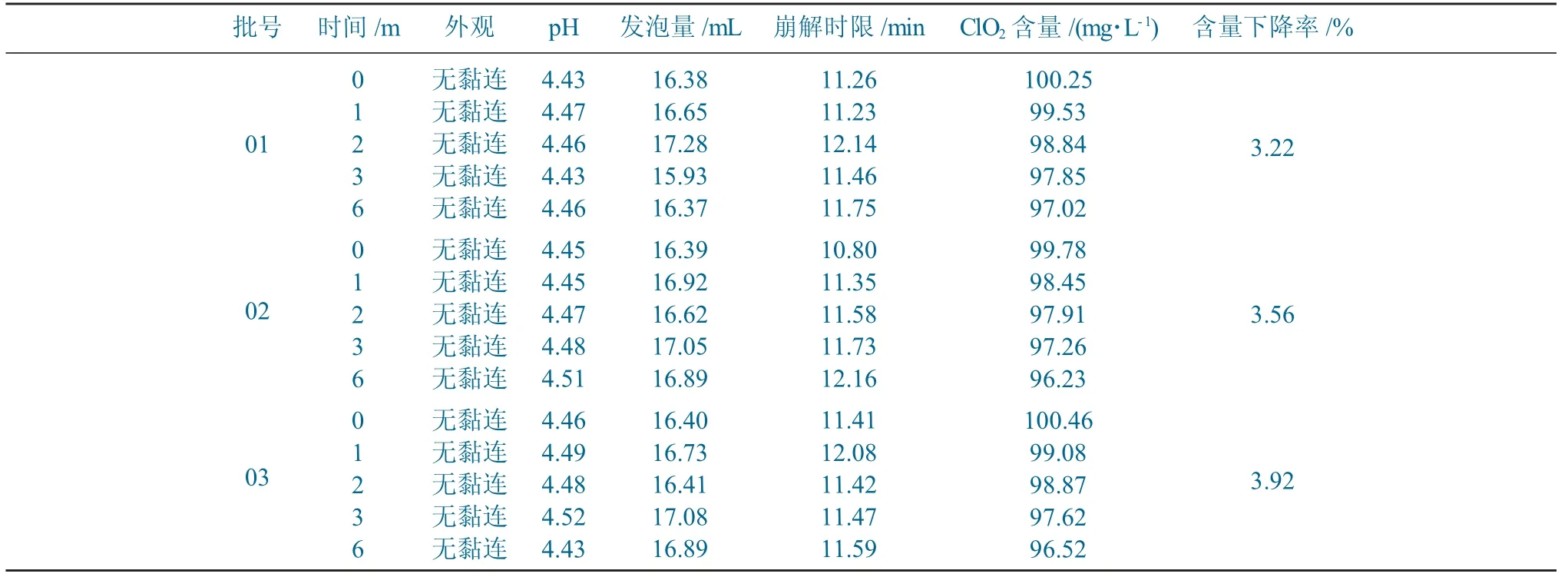
表4 加速试验结果Table 4 Accelerated test results
由表4可以看出,其外观、pH 值、发泡量、崩解时限和二氧化氯含量均发生了变化,但各项试验指标均在2020年版中国兽药典规定的范围内,因此说明该样品胶囊在加速条件下性质稳定。
3.4.3 长期试验
取3 批市售包装的样品胶囊,置于温度25 ℃、RH 60%的恒温恒湿箱中12 个月,分别于第0 个月、3 个月、6 个月、9 个月、12 个月取样检测。由表5可以看出,其外观、pH、发泡量、崩解时限等试验指标均无明显变化,二氧化氯含量下降率均小于4.00%,由此可知,各项试验指标均在2020年版中国兽药典规定的范围内,因此说明该样品胶囊在12 个月内性质稳定。长期试验结果见表5。

表5 长期试验结果Table 5 Long-term test results
4 结语
(1) 本实验的处方设计安全合理,制备工艺简单、稳定、成本低廉,泡腾胶囊质量研究结果表明,各项指标均符合2020年版中国兽药典规定。
(2) 体外杀菌性能研究结果表明,复合亚氯酸钠泡腾胶囊溶液浓度为100 mg/L 时,对大肠杆菌和金黄色葡萄球菌作用3 min 后杀灭对数值均大于5.00,该样品胶囊的体外杀菌性能良好。
(3) 安全性能研究结果表明,在给药48 h内,新西兰兔背部两侧皮肤均未出现红斑和水肿现象,该样品胶囊的安全性能性能良好。
(4) 稳定性试验结果表明,温度和光照对样品胶囊稳定性考察指标基本无影响,湿度影响较大;样品胶囊在12 个月内质量稳定,市售包装对药品质量无影响。
