微量法和倾注接种法对金黄色葡萄球菌计数的影响
2023-01-11楼津圻王媛蔡玲斐康艳华
楼津圻 王媛 蔡玲斐 康艳华
杭州师范大学,浙江 杭州 311121
急性肺损伤(acute lung injury,ALI)是一种临床常见的呼吸系统疾病,主要以肺水肿、肺上皮和内皮细胞损伤为病理特征[1]。细菌感染是造成ALI/急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)的主要诱因[2-3]。金黄色葡萄球菌,尤其是耐甲氧西林金黄色葡萄球菌(methicillin-resistant staphylococcus aureus,MRSA)感染引起的ALI由于缺乏有效的药物与干预措施,其死亡率居高不下,已成为危重症患者死亡的主要原因[4]。耐药菌感染是危重病领域面临的棘手难题,给临床抗感染治疗带来巨大挑战。近年来,从MRSA感染的致病机制和机体免疫防御角度探寻新的治疗靶标颇受关注,但其确切机制仍有待阐明。在研究过程中感染模型的构建、组织器官的细菌载量以及固有免疫细胞对细菌的吞噬杀伤功能的检测等都是影响实验结果稳定、可靠的关键环节。而准确的细菌定量在此环节中起着决定性作用。
细菌定量主要通过测定活菌数来实现。目前国内外使用较为普遍的活菌计数方法是平板菌落计数法,然而该方法在实际操作过程以及结果统计方面存在着很大争议。国内学者不断的探索新方法、新策略来排除各种影响及干扰因素,比如改进试验样本的稀释方式、菌种的繁殖方式、接种方式以及计数方法等[5-9]。本研究采用倾注法和微量法培养细菌,比较两种不同接种方式对活菌总量的影响;同时应用可见光分光光度计检测菌悬液的吸光度,探讨微量法接种培养的细菌总量与菌液吸光度之间关系,建立标准曲线,以便快捷稳定的计算细菌浓度,提高工作效率。
1 材料与方法
1.1 仪器与试剂 自控手提式压力蒸汽灭菌器、霉菌培养箱(上海博讯实业有限公司医疗设备厂);数显恒温浴锅(上海硕光电子科技有限公司);生物安全柜(Thermo公司);721型可见分光光度计(上海菁华科技有限公司);营养琼脂、营养肉汤培养基(杭州滨和微生物试剂有限公司);哥伦比亚血琼脂平板(杭州怡丹生物技术有限公司)。
1.2 菌种MRSA USA300菌株由杭州师范大学基础医学院免疫与病原生物系实验室分离并保存。
1.3 菌种复苏与培养 取出-80℃冰箱中保存的MRSA USA300菌株甘油管,冰上自然溶解,挑取少量菌液划线接种于血琼脂平板上,37℃恒温培养箱培养过夜。次日挑取具有透明溶血环的单克隆菌落再次接种血琼脂平板上,37℃恒温培养箱培养18~24h后,备用。
1.4 菌悬液的配制 刮取血平板上的菌苔置于10mL无菌生理盐水中,吹打混匀配成菌悬液。
1.5 细菌的接种与计数
1.5.1 倾注平板接种法。在试管中将菌悬液进行10倍系列稀释。取稀释度为10-5、10-6、10-7、10-8的菌液各1mL接种于无菌培养皿中,将10mL冷却至45℃左右的普通琼脂培养基倒于已加入菌液的培养皿中,并轻轻转动使其与菌液均匀混合,待凝固后置37℃培养18~24h后,观察菌落生长状态,拍照并用ImageJ软件对平板上的菌落进行计数[10]。见图1。每个稀释度接种3个平板,并计算同一稀释度的平均菌落数。
图1 ImageJ软件统计菌落数目的示意图
1.5.2 微量滴注接种法。使用96孔板将原液进行10倍系列稀释。取同样稀释度的菌液各0.01mL滴注于普通琼脂平板表面,每个梯度点种3个重复,待菌液被完全吸收后,倒置放于37℃培养箱中培养18~24h。次日,观察平板上的菌落生长状态,并采用传统的人工计数。
1.6 微量滴注接种培养平板计数法与菌悬液吸光度值之间的相关性 取稀释度为10-6的菌悬液作1∶1、1∶2、1∶3、1∶4、1∶5稀释,以无菌生理盐水作对照,分光光度计测定波长600nm处的吸光度(OD600)值,同时取0.01mL菌悬液采用滴注接种培养法进行平板计数,每个稀释度做3个重复。记录OD600值,稀释倍数和相应菌落数,并建立金黄色葡萄球菌菌悬液与吸光度值间的线性关系。
1.7 统计学处理 采用GraphPad Prism 7软件,数据以均数±标准差()表示,通过Ordinary one-way ANOVA进行组内分析,P<0.05为差异有统计学意义。
2 结果
2.1 两种接种方法菌落特征的比较 培养相同时间后,倾注法接种培养的平板上菌落大小不一,位于琼脂深层的菌落小且形态不规则,琼脂表层的菌落大小一致,呈圆形凸起且色素明显;菌落分布不均匀,部分菌落生长在培养基边缘的深层(图2A)。相比之下,微量法接种培养的平板上菌落大小一致,呈金黄色的圆形凸起且均匀分布于接种区域的琼脂表面(图2B)。

图2 两种接种方法培养细菌菌落形态
2.2 两种接种方法培养细菌总数的比较 细菌总数的计算公式分别按:N×稀释倍数(倾注法)和N×稀释倍数×100(微量法)计算,N为菌落个数。结果表明,随着稀释倍数的增加,两种接种方法在10-6,10-7稀释度时所统计的菌落个数呈递减关系,10-8时的菌落数与10-7相比仅呈减少趋势。而从不同稀释度的细菌总数层面来讲,微量接种法三个不同稀释度所得的细菌总数在同一数量级,组内差异无统计学意义(P>0.05),倾注接种法记录的三个不同稀释度的细菌总数呈递减趋势且组内统计差异有统计学意义(P<0.05),提示与微量接种法相比,倾注接种法对细菌总数具有不稳定性,这可能与菌落形态形成有一定关系。见表1。

表1 不同接种方式培养的细菌总数
2.3 菌悬液在600nm处的吸光度值与活菌数量之间的相关性 用GraphPad Prism 7软件对获得的数据进行相关性分析,以微量法接种培养的计数结果为纵坐标(Y,×108cfu/mL),对应的菌液在600nm处的光密度值为横坐标(X),得出细菌浓度的线性回归方程为Y=7.996X+0.183,Pearson相关系数的平方为0.995,线性范围为0.233~6.433(×108cfu/mL)。见图3。
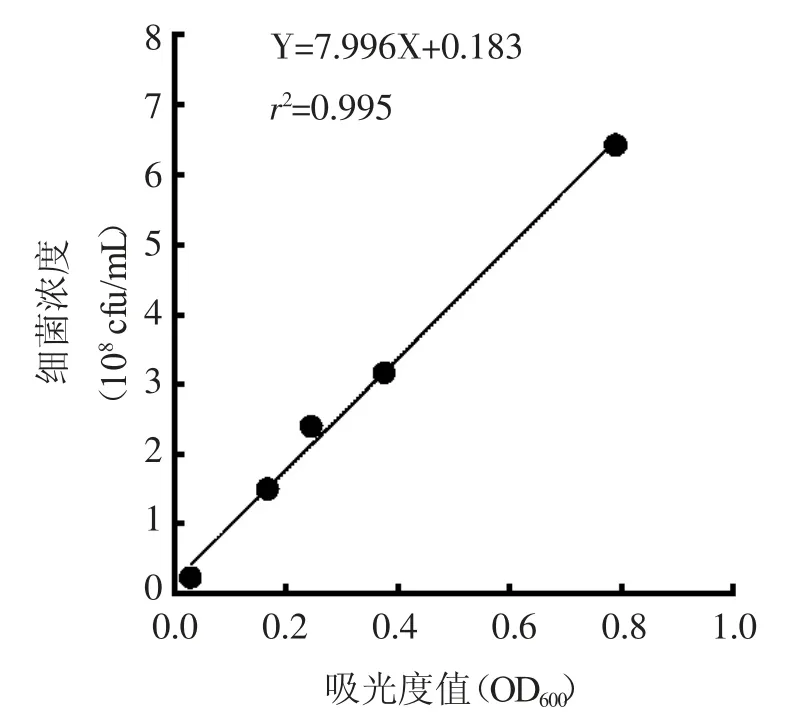
图3 MRSA浓度与OD600值的线性关系
3 讨论
近年来,MRSA引起院内感染日益增多,由于MR-SA 的广泛耐药性,其感染后的治疗问题已成为当前临床以及科学研究中的难题。在开展相关研究的实验(如造模时的攻毒剂量、感染模型中组织器官的细菌载量、固有免疫细胞中细菌的存活率等)中,需要进行准确细菌计数才能得到稳定和可靠的实验结果。目前,平板菌落计数是微生物实验教学、科研以及生产实践中最常用的活菌总数测定方法,然而计数结果的准确性与接种方法之间的关系一直备受关注[11-12]。此外,本实验以MRSA 为待测菌株,采用倾注法与微量法接种培养,从菌落形态、计数测定方式、计数准确性方面比较了两种方法的差异,并使用光密度法探讨了菌悬液的吸光度与细菌总量之间的相关性。
本研究对两种接种方法培养的菌落形态进行了比较。培养相同时间后,相比倾注法培养的菌落,微量法接种培养的菌落大小一致,形态均一,色素明显,极易判断是金黄色葡萄球菌。对于来源于肺泡灌洗液或肺组织匀浆液等标本,如果采用倾注接种法培养细菌,很难从形态上判断出感染细菌的类型,而微量滴注接种则具有显著的优势。
本研究对细菌总数进行了统计,结果表明微量法接种培养的细菌总数高于倾注法,尽管两者在同一数量级,但具有两倍的差异。在统计细菌总数时,借鉴并改进了黄晓辉等[10]报道的方法。不仅使数据来源更加科学、可信,而且节省大量的人力、物力与时间[9],拍照取样只能统计平板底部的菌落,忽略了平板边缘深层或深层与底部重叠的菌落,这可能是导致总数偏低的原因;另外,倾注法对琼脂培养基温度的控制是个难点,如果培养基温度过高会影响细菌的存活,这也是导致细菌总数偏低的另一原因,因此该方法对操作者的技术要求相对较高。微量法接种培养的细菌,由于菌落生长在琼脂的表面,在适当的稀释倍数下能清楚地数出菌落个数,菌落粘连程度不大,计数结果比较稳定,但是该接种方法对稀释比例要求较高,如果稀释倍数过低,会导致菌落粘连在一起,不易计数,如果稀释倍数过高,有可能长不出菌落。在试剂和耗材的消耗方面,微量法优于倾注接种法。一个琼脂平板上,微量法可以同时检测出6~9 个稀释梯度的菌落数,节省了大量的培养基和培养皿,减少了工作量,节省大量的时间,尤其是样本量较大时。
有不少研究者通过光电比色法、酶联免疫检测仪、紫外-可见光分光光度[13-16,17]测定法对菌悬液的光密度值与细菌的数量之间的关系进行了探讨,发现两者之间存在线性相关,然而这种相关性可能受细菌的种类、大小、色素等因素的影响。本研究结合微量法培养的细菌计数分析了MRSA 在OD600处的光密度值和活菌数量之间的线性关系。研究显示,菌悬液的光密度值与细菌总数之间呈良好的线性相关,相关系数平方值为0.995。由此,可以通过线性回归方程准确地进行细菌定量,提高实验的准确性和可重复性。
本研究通过分析两种不同的接种方法比较了对金黄色葡萄球菌活菌计数的差异。微量滴注法具有操作简便,省时省力、上样量少、节省实验耗材,且计数结果准确性高和重现性好等优势。同时可采用相应的回归方程精确地进行细菌定量,缩短实验周期,增加实验结果的稳定性和可靠性。
