核桃内种皮鞣花酸水解条件优化
2023-01-10赵鑫丹贾彩霞肖敏郝苑汝翟梅枝
赵鑫丹 贾彩霞 肖敏 郝苑汝 翟梅枝
(辽宁省旱地农林研究所,朝阳,122000)(西北农林科技大学)
核桃(JuglansregiaL.),又称胡桃、羌桃,胡桃科(Juglandaceae)核桃属(Juglans)落叶乔木。我国核桃种质资源丰富,种植范围极广,黑龙江、辽宁、湖北、陕西、云南、四川等22省市均有分布[1]。核桃营养价值丰富,含油率在60%~70%,其中油酸、亚油酸、亚麻酸等不饱和脂肪酸占90%以上,其次是蛋白质和碳水化合物,含量分别在15%和10%以上[2]。核桃具有多种生物活性,如抗氧化、抗肿瘤、抑菌、抗炎、降脂、降血糖等,其抗氧化活性尤为突出,素有“抗氧化之王”之称[3]。已有研究表明,核桃仁中90%抗氧化活性物质都来源于核桃内种皮[4]。Angeli et al.[5]研究发现核桃内种皮提取物可以清除自由基,对超氧阴离子及DPPH自由基清除能力半抑制质量浓度分别为80和48.35 mg/L。张泽生等[6]研究发现核桃内种皮提取物可以减轻D-半乳糖致衰小鼠的氧化损伤,显著提高小鼠血清、肝脏和脑组织中超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶活力和总抗氧化能力,并降低丙二醛质量摩尔浓度。研究发现,核桃内种皮抗氧化活性物质主要为鞣花酸[7]。
鞣花酸,化学式为C14H6O8,是一种天然多酚,没食子酸的二聚衍生物。鞣花酸最早于1818年被法国化学家亨利·布拉科诺从五倍子中发现。鞣花酸抗氧化活性极强,还具有抗癌变、抗菌、抗肿瘤等生物活性[8]。肖玉欣等[9]发现鞣花酸可以抑制脂质过氧化,并可以通过调控线粒体功能发挥抗氧化活性。孙勋[10]研究发现鞣花酸可以抑制小鼠突触丢失、神经元凋亡及氧化应激水平,表明鞣花酸是一种较好的具有亨廷顿舞蹈病治疗潜力的天然化合物。鞣花酸有游离和缩合两种形式,自然界中鞣花酸大部分以缩合形式存在,游离鞣花酸含量极少[11],经加酸处理可使缩合态鞣花酸水解出来[12],但核桃内种皮鞣花酸的酸水解工艺未见报导。课题组前期研究初步显示,核桃内种皮醇提物的不同极性萃取物抗氧化活性不同,但以乙酸乙酯萃取物(EAE)抗氧化活性较好。在此基础上,本研究拟利用HPLC法测定EAE中鞣花酸含量,通过酸水解下的单因素筛选和正交试验,优化酸水解提高鞣花酸得率的提取工艺,为核桃内种皮资源的高效开发利用提供理论依据。
1 材料与方法
试验材料:核桃采自西北农林科技大学山阳核桃试验示范站,选择‘香玲’、‘西林3号’等核桃良种采样。坚果挑选大小基本一致且无病虫害的果实,人工去青皮、去果壳、剥离内种皮,将内种皮阴干、粉碎,过60目筛,冰箱4 ℃保存备用。
所用试剂:色谱乙腈、色谱甲醇(安徽天地高纯溶剂有限公司)、色谱甲酸(天津市科密欧化学试剂有限公司)、均为色谱纯;三氟乙酸(上海阿拉丁生化科技股份有限公司)、盐酸、硫酸、醋酸、磷酸、石油醚、乙酸乙酯、正丁醇、无水乙醇(成都市科隆化学品有限公司)均为分析纯;鞣花酸(上海源叶生物科技有限公司)分析标准品。
所用仪器:LC-15C高效液相色谱仪(岛津企业管理中国有限公司);HH-2电热恒温水浴锅(北京科伟永兴仪器有限公司);YJ-2004高速中药粉碎机(济南亿健医疗设备有限公司);ME104E电子天平(梅特勒-托利多仪器上海有限公司)。
1.1 供试样品制备
称取核桃内种皮粉末10 g,加体积分数85%乙醇300 mL,53 ℃超声辅助提取55 min后过滤,收集上清液,残渣在相同条件下重复提取2次,合并3次上清液,减压浓缩得醇提物[13-14]。将醇提物用蒸馏水溶解,依次分别用1.5倍体积的石油醚、三氯甲烷、乙酸乙酯、正丁醇多次萃取至颜色很淡时,收集各萃取液,减压浓缩得浸膏,根据前期试验乙酸乙酯萃取物(EAE)抗氧化活性最强,故本试验选取EAE备用。
1.2 试验方法
EAE游离鞣花酸测定。准确称取0.05 g EAE样品,加入V(色谱甲醇)∶V(0.1%三氟乙酸)=4∶1溶液至50 mL;样液用0.22 μm滤膜过滤,取滤液上机分析[15]。HPLC的色谱条件:WondaSil C18色谱柱(4.6 mm×250.0 mm,5 μm),柱温30 ℃,进样体积20 μL,流速1.0 mL/min,检测波长254 nm,采用V(0.1%甲酸水溶液)∶V(乙腈)=80∶20等度洗脱[16]。
EAE酸水解后游离鞣花酸测定。准确称取0.05 g EAE样品,加入2 mol/L三氟乙酸溶液至50 mL,90 ℃水浴2 h,冷却后用色谱甲醇稀释10倍,0.22 μm滤膜过滤,取滤液上机分析[15]。HPLC色谱条件同上。
鞣花酸标准曲线绘制。准确称取10 mg鞣花酸标准品,加色谱甲醇至10 mL,得1 g/mL鞣花酸母液,用色谱甲醇将母液稀释至鞣花酸质量浓度分别25、50、100、200、300、400、500 mg/L,0.22 μm滤膜过滤,取滤液上机分析。HPLC色谱条件同上。以峰面积(y)为纵坐标,鞣花酸浓度(x)为横坐标,绘制标准曲线。得回归方程为:y=18.286x-350.52,R2=0.999 7。说明标准曲线回归性良好,可以用于定量分析。
精密度试验。取鞣花酸标准品溶液,按上述色谱条件,连续进样6次,测定峰面积,计算相对标准偏差。
重复性试验。精密称取6份EAE样品0.05 g,处理后按上述色谱条件进样,记录峰面积,计算相对标准偏差值。
稳定性试验。取处理后样品,按上述色谱条件,在第0、4、6、8、12、24 h进样,记录峰面积,计算相对标准偏差值。
加标回收率试验。精密称取6份EAE样品0.05 g,取处理后样品,分别加入等量鞣花酸标准品,按上述色谱条件进行测定,计算加标回收率。
不同酸对EAE水解后游离鞣花酸质量分数的影响。准确称取EAE样品0.5 g,分别加入2 mol/L三氟乙酸、盐酸、硫酸、醋酸、磷酸各50 mL,充分摇匀后放入水浴锅90 ℃水解2 h,通过HPLC测定不同酸水解后样品中游离鞣花酸质量分数。
水解时间对EAE水解后游离鞣花酸质量分数的影响。准确称取EAE样品0.5 g,加入2 mol/L三氟乙酸50 mL,充分摇匀后放入90 ℃水浴锅,分别水解1、2、3、4、5 h,采用HPLC法测定不同时间水解后样品中游离鞣花酸质量分数。
水解温度对EAE水解后游离鞣花酸质量分数的影响。准确称取EAE样品0.5 g,加入2 mol/L三氟乙酸50 mL,充分摇匀后分别放入水浴锅60、70、80、90、100 ℃水解2 h,采用HPLC测定样品不同温度水解后游离鞣花酸质量分数。
酸浓度对EAE水解后游离鞣花酸质量分数的影响。准确称取EAE样品0.5 g,分别加入1、2、3、4、5 mol/L三氟乙酸50 mL,充分摇匀后放入水浴锅90 ℃水解2 h,采用HPLC测定样品不同浓度酸水解后游离鞣花酸质量分数。
鞣花酸水解条件正交试验。在单因素试验的基础上,以水解后游离鞣花酸质量分数为考察指标,选取三氟乙酸浓度、水解温度和水解时间进行L9(34)正交优化试验,对水解内种皮EAE鞣花酸工艺进行优化,确定内种皮鞣花酸水解的最佳工艺条件。因素水平设计如表1所示。

表1 正交试验因素和水平
1.3 数据处理
测定设置3次重复试验,试验结果以(平均值±标准差)表示。采用SPSS 25.0软件进行统计分析,Duncan法进行显著性分析,Origin 9.1软件作图。
2 结果与分析
2.1 酸水解前后游离鞣花酸质量分数
按上述色谱条件得到鞣花酸标准品、EAE水解前后样品中游离鞣花酸质量分数色谱图(图1)。由图1(A)可知,鞣花酸色谱峰峰形良好,无杂峰干扰,基线平稳。根据峰面积及标准曲线计算游离鞣花酸质量分数,内种皮EAE酸水解前后游离鞣花酸分别为68.29、306.96 mg/g,水解后质量分数提高238.67 mg/g。这是由于加酸处理后样品中结合态鞣花酸发生水解,使得游离鞣花酸质量分数由6.83%升高至30.70%,水解后游离鞣花酸得率是水解之前的4.49倍。说明加酸水解后可提高内种皮游离鞣花酸质量分数。为更好地提高EAE水解后游离鞣花酸得率,对EAE鞣花酸水解条件进行工艺优化。

A、B、C分别代表鞣花酸标准品、EAE水解前后游离态鞣花酸质量分数的色谱图;峰1为鞣花酸。
经方法学考察发现,其精密度、重复性和稳定性试验相对标准偏差(n=6)分别为0.92%、1.14%、1.38%。加样回收率试验结果见表2,鞣花酸加样的平均回收率为98.18%,相对标准偏差为1.20%。这些都说明该方法下仪器精密度良好,方法准确、重复性好,供试样品溶液在24 h内稳定,此方法可用于核桃内种皮鞣花酸质量分数的定量测定与分析。

表2 加样回收率试验结果(n=6)
2.2 内种皮鞣花酸水解工艺条件优化
2.2.1 单因素试验
单因素对内种皮鞣花酸水解效果的影响见表3。由表3可知,在浓度为2 mol/L时,三氟乙酸水解后游离鞣花酸的质量分数高于其他酸处理(p<0.05)。三氟乙酸水解后游离鞣花酸质量分数达371.95 mg/g,醋酸水解后游离鞣花酸质量分数最低,为197.00 mg/g,仅为三氟乙酸水解后游离鞣花酸质量分数的52.96%。不同酸水解后游离鞣花酸质量分数由大到小依次为三氟乙酸、盐酸、硫酸、磷酸、醋酸。说明加入三氟乙酸水解可以使结合态鞣花酸较好地游离出来。因此,选取三氟乙酸为适宜的水解酸。不同浓度三氟乙酸处理对水解后游离鞣花酸质量分数的影响差异显著(p<0.05)。当酸浓度<4 mol/L时,水解后鞣花酸的质量分数随着酸浓度的增大而增加,酸浓度>4 mol/L鞣花酸质量分数呈下降趋势。表明在一定范围内提高酸浓度可以促进结合态鞣花酸的水解,但浓度过高会影响水解效果。因此选取4 mol/L三氟乙酸为适宜水解浓度。水解处理在1~3 h时,游离鞣花酸质量分数随水解时间的延长而呈显著上升趋势(p<0.05),水解1 h时游离鞣花酸质量分数为285.07 mg/g,水解3 h达到409.50 mg/g;当水解时间3~5 h时,游离鞣花酸质量分数稍有上升,差异不显著,水解5 h时质量分数为409.85 mg/g,仅比水解3 h增加0.35 mg/g。说明水解3 h时供试样品中结合态鞣花酸几乎水解完全,故选取3 h为适宜的水解时间。水解温度在60~80 ℃时,随着温度的升高,水解后游离鞣花酸质量分数稍有增加,差异不显著,80 ℃水解后游离鞣花酸质量分数为246.85 mg/g,仅比60 ℃水解后游离鞣花酸质量分数高10.75 mg/g;而当温度>80 ℃时,随着温度的升高游离鞣花酸质量分数呈显著上升趋势(p<0.05),100 ℃水解后游离鞣花酸质量分数达394.54 mg/g,比80 ℃时高出147.69 mg/g。说明温度升高有利于EAE中结合态鞣花酸的水解。因此选取100 ℃为适宜水解温度。

表3 单因素试验内种皮鞣花酸水解效果

注:表中数据为平均值±标准差;同组同列不同字母表示差异显著(p<0.05)。
综上,就水解酸种类、酸浓度、水解温度、水解时间对水解后游离鞣花酸质量分数的影响而言,选择4 mol/L三氟乙酸水溶液、水解温度100 ℃和水解3 h较好。
2.2.2 正交试验优化工艺条件
基于单因素试验,以三氟乙酸浓度、水解温度、水解时间进行的鞣花酸水解工艺条件正交优化,结果见表4。由表4可看出,正交试验极差(R)由大到小表现为A、B、C,表明各因素对内种皮鞣花酸水解的影响效果由大到小依次为三氟乙酸浓度、水解温度、水解时间。通过k值比较得到鞣花酸水解的最佳工艺条件为A1B2C3,即三氟乙酸浓度3.5 mol/L、水解温度95 ℃、水解时间3.5 h。
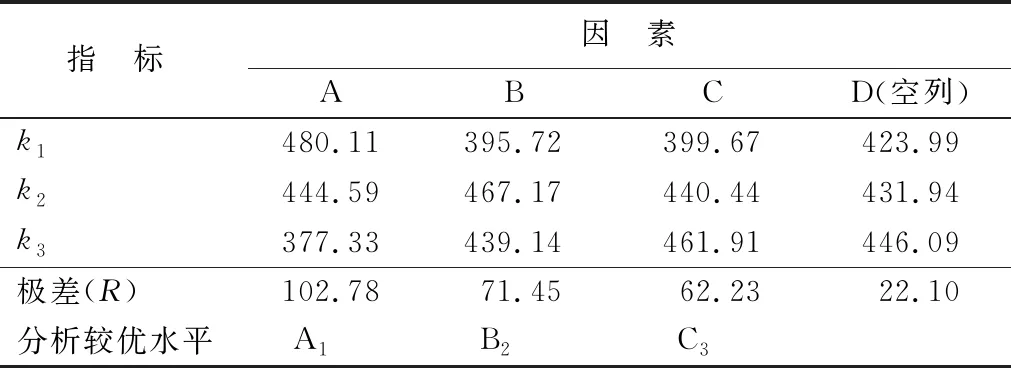
表4 正交试验结果
由极差进行直观分析,方便清晰,但无法确定是由因素水平变化引起试验结果不同,还是由误差导致的,因此对试验结果进行方差分析(表5)。结果显示,三氟乙酸浓度对鞣花酸水解影响显著(p<0.05),水解温度及时间影响不显著,这与极差分析结果一致。说明试验结果是由因素、水平变化不同所致,故A1B2C3为内种皮鞣花酸水解的最佳工艺条件。

表5 正交试验方差分析结果
2.3 试验结果验证
根据正交试验得出的最佳水解工艺条件为A1B2C3,即三氟乙酸浓度3.5 mol/L、水解温度95 ℃、水解时间3.5 h。正交试验的最优组合(A1B2C3)未在正交试验设计表内,因此对最佳工艺组合进行验证试验,在此条件下进行3次平行验证试验,结果见表6,其色谱图见图2。
表6可看出,在正交试验确定的最佳工艺组合下,3次重复试验的游离鞣花酸质量分数在562.08~599.18 mg/g,平均值为573.01±20.94 mg/g,高于正交试验结果中任一组合条件下鞣花酸质量分数,由此说明A1B2C3为核桃内种皮鞣花酸水解的最优工艺条件。由A1B2C3工艺条件下验证试验3的色谱图(图2)可见,鞣花酸是主峰,峰形良好,无杂峰干扰,其他物质峰面积远低于鞣花酸,说明该条件可作为内种皮鞣花酸的最优水解条件。

表6 验证试验结果

图2 优化组合A1B2C3工艺条件下鞣花酸HPLC色谱图
3 结论与讨论
本试验利用加酸方式水解内种皮中鞣花酸,在单因素试验的基础上,通过正交试验确定水解内种皮鞣花酸的最佳工艺条件为:三氟乙酸浓度3.5 mol/L、水解温度95 ℃、水解时间3.5 h,该条件下游离鞣花酸质量分数可达573.01 mg/g,是水解前游离鞣花酸质量分数(68.29 mg/g)的8.4倍。各因素对鞣花酸水解效果的影响由大到小为三氟乙酸浓度、水解温度、水解时间。
利用HPLC法测定核桃内种皮鞣花酸质量分数,结果发现,鞣花酸在测定范围内呈良好线性关系,平均加样回收率为98.18%,相对标准偏差为1.2%,其方法简单、重复性和稳定性均较好,该法可用于测定核桃内种皮中鞣花酸的质量分数。
鞣花酸作为一种天然多酚二内酯,广泛的分布在自然界中。自然界中多以结合态存在,游离的鞣花酸质量分数较低、提取率不高,采用溶剂提取法直接从植物中仅能提取出少量游离鞣花酸,而加酸水解后可大大提高鞣花酸产率[17]。加酸水解的原理是在酸性及加热条件下,结合态鞣花酸中的酯键或苷键易断裂,产生游离态鞣花酸[18]。杨媛等[15]研究发现利用溶剂提取法直接提取不同品种树莓中鞣花酸,其游离鞣花酸质量分数仅为3.86~11.83 mg/kg,而加酸水解后鞣花酸质量分数可达37.58~125.60 mg/kg。杨笑笑等[17]采用正交试验优化石榴皮中鞣花酸水解工艺,得到的最佳工艺条件为:水解时间6 h,水解温度100 ℃,浓硫酸浓度1.0 mol/L;各因素的影响效果由大到小为酸浓度、水解温度、水解时间,本试验得到结果与此一致,即酸浓度显著影响鞣花酸的水解效果。本研究发现相同条件下,内种皮乙酸乙酯萃取物中加入硫酸水解后游离鞣花酸质量分数为267.94 mg/g,而加入三氟乙酸水解后游离鞣花酸质量分数为371.95 mg/g,说明加三氟乙酸的水解效果优于加硫酸水解;从安全性而言,浓硫酸属中等毒性物质,而三氟乙酸只有轻微毒性,因此选择三氟乙酸作为水解酸来提高鞣花酸水解的安全性;从水解时间来看,本研究的最佳水解时间为3.5 h,相比前人对鞣花酸水解工艺条件的优化,提高了工作效率。
比较鞣花酸质量分数测定方法发现,紫外分光光度法耗用溶剂少、分析成本较低,但杂质干扰大,结果准确度不高[19];高效毛细管电泳法测量方法准确,但前处理复杂、耗时长且溶剂用量大[20];而高效液相色谱法(HPLC)操作简单、效率高、准确性好,是目前最常用的一种检测方法[12]。潘遐等[21]利用HPLC法测定藏药石榴莲花散中鞣花酸质量分数,结果发现鞣花酸的质量分数和峰面积在测定范围内线性关系良好,平均回收率98.2%,相对标准偏差2.8%,该方法简便、准确、重复性好,结果可靠,可用于测定石榴莲花散中鞣花酸质量。邹园生等[16]利用HPLC法测定猴枣中鞣花酸的质量分数,结果发现鞣花酸在0.049 5~989.4 mg/L呈良好线性关系,平均加样回收率为99.4%,相对标准偏差为1.2%,该方法简单,准确,重复性好,具有良好的稳定性,可用于猴枣药材中鞣花酸质量分数的分析测定。本研究利用HPLC法测定核桃内种皮鞣花酸的质量分数,其方法简单、重复性和稳定性均较好,结果可靠,说明该法可用于测定核桃内种皮中鞣花酸的质量分数。
