接种促生菌对金线莲生物活性成分及土壤细菌群落的影响
2023-01-10黄靖,陈婵
黄 靖, 陈 婵
(福建农业职业技术学院,福建福州 350119)
金线莲(Anoectochilusroxburghii)别称金线兰,广泛分布于中国、印度、尼泊尔、日本和越南等国,是一种罕见的多年生名贵中草药[1]。在我国,金线莲主要种植于福建、浙江、贵州和台湾等地区。现有研究表明,金线莲含有多种生物活性物质,包括黄酮类、多糖类、人参皂苷、类固醇、三萜、氨基酸及生物碱等[2],具有增强免疫力、防止肝损伤和氧化、降低血糖等药理作用[3]。由于金线莲药用价值极高,在医药制剂方面供不应求,且在市场需求日益增长的美容和饮品中也逐渐普及,目前已成为我国发展最为快速的中药材之一。
金线莲作为一种遮阴植物,对气候环境有着严格要求,其植株矮小、根系浅;因此,对各种生态资源的利用率均较低,且在栽培过程中常发生软腐病、茎腐病、灰霉病、难疫病等病害,给种植者造成了巨大的经济损失[4]。根际是土壤、根系和微生物紧密联系和相互作用的区域[5]。药用植物的根际包括促进植物生长的有益微生物,同时也包括通过自毒作用、改变土壤理化性质和降低土壤肥力的有害微生物,因此根际微生物群落影响着药用作物的产量[6]。目前,化学农药制剂是防治金线莲病虫害的主要手段,但农药残留超标、病原菌抗药性增加及作用无靶标等问题已严重影响了金线莲的安全生产。微生物施用策略表现出的无公害、长效性及费用低廉等优势[7],使得功能菌防治技术成为控制植物病害的最佳选择之一。目前,药用植物与根际微生物关系的研究尚处于起步阶段。大多数研究均集中在幼苗和组织培养阶段内生真菌和金线莲的共生培养。如郭顺星等从金线莲根际中分离得到21种菌根真菌,离体培养发现6种菌根真菌促进了天麻种子萌发,5种真菌显著促进了金线莲幼苗的生长[8]。然而,目前关于在温室或林下进行根系促生菌与金线莲共培养以改善该植物的生长和代谢的研究仍较少。
植物根际促生菌(PGPR)是一类生活在土壤中或依附于植物根系的有益微生物,PGPR可提高作物病害防治效果并促进植物生长[9]。如Dunlap等发现,解淀粉芽孢杆菌(Bacillusamyloliquefaciens)FZB42可产生多种抗生素化合物和吲哚-3-乙酸(IAA)从而有效防治金线莲灰霉病的发生,并促进植株生长[10]。Zhang等的研究表明,菌根真菌(Ceratobasidiumsp.)AR2可与金线莲共生,促进金线莲次生代谢水平,提高总黄酮、生物碱、鼠李糖和花青素-3-葡萄糖苷氯化物等活性化合物的含量[11]。Arkhipova等的研究表明,枯草芽孢杆菌(B.subtilis)和巨大芽孢杆菌(B.megaterium)组合施用可促进宿主的细胞分裂素(CKs)分泌,从而提高宿主生理代谢[6]。上述研究为促生菌应用于金线莲培养提供了一定的理论依据。然而,土壤环境是决定植物生长的重要因素,目前关于施用促生菌对土壤微生物体系的研究鲜有报道。基于此,本研究基于高通量测序技术,探索了接种2株芽孢杆菌对金线莲皂苷、黄酮等生物活性化合物及土壤微生物群落的影响,以期为促进金线莲产业的绿色可持续发展提供理论依据。
1 材料与方法
1.1 供试地点与材料
试验于2021年6—7月在福建农业职业技术学院光照培养室中进行。培养室条件:光周期(白天/黑夜)为12 h/12 h,空气相对湿度为75%,温度为20~25 ℃。金线莲购自连江金草农业开发有限责任公司。
促生菌均属于芽孢杆菌属,分别为解淀粉芽孢杆菌和枯草芽孢杆菌,均由中国农业微生物菌种保藏管理中心提供,B.amyloliquefaciens保藏编号为ACCC 60428,B.subtilis保藏编号为ACCC 60429,两者均分离自番茄根际土壤。B.amyloliquefaciens、B.subtilis均采用牛肉膏蛋白胨液体培养基在恒温摇床(30 ℃、180 r/min)振荡培养24 h获得接种菌剂(2.0×108CFU/mL)。
盆栽试验所用土壤取自福建农业职业技术学院试验田(119°38′43″E,25°46′29″N)0~20 cm表层土壤。供试土壤为红壤,土壤理化性质:pH值为5.85,有机质含量为24.75 g/kg,全氮含量为 1.22 g/kg,碱解氮含量为65.08 mg/kg,有效磷含量为34.91 mg/kg,速效钾含量为107.62 mg/kg。
1.2 试验设计
试验采用完全随机设计,设置4个处理,CK:原土培养,不接种微生物菌剂;BA:接种解淀粉芽孢杆菌;BS:接种枯草芽孢杆菌;BA+BS:接种解淀粉芽孢杆菌和枯草芽孢杆菌。每个处理重复8次。
采用黑色圆聚乙烯塑胶桶,每盆装土1.5 kg,将来自无性繁殖的3株金线莲小植株移入盆中。对于BA、BS处理皆采用灌根的方式施用10 mL菌剂,BA+BS 处理2种菌剂各5 mL,CK处理即施用同等用量的无菌牛肉膏蛋白胨液体培养液。土壤持水量保持为75%,试验培育40 d。
1.3 样品采集及测定分析
1.3.1 栽培期菌株存活数及生物膜形成情况测定 为评估施入金线莲栽培土壤中菌株的存活数,采用平板计数,每周检查土壤中解淀粉芽孢杆菌、枯草芽孢杆菌菌株的活菌数,重复3次。
生物膜测定即在96孔塑料培养板中分别加入150 μLD600 nm为0.5的解淀粉芽孢杆菌、枯草芽孢杆菌菌液,重复3次,放入培养箱30 ℃静置培养 48 h,观察菌株生物膜形成情况。
1.3.2 解淀粉芽孢杆菌和枯草芽孢杆菌的功能代谢物分析 2种菌株的溶磷性、植酸酶分泌和嗜铁能力按照李春雨描述的方法[12]进行。植物生长调节剂,如吲哚-3-乙酸、玉米素(ZE)和赤霉素(GA)的检测如下:将0.5 mL 解淀粉芽孢杆菌和枯草芽孢杆菌发酵液接种于50 mL LB培养基中。培养物在恒温振荡器(180 r/min、30 ℃)中振荡培养18 h;振荡培养结束后7 000 r/min离心5 min,取上清液,经0.22 μm的微孔滤膜过滤,再采用乙酸乙酯萃取。
IAA、ZE和GA的高效液相色谱(HPLC)分析在配备C18小柱(4.6 mm×150 mm,5 μm)的Agilent Poroshell 1200系统上进行。溶剂体系为甲醇和0.075%乙酸水溶液(体积比为45 ∶55),流速为 0.7 mL/min,30 ℃条件下反应 20 min。使用紫外分光光度法分别在218、270、200 nm处检测IAA、ZE和GA的吸光度。
1.3.3 金线莲生物活性化合物的提取与测定 本研究中涉及的金线莲生物活性化合物包括多糖、槲皮素、山柰酚、异鼠李素、皂苷等。多糖含量采用优化的苯酚-硫酸法测定[13]。槲皮素、山柰酚及异鼠李素皆采用高效液相色谱法测定,具体步骤参照张玲等的研究[14]。皂苷含量采用甲醇-超声法提取,按NY/T 1842—2010《人参中皂苷的测定》标准采用高效液相色谱测定[15]。
1.3.4 金线莲根际细菌群落的高通量测序 称取土壤样品0.25 g,采用土壤DNA试剂盒(MO Bio Laboratories,USA)提取总基因组DNA。采用NanoDrop®ND-2000c紫外-可见分光光度计(NanoDrop Technologies,Wilmington,DE,USA)通过光度法检查提取的基因组DNA的数量和质量。细菌qRT-PCR扩增引物采用细菌16S rRNA V3~V4区间:338F(5′-ACTCCTACGGGAGGCAGCAG-3′),806R(5′-GGACTACHVGGGTWTCTAAT-3′)。
每个样品的qRT-PCR反应体系为25.00 μL,包括5.00 μL反应缓冲液、5.00 μL GC缓冲液、2.00 μL dNTP (2.5 mmol/L)、1.00 μL正向引物(10 μmol/L)、1.00 μL反向引物(10 μmol/L)、2.00 μL DNA模板、8.75 μL ddH2O、0.25 μL Q5 DNA 聚合酶。PCR热循环条件如下:初始变性 98 ℃ 120 s,30个循环,98 ℃ 15 s,退火55 ℃ 30 s,延伸72 ℃ 30 s,最终72 ℃延伸5 min。通过16S rRNA 扩增子测序检查土壤细菌多样性和群落组成,扩增完毕后,借助Illumina MiSeq平台进行Next Generation Sequencing Service测序。Illumina MiseqTM得到的原始数据采用CASAVA-FLASH进行过滤-拼接后,利用QIIME对每条序列与Silva数据库(SSU123)比对进行物种分类注释。利用Mothur软件统计每个生物样本的α多样性指数。以上分析委托上海天昊生物科技有限公司完成。
1.4 统计分析
采用Microsoft excel 2016进行数据整理,采用SPSS 22.0软件进行单因素(ANOVA)方差分析,采用最小显著差异(LSD)法进行显著性检验(α=0.05),采用Origin 9进行图形绘制。
2 结果与分析
2.1 促生菌生物膜形成情况及在土壤中的存活数
由图1-A可知,随试验培养周期的延长,土壤中解淀粉芽孢杆菌(BA)、枯草芽孢杆菌(BS)及其组合施用处理(BA+BS)的浓度均呈下降趋势。在培养第1周中,BA、BS处理的活菌数明显下降,其中,BS处理的下降幅度最为明显;培养第2周时,BA、BS处理的活菌数进一步降低,此时,BA、BS处理的活菌数仅为原菌剂的1/2;此后3周BA、BS处理的活菌数下降减缓,当培养第5周时BA、BS处理的活菌数分别约为0.25×108、0.33×108CFU/g。而当两者组合施用(BA+BS)情况下,其活菌数下降幅度缓慢,且任一培养周期段皆明显高于单一菌株施用处理(BA、BS),施入土壤5周后,BA+BS处理的活菌数为0.81×108CFU/g。

由图1-B可知,单一培养解淀粉芽孢杆菌(BA)不形成聚集体生物膜,单一培养枯草芽孢杆菌(BS)形成少量生物膜(图1-C),表明BS处理比BA处理更容易形成生物膜。当解淀粉芽孢杆菌与枯草芽孢杆菌组合施用时,生物膜的数量明显增加,明显高于单一菌株处理(图1-D),表明解淀粉芽孢杆菌的存在可促进枯草芽孢杆菌生物膜的形成,且共培养条件下比单一培养更容易形成聚集体。
2.2 促生菌的功能代谢物分析
由表1可知,解淀粉芽孢杆菌和枯草芽孢杆菌均能分泌植酸酶和铁载体,且前者具备溶磷能力。基于HPLC分析显示,解淀粉芽孢杆菌和枯草芽孢杆菌均可分泌生长素、玉米素,2种菌株均不分泌赤霉素,且前者的IAA分泌能力大于后者,而后者的ZE分泌能力大于前者。结果表明,解淀粉芽孢杆菌和枯草芽孢杆菌可通过自身代谢产生多种植物激素从而有利于宿主植物生长。
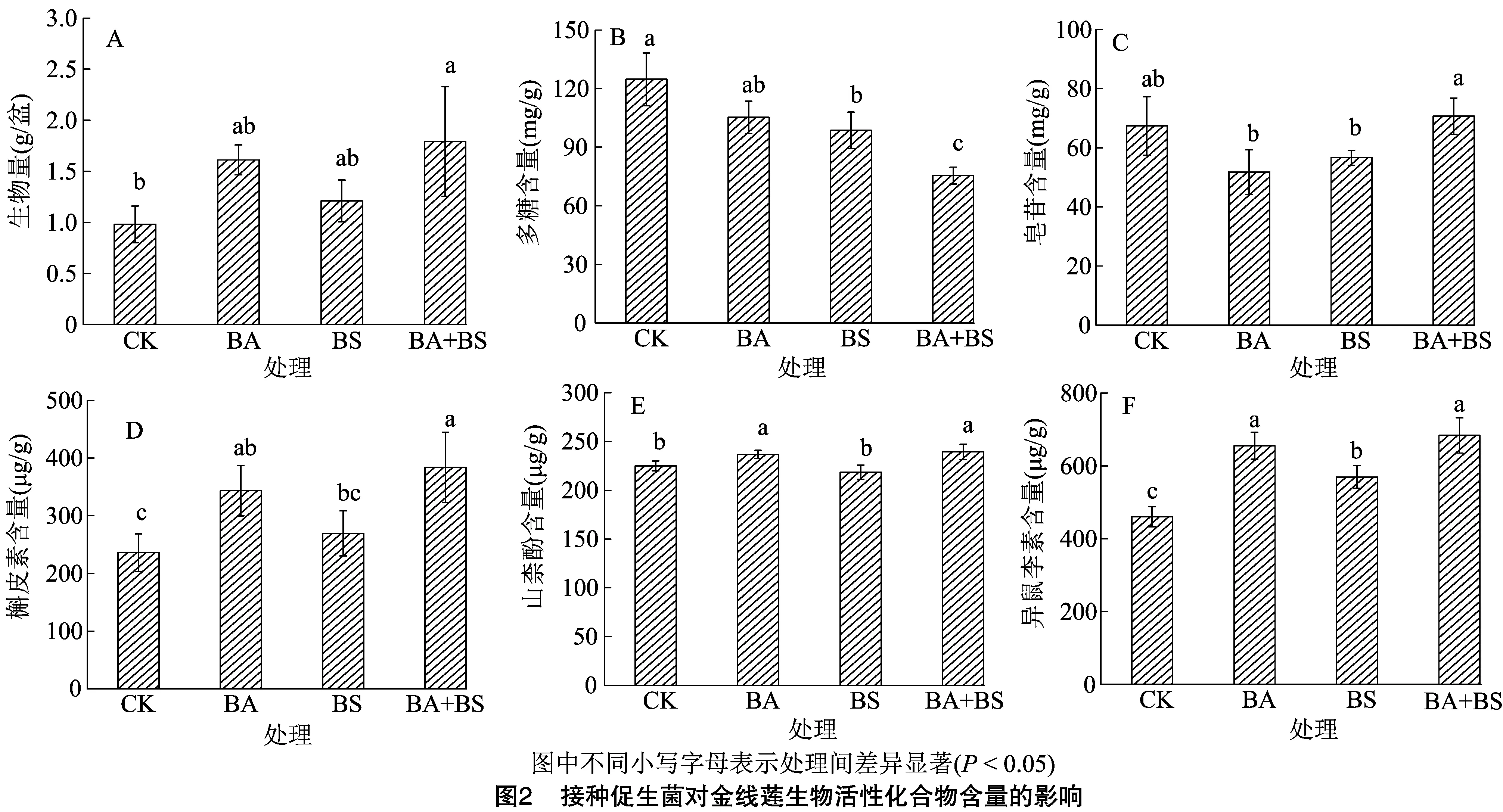
2.3 接种促生菌对金线莲生物活性化合物含量的影响
由图2可知,当解淀粉芽孢杆菌和枯草芽孢杆菌与金线莲培养时,多糖含量降低,生物量、皂苷和3种黄酮(槲皮素、山柰酚、异鼠李素)的含量整体增加。由图2-A可知,生物量中,以BA+BS处理整体较高,CK、BS、BA处理较BA+BS处理降低10.10%~45.26%,其中,BA+BS与CK处理差异显著(P<0.05)。由图2-B可知,多糖含量中,各处理表现为CK>BA>BS>BA+BS,其中,CK、BS、BA处理较BA+BS处理分别显著提高65.26%、39.46%、30.61%。由图2-C可知,皂苷含量以 BA+BS 处理最高,CK处理其次,两者无显著差异,且与BA、BS处理相比,BA+BS处理分别显著提高26.72%、19.92%。由图2-D至图2-F可知,3种黄酮(槲皮素、山柰酚、异鼠李素)的含量均整体表现为CK 表1 解淀粉芽孢杆菌和枯草芽孢杆菌的功能代谢物分析 细菌α多样性是用于评估细菌物种数量(Sobs指数)、多样性(Shannon指数)和丰富度(Chao1指数)的重要指标。由图3可知,在2种菌株组合施用处理(BA+BS)与不接种处理(CK)的α多样指数中,Sobs指数以BA+BS处理大于CK,Shannon指数则以CK大于BA+BS处理,但2个处理的Sobs、Shannon指数均无显著差异。而在Chao1指数中,以BA+BS处理显著大于CK处理,表明2种菌株组合施用对金线莲土壤细菌物种总量及多样性无明显影响,但可提高细菌的丰富度。 在为期40 d的培养中,在门水平组成上,CK处理与BA+BS处理基本一致,但在丰度上存在一定差异。由图4-A可知,变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)最为丰富,三者总丰度在CK、BA+BS处理中各占总丰度的84.55%、79.26%。绿弯菌门(Chloroflexi)在CK、BA+BS处理中各占比总丰度的13.869%、2.454%。浮霉菌门(Planctomycetes)的丰度从CK处理的3.75%在接种处理后略微增加至4.05%。芽孢杆菌属(Bacillus)为厚壁菌门(Firmicutes)的重要属类,与CK处理相比,添加2种菌株培养后土壤中厚壁菌门的丰度由0.78%显著提高至2.13%。 在属水平上,由图4-B可知,CK处理中热酸菌属(Acidothermus)相对丰度为8.04%,添加2种菌株显著提高了热酸菌属的相对丰度,此时丰度为11.75%。类似地,康奈斯氏杆菌属(Conexibacter)从CK处理的1.24%在接种促生菌后升高至3.33%。相比之下,黄色杆菌科类(norank_f_Xanthobacteraceae)的丰度急剧降低。 由图5可知,在CK、BA+BS处理间丰度差异最大的前15个菌属,除出芽菌科未分类属(norank_f_Gemmataceae)外,CK、BA+BS处理间的其他14属皆存在显著差异。其中,热酸菌属(Acidothermus)、慢生根瘤菌属(Bradyhizobium)、norank_o_Subgroup_2、酸杆菌目未分类属(norank_o_Acidobacteriales)、康奈斯氏杆菌属(Conexibacter)、玫瑰弯菌属(Roseiarcus)、norank_c_Actinobacteria、不动杆菌属(Acidibacter)的相对丰度以BA+BS显著高于CK处理。而在黄色杆菌科未分类属(norank_f_Xanthobacteraceae)、norank_c_AD3、norank_o_IMCC26256、norank_o_Elsterales、norank_c_Subgroup_6、Candidatus_Solibacter则以CK处理的相对丰度显著高于BA+BS处理。 由表2可知,Candidatus_Solibacter与多糖、皂苷、槲皮素、山柰酚、异鼠李素等的含量之间皆不存在明显相关性。就多糖含量而言,其与热酸菌属(Acidothermus)、慢生根瘤菌属(Bradyhizobium)、norank_o_Subgroup_2、norank_o_Acidobacteriales、康奈斯氏杆菌属(Conexibacter)、玫瑰弯菌属(Roseiarcus)、norank_c_Actinobacteria、不动杆菌属(Acidibacter)呈显著或极限显著负相关,与黄色杆菌未分类属(norank_f_Xanthobacteraceae)、norank_c_AD3、norank_o_IMCC26256、norank_o_Elsterales、norank_c_Subgroup_6、norank_f_Gemmatacea呈显著或极显著正相关。14个菌属的丰度与皂苷、槲皮素、山柰酚、异鼠李素含量的相关性与多糖含量的相关性趋势相反。 芽孢杆菌属具有较佳的生防及促生功能,可形成菌液制剂且产孢稳定,因此越来越多地用于农业系统[7]。其中,解淀粉芽孢杆菌和枯草芽孢杆菌是应用最为广泛的芽孢杆菌属成员,两者皆可分泌低分子量多肽及胞外水解酶等活性物质以抑制病原菌,且可产生植物激素促进植物生长发育[16]。 本研究结果表明,解淀粉芽孢杆菌和枯草芽孢杆菌可在金线莲的根际土壤存活,且这2种菌株可以相互促进形成生物膜。生物膜是不同细菌交换代谢产物的场所,其中,一些细菌可利用其他细菌的代谢产物作为电子受体或供体,从而提高生物膜的功能[17]。前人的研究表明,多物种的协同作用可促进群落生物膜的形成[18],这可能是菌株间的生防分泌物与细胞膜铁离子转运通道FeuABC的调控蛋白特异性结合,并诱导feuABC基因的表达,从而提高胞内铁离子浓度和促进生物膜形成[19]。 表2 促生菌处理下土壤细菌属水平差异菌属丰度与生物活性化合物含量的相关性分析结果 本研究中,解淀粉芽孢杆菌和枯草芽孢杆菌的功能代谢产物分析结果表明,2种菌株皆可分泌植酸酶、铁载体、生长素和玉米素;此外,枯草芽孢杆菌可溶解磷。土壤微生物可为植物生长提供养分,溶解土壤中难溶的磷,在非共生条件下固氮[20];此外,部分促生菌可分泌铁载体从而提高土壤中铁的利用率[21]。由此可见,解淀粉芽孢杆菌和枯草芽孢杆菌具有较佳的促生及生防潜力。Idris等的研究表明,解淀粉芽孢杆菌(B.amyloliquefaciensFZB42)分泌IAA是该菌株影响植物生长的主要机制之一[22]。另一项研究报道,PGPR通过产生亚精胺和赤霉素促进植物生长[23]。本研究中,解淀粉芽孢杆菌和枯草芽孢杆菌的发酵液中未检出亚精胺和赤霉素,说明不同促生菌分泌的植物生长激素的种类和含量不同。 金线莲含有黄酮、多糖、皂苷、生物碱、甾醇、有机酸及微量元素等多种活性成分[2-3],不同活性成分对植物生长发育及药用功能不同。本研究中,2种芽孢杆菌属菌株与金线莲共培养时,皂苷和3种黄酮(槲皮素、山柰酚、异鼠李素)的含量普遍增加,但多糖含量下降。植物多糖作为环境响应物质,可作为碳源产生细胞外基质输送至根际从而介导植物根部周围细菌生物膜的形成[24]。因此,解淀粉芽孢杆菌和枯草芽孢杆菌可使用金线莲中的多糖及其衍生物以便更好地在根际定殖,因此多糖含量下降。此外,在活性成分中,皂苷和黄酮是金线莲的特征成分,具有药用和食用价值,且金线莲生物量在接种促生菌的条件下增加;因此,多糖含量的降低并不代表金线莲多糖分泌水平的降低,可能是根际微生物截取的结果。Rahman等的研究表明,植物促生菌芽孢杆菌属和伯霍尔德杆菌属(Paraburkholderia)可提高草莓果实中抗氧化剂的含量,如酚类物质、类胡萝卜素、黄酮类化合物和花青素[25]。这些研究表明,添加有益微生物可诱导宿主作物的生物活性成分的合成。 近年来,微生物肥料对根际微生物群或植物微生物群的调控得到广泛研究,且根际微生物群落比寄主植物编码更多的基因,通过合作和竞争形成稳定的群落结构,对植物的健康和生长至关重要。本研究中,细菌α多样性指数表明,解淀粉芽孢杆菌和枯草芽孢杆菌组合施用对金线莲土壤细菌物种总量及多样性无明显影响,但提高了细菌群落的丰富度。根际细菌群落中,在门水平上,部分细菌门丰度发生显著变化,如绿弯菌门(Chloroflexi)、浮霉菌门(Planctomycetes)、厚壁菌门(Firmicutes)的相对丰度皆明显提高,Chloroflexi是光合细菌的主要细菌门之一,Planctomycetes是全球氮循环和污水处理贡献最大的主要细菌门,在厌氧和自养代谢中具有独特的氧化铵的作用,芽孢杆菌属于厚壁菌门(Firmicutes),是主要的生防菌株来源门类[12,26]。此外,在属水平上,以热酸菌属(Acidothermus)、慢生根瘤菌属(Bradyhizobium)、玫瑰弯菌属(Roseiarcus)为主的菌属丰度发生显著上调,而病原菌较多的黄色杆菌科未分类属(norank_f_Xanthobacteraceae)的丰度急剧降低。相关分析结果进一步表明,皂苷、槲皮素、山柰酚、异鼠李素的含量与以热酸菌属(Acidothermus)、慢生根瘤菌属(Bradyhizobium)、玫瑰弯菌属(Roseiarcus)为主的有益菌属的丰度皆呈显著或极显著正相关,而与黄色杆菌科未分类属(norank_f_Xanthobacteraceae)的丰度呈极显著负相关。这些结果表明接种解淀粉芽孢杆菌和枯草芽孢杆菌可通过增加有益微生物的丰度和降低有害微生物的丰度来改善金线莲的健康及生物活性化合物的合成水平。
2.4 接种促生菌对金线莲栽培土壤α多样性的影响

2.5 接种促生菌对金线莲栽培土壤细菌群落结构的影响
2.6 接种促生菌对金线莲栽培土壤细菌属水平群落差异的影响
2.7 促生菌处理下土壤细菌丰度与生物活性化合物的相关性分析
3 讨论与结论



