8种睡莲对低温胁迫的生理响应及抗寒性评价
2023-01-10杨梅花韩彦奇郭佳星李卓怡徐迎春刘长青
杨梅花, 黄 祥, 韩彦奇, 郭佳星, 李卓怡, 钟 敏, 徐迎春, 刘长青
(1.石河子大学农学院,新疆石河子 832003; 2.石河子市园林研究所,新疆石河子 832003;3.南京农业大学园艺学院/农业农村部景观设计重点实验室,江苏南京 210095;4.新疆生产建设兵团林业和草原资源监测中心,新疆乌鲁木齐 830011)
睡莲为睡莲科(Nymphaeaceae)睡莲属(NymphaeaL.)多年生水生植物,在多个领域被广泛应用[1],具有观赏性[2]、食用性[3]、药用性[4]和生态修复[5-6]等重要的经济价值。根据其生态习性,可分为耐寒睡莲(hardy waterlily)和热带睡莲(tropical waterlily)。其中耐寒睡莲具有较高的抗寒性,主要分布在20°N以北的地域[7],而热带睡莲主要分布于热带地区,其在花色、气味、用途上均优于耐寒睡莲,但耐寒能力差,在北方地区不能露地越冬,是限制其在北方地区引种栽培的主要因素。
在低温胁迫下,植物细胞的各项生理指标等会发生显著变化[8]。同时,植物的抗寒性由多个因素综合控制,抗寒机制复杂,抗寒性评价必须是多方面的[9]。目前,关于水生植物对低温胁迫的响应及抗寒性评价的研究颇多。梁雪等通过综合比较各指标,得到了3种湿地植物的耐寒性强弱[10]。李欣等发现,荷花不同品种对低温胁迫的响应能力有一定差异[11]。吉琴针对6种睡莲叶片相关生理指标在低温胁迫下的变化特征,探讨了热带睡莲种间的抗寒性差异[12]。而针对不同生态类型睡莲的抗寒性生理研究及抗寒性综合评价却鲜有报道。
本研究以4种耐寒睡莲,雪白睡莲(N.candida)、伊丽莎白(N. ‘Princess Elizabeth’)、科罗拉多(N. ‘Colorado’)、墨西哥黄(N.mexicanaZucc.),4种热带睡莲黑美人(N. ‘Black Beauty’)、蒂娜(N. ‘Tina’)、九品香(N. ‘hybrid’)、伊斯兰达(N. ‘Islamorada’)为试验材料,在低温胁迫下测定其叶片相关生理指标,研究8种睡莲对低温胁迫的生理响应机制差异,并建立抗寒性综合评价体系,以期为睡莲的推广应用和选育抗寒性强的睡莲种质提供理论依据。
1 材料与方法
1.1 试验区概况
试验于2021年在石河子大学进行,地理坐标86°3′9″E,44°17′49″N附近,海拔430 m。试验区年平均气温7~8 ℃,年日照2 300~2 700 h,年降水量180~270 mm。
1.2 试验材料
试验共选用4种耐寒睡莲、4种热带睡莲,其中雪白睡莲为分布在我国新疆的原生种(表1)。8种睡莲于2021年4月采用温室内自然光照的盆栽方式培养,盆深50 cm,口径45 cm,正常水肥管理,当植株长至9~11张叶片时,选取长势良好的植株,取样进行低温处理。

表1 参试睡莲材料基本信息
1.3 试验方法
本试验选取长势相同的浮水功能叶,取离体叶片,在10、5、0、-5 ℃低温胁迫下分别处理4 h,以15 ℃为对照,共5个温度梯度,每处理重复3次。处理后的试验材料分为2个部分,一份叶片剪碎后测定电导率(REC)和叶绿素(Chl)含量指标,另一份液氮冻存后置于-80 ℃保存,测定叶片丙二醛(MDA)含量、酶活性、可溶性糖(SS)和可溶性蛋白(SP)含量。
1.4 项目测定
相对电导率的测定采用电导仪法[13];丙二醛含量的测定采用硫代巴比妥酸法[13];超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性、过氧化氢酶(CAT)活性的测定分别采用氮蓝四唑还原法、愈创木酚法和紫外吸收法[13];可溶性糖、可溶性蛋白含量的测定分别采用蒽酮比色法和考马斯亮蓝G-250染色法[14];叶绿素含量测定采用分光光度法[14]。
1.5 数据分析
通过隶属函数法计算各指标的隶属函数值,抗寒性负相关的参数(REC、MDA含量)采用降型分布函数:U(Xijk)=(Xmax-Xijk)/(Xmax-Xmin),与抗寒性呈正相关的参数(叶绿素、SS、SP含量,SOD、POD、CAT酶活性)采用升型分布函数:U(Xijk)=(Xijk-Xmin)/(Xmax-Xmin)[15]。隶属函数值乘以相应的权重,累加求和得出综合评价值。运用 SPSS 22.0对数据进行处理,采用Excel 2016软件绘图。
2 结果与分析
2.1 低温胁迫对睡莲细胞膜透性的影响
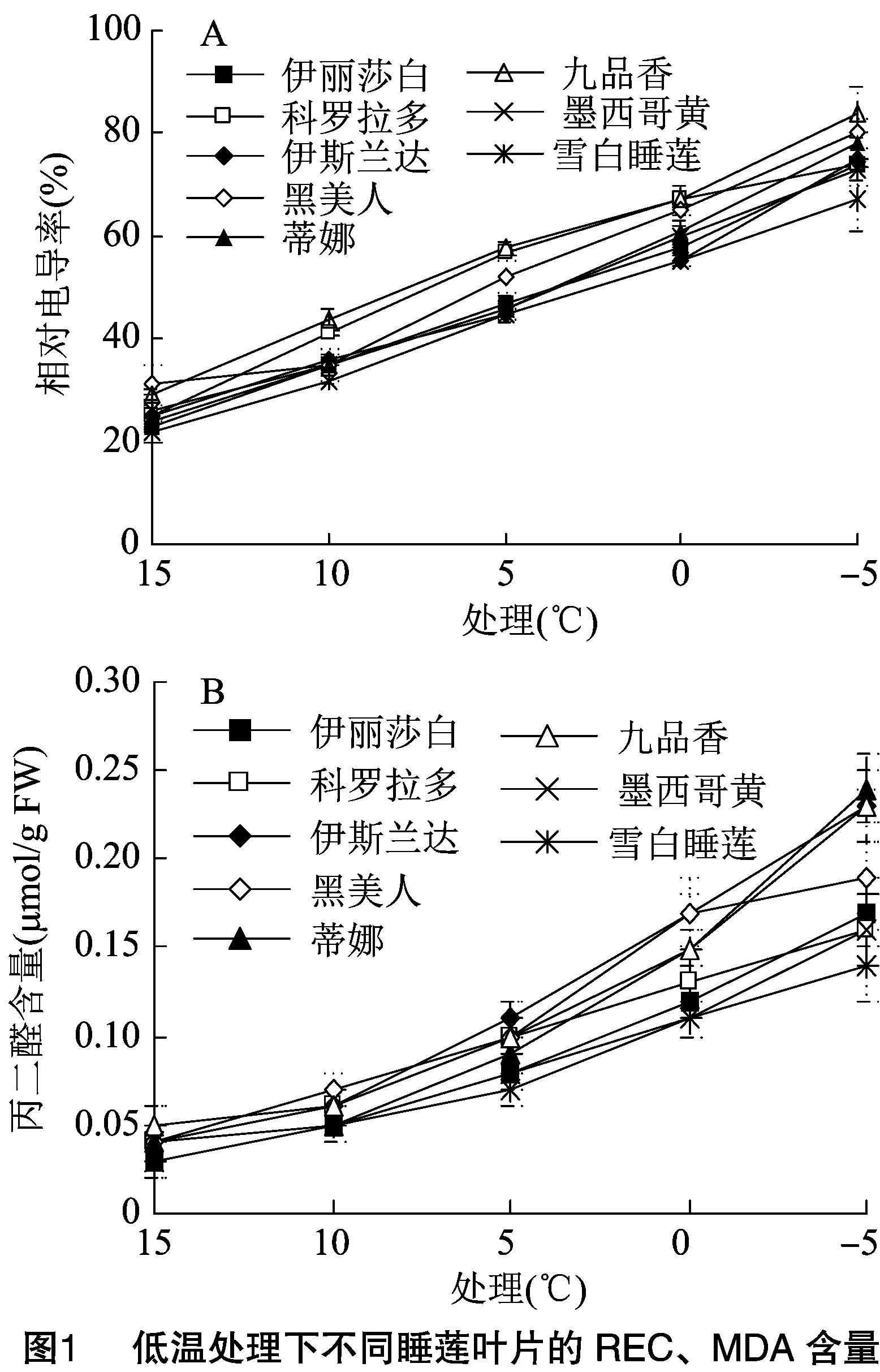
随胁迫温度的降低,8种睡莲叶片REC均呈上升趋势。在对照处理15 ℃下,8种睡莲叶片REC均保持在20%~30%。在-5 ℃低温胁迫时,8种睡莲叶片REC达到最大值,其中九品香睡莲叶片REC最大,为84%,雪白睡莲叶片REC最小,为67%。其中雪白睡莲叶片的REC在-5 ℃低温胁迫下均小于其他7种睡莲叶片。8种睡莲叶片REC达到最大值时相比对照增幅为蒂娜(225.0%)>伊丽莎白(221.7%)>雪白睡莲(204.5%)>伊斯兰达(200.0%)>科罗拉多(196.0%)>九品香(189.7%)>墨西哥黄(180.8%)>黑美人(158.1%)(图1-A)。
随胁迫温度的降低,8种睡莲叶片MDA含量均呈上升趋势。在对照15 ℃处理下,8种睡莲叶片MDA含量保持在0.03~0.05 μmol/g FW。在 -5 ℃ 低温胁迫时,8种睡莲叶片MDA含量达到最大值,蒂娜睡莲叶片MDA含量最大,为 0.24 μmol/g FW,雪白睡莲叶片最小,为 0.14 μmol/g FW。其中雪白睡莲叶片的MDA含量在低温胁迫下均小于其他7种睡莲。8种睡莲叶片MDA含量达到最大值时相比对照增幅为蒂娜(500.0%)>伊斯兰达(475.0%)>伊丽莎白(466.7%)>黑美人(375.0%)>雪白睡莲(366.7%)>九品香(360.0%)>科罗拉多、墨西哥黄(300.0%)(图1-B)。
2.2 低温胁迫对睡莲抗氧化酶活性的影响
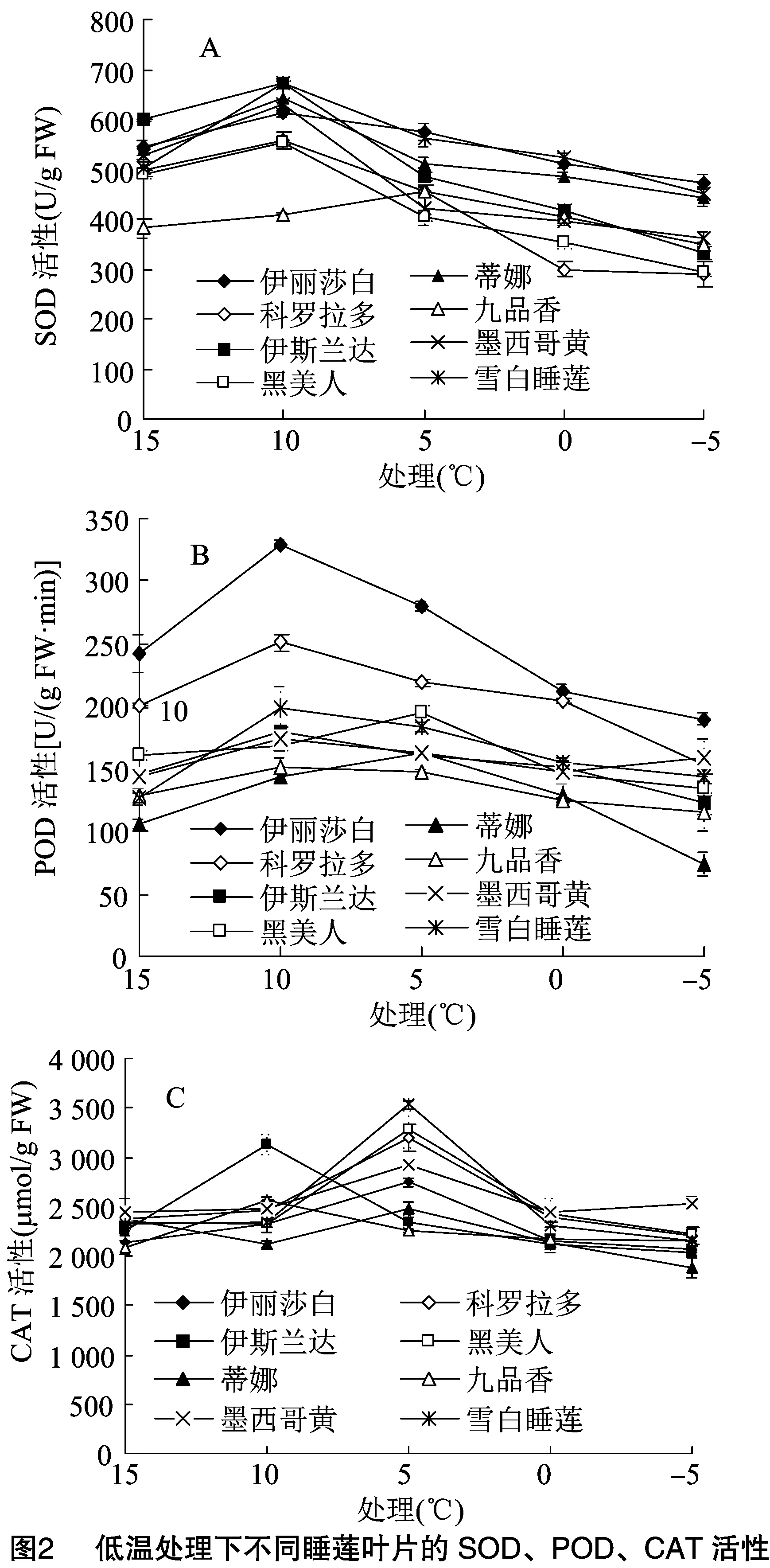
随胁迫温度的降低,8种睡莲叶片SOD酶活性均呈先升后降趋势。九品香睡莲叶片在5 ℃低温胁迫时SOD活性最大,其余睡莲在10 ℃低温胁迫时SOD活性最大。8种睡莲叶片SOD酶活性最大值均不同,雪白睡莲叶片SOD酶活性最大值最大,为673.46 U/g FW,九品香睡莲叶片SOD酶活性最大值最小,为454.99 U/g FW。8种睡莲叶片SOD酶活性在达到最大值时相比对照增幅为雪白睡莲(33.6%)>九品香(19.3%)>蒂娜(18.7%)>墨西哥黄(18.7%)>黑美人(13.7%)>伊丽莎白(13.0%)>伊斯兰达(11.8%)>科罗拉多(11.7%)(图2-A)。
随胁迫温度的降低,8种睡莲叶片POD酶活性均呈先升后降趋势。在10 ℃低温胁迫时,伊丽莎白、科罗拉多、伊斯兰达、九品香、墨西哥黄、雪白睡莲叶片POD酶活性达最大,黑美人、蒂娜睡莲叶片在5 ℃低温胁迫时酶活性最大。8种睡莲叶片POD酶活性最大值均不同,伊丽莎白睡莲叶片POD酶活性最大值最大,为329.49 U/(g FW·min),九品香睡莲叶片POD酶活性最大值最小,为 152.05 U/(g FW·min)。8种睡莲叶片POD酶活性在达到最大值时相比对照增幅为雪白睡莲(56.7%)>蒂娜(53.9%)>伊丽莎白(36.1%)>科罗拉多(25.4%)>伊斯兰达(23.0%)>墨西哥黄(21.9%)>黑美人(21.3%)>九品香(18.8%)(图2-B)。
随胁迫温度的降低,8种睡莲叶片CAT酶活性均呈先升后降趋势。伊斯兰达、九品香睡莲叶片在10 ℃低温胁迫时CAT酶活性最大,其余睡莲叶片在5 ℃低温胁迫时酶活性最大。8种睡莲叶片CAT酶活性最大值均不同,雪白睡莲叶片CAT酶活性最大值最大,为3 532.54 μmol/g FW,蒂娜睡莲叶片CAT酶活性最大值最小,为2 471.91 μmol/g FW。8种睡莲叶片CAT酶活性在达到最大值时相比对照增幅为雪白睡莲(51.8%)>黑美人(40.4%)>伊斯兰达(38.0%)>科罗拉多(34.7%)>伊丽莎白(28.7%)>九品香(23.0%)>墨西哥黄(19.0%)>蒂娜(3.8%)(图2-C)。
2.3 低温胁迫对睡莲可溶性渗透调节物质的影响
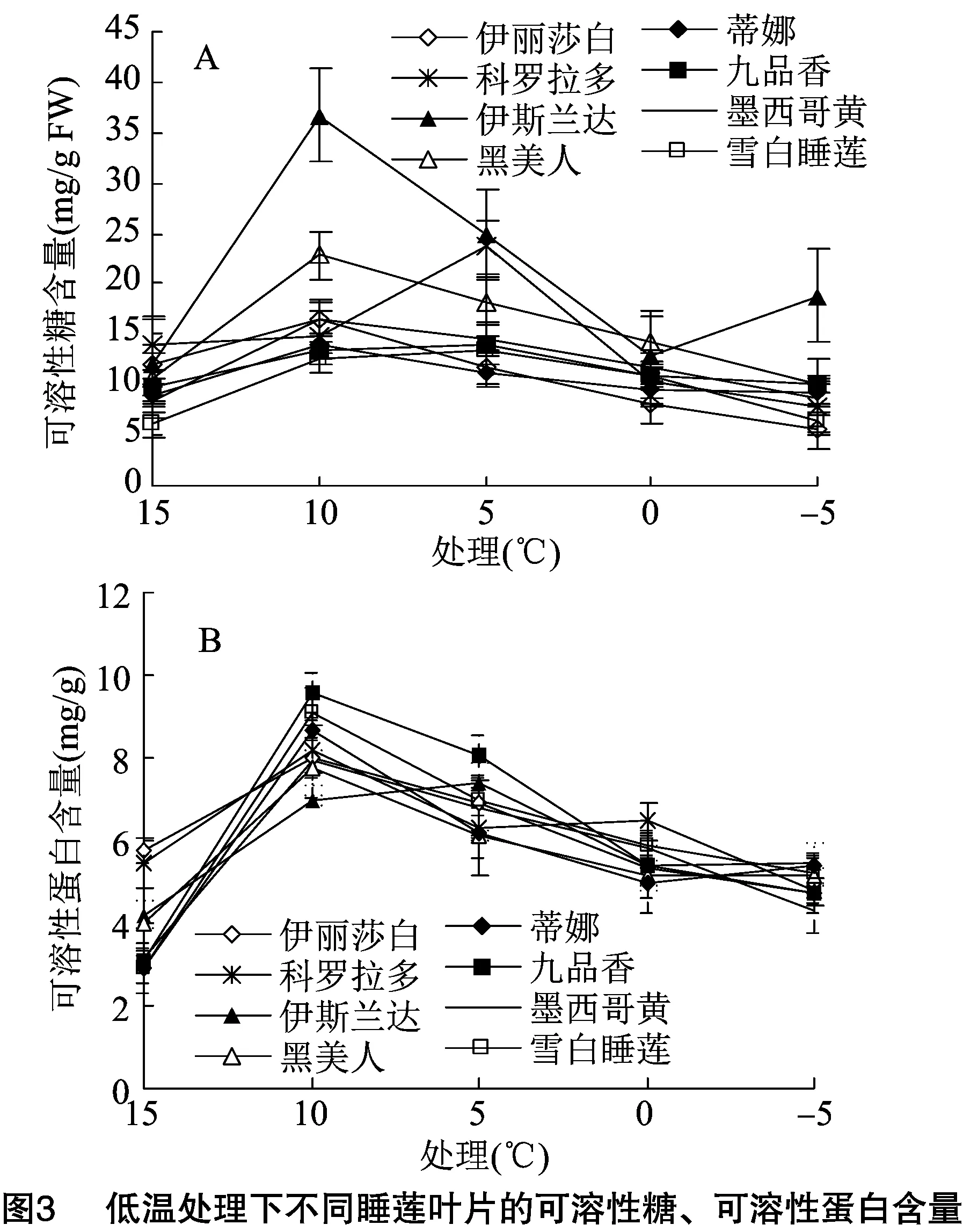
随胁迫温度的降低,8种睡莲叶片SS含量均呈先升后降趋势。科罗拉多、九品香、雪白睡莲叶片在5 ℃低温胁迫时SS含量最高,其余睡莲叶片在10 ℃低温胁迫时SS含量最高。8种睡莲叶片SS含量最大值均不同,伊斯兰达睡莲叶片SS含量最大值最大,为36.68 mg/g FW,雪白睡莲叶片SS含量最大值最小,为13.40 mg/g FW。8种睡莲叶片SS含量达到最大值时相比对照增幅为伊斯兰达(207.7%)>雪白睡莲(114.7%)>黑美人(113.5%)>墨西哥黄(99.3%)>科罗拉多(68.1%)>蒂娜(53.7%)>九品香(45.2%)>伊丽莎白(38.6%)(图3-A)。
随胁迫温度的降低,8种睡莲叶片SP含量均呈先升后降趋势。伊斯兰达睡莲叶片在5 ℃低温胁迫时SP含量最高,其余睡莲叶片在10 ℃低温胁迫时SP含量最高。8种睡莲叶片SP含量最大值均不同,九品香睡莲叶片SP含量最大值最大,为 9.59 mg/g FW,伊斯兰达睡莲叶片SP含量最小,为7.4 mg/g FW。8种睡莲叶片SP含量在达到最大值时相比对照增幅为雪白睡莲(212.4%)>九品香(209.4%)>蒂娜(200.0%)>墨西哥黄(151.9%)>黑美人(95.5%)>伊斯兰达(76.6%)>科罗拉多(50.9%)>伊丽莎白(38.1%)(图3-B)。
2.4 低温胁迫对叶绿素总含量的影响
由图4可知,随胁迫温度的降低,8种睡莲叶片的Chl含量逐渐下降,其下降的速率随着温度的降低而减小。在15 ℃下,除科罗拉多睡莲,其他7种睡莲叶片Chl含量均保持在1.5 mg/g FW左右。在-5 ℃低温胁迫时Chl含量达到最小值,其中科罗拉多睡莲叶片Chl含量最大值最大,为2.4 mg/g FW,伊斯兰达睡莲叶片Chl含量最大值最小,为 1.33 mg/g FW。科罗拉多睡莲叶片的Chl含量在低温胁迫下均高于其他7种睡莲叶片。8种睡莲叶片Chl含量达到最低值时相比对照降幅为黑美人(66.5%)>伊丽莎白(64.6%)>蒂娜(58.3%)>墨西哥黄(56.5%)>科罗拉多(50.0%)>伊斯兰达(49.6%)>九品香(40.0%)>雪白睡莲(37.5%)。

2.5 抗寒性综合评价
2.5.1 抗寒性综合评价体系的建立 抗寒性综合评价体系中,提取累计贡献率达到80%以上的主成分进行综合评价[16]。由表2可知,前3个指标贡献率分别为36.277%、26.689%、17.365%,累计贡献率为80.331%。以前3个主成分分析各指标的权重,由表3可知,睡莲叶片中抗寒性相关性最大的指标是CAT活性、Chl含量,其次是SP、SS含量。

表2 8种睡莲材料抗寒性指标的特征根和贡献率

表3 8种睡莲材料抗寒性指标的权重
2.5.2 各指标隶属度值及抗寒性综合指数 抗寒性综合指数是各指标隶属度与各指标权重的乘积,综合指数的大小反映综合抗寒性能力的差异[17],综合指数值越大,表明睡莲抗寒性越强。从表4可知,在8种睡莲中,科罗拉多的抗寒能力最强,蒂娜抗寒能力最差,抗寒能力强弱依次为科罗拉多(0.64)>雪白睡莲(0.54)>伊丽莎白(0.52)>墨西哥黄、伊斯兰达、黑美人(0.48)>九品香(0.47)>蒂娜(0.43)。

表4 8种睡莲材料各指标隶属度值及抗寒性综合指数
3 讨论与结论
REC和MDA含量的变化反映细胞膜的损伤程度[18-19],可作为植物抗寒性鉴定的指标。本试验中随胁迫温度的降低,8种睡莲叶片的REC与MDA含量均呈上升趋势。这与张艳侠等在5个石榴品种的抗寒性评价中REC与MDA含量变化趋势[20]相同。反映出在低温胁迫下,睡莲细胞膜受到损伤,透性增大而引起了REC的变化。其中,蒂娜睡莲叶片REC增幅最大,黑美人睡莲叶片的REC增幅最小。同时,植物脂质过氧化产物MDA大量积累,其浓度越高对植物细胞的损害越大。其中,蒂娜睡莲叶片MDA含量增幅最大,墨西哥黄睡莲叶片的MDA含量增幅最小。本试验中,蒂娜睡莲叶片REC和MDA含量变化幅度均为最大,表明其细胞膜的损伤程度为最大,在一定程度上反映了其抗寒能力较弱。雪白睡莲的REC与MDA含量在低温胁迫下均保持最小值,也可反映其抗寒能力较强。
SOD、POD和CAT酶是植物重要的抗氧化保护酶系统的保护酶[21-24]。本试验中SOD、POD和CAT酶活性呈先升后降趋势,表明低温胁迫破坏了植物正常的氧化代谢,活性氧产生过快导致积累,抗氧化酶活性因而增强;但随着温度的进一步降低,SOD、POD和CAT酶活性均有下降,推测可能是细胞结构受到了破坏,保护酶系统清除活性氧的能力降低。这与陈明辉等研究低温处理下果树的抗氧化酶活性变化趋势[25]一致。本研究中,科罗拉多、九品香和蒂娜的睡莲叶片分别在SOD、POD和CAT酶活性的测定中增幅最小,雪白睡莲叶片SOD、POD和CAT酶活性增幅均为最大,表明其在低温胁迫下细胞抗氧化能力最强,推测雪白睡莲对低温变化的适应性较强。
SS、SP是重要的有机渗透调节物质[26-27]。本试验中8种睡莲叶片SS和SP含量呈先升后降趋势。在低温胁迫初期,睡莲叶片SS和SP含量升高,调节了其细胞渗透压,增强了其抗寒能力,但随着温度的进一步降低,细胞膜被破坏,有机渗透调节物质外渗,SS和SP含量下降。这与刘杜玲等对早实核桃的研究结果[28]一致。本试验中,伊斯兰达睡莲和雪白睡莲叶片在SS、SP含量中分别增幅最大,伊丽莎白睡莲叶片SS和SP含量增幅均最小。伊丽莎白为耐寒性睡莲,其SS、SP含量增幅却远小于热带的伊斯兰达睡莲SS含量增幅,推测原因是伊丽莎白叶片本身SS含量较高,受到低温胁迫后,细胞组织中SS含量小幅度提高即可降低膜内细胞受低温的伤害。
叶绿素是反映低温胁迫下植物光合作用能力的重要指标[29]。本试验中,随胁迫温度的降低,8种睡莲叶片的Chl含量逐渐下降,并且逐渐趋于平缓,推测低温加速了叶绿素的分解,导致睡莲叶片内Chl含量减少。其中黑美人睡莲叶片Chl含量下降幅度最大,雪白睡莲叶片Chl含量下降幅度最小,在一定程度上表明雪白睡莲的抗寒性较强,黑美人睡莲的抗寒性较弱。而科罗拉多睡莲叶片Chl含量在试验中均保持最大值,可反映其抗寒能力最强。
植物在逆境胁迫过程中,多种因素影响其生理指标的变化[30-31],因此不能用单个指标来评价睡莲植物的抗逆性。本研究结果中CAT活性、Chl、SP、SS含量可作为评价睡莲抗寒性的主要指标。这与姜丽娜等研究的小麦抗寒性主要评价指标[9]不完全一致,表明抗寒性评价指标的权重在不同物种中存在差异。
植物抗寒能力的研究具有重要的应用价值[32]。本研究通过对8种睡莲叶片的相关生理指标进行分析,采用隶属函数法对其抗寒性进行综合评价。结果表明,抗寒能力为科罗拉多>雪白睡莲>伊丽莎白>墨西哥黄、伊斯兰达、黑美人>九品香>蒂娜。本研究结果可为睡莲抗寒性选育推广和栽培养护提供科学方法和相关理论依据。
