瓜类白粉病菌生理小种鉴定及抗白粉病甜瓜品种筛选
2023-01-10徐兵划汪国莲仲秀娟黄大跃张朝阳孙玉东
徐兵划, 汪国莲, 仲秀娟, 黄大跃, 顾 妍, 张朝阳, 程 瑞, 孙玉东
(1.江苏徐淮地区淮阴农业科学研究所,江苏淮安 223001; 2.淮安市设施蔬菜重点实验室,江苏淮安 223001)
瓜类白粉病是一种在甜瓜、黄瓜、南瓜、西瓜等瓜类作物上广泛发生的重要病害。在发病期,白粉病病菌呈指数增长,且迅速传播,植株叶片大面积枯死,导致产量减产,造成严重的经济损失[1]。江苏地区甜瓜多为大棚设施栽培,加之高温高湿气候条件,成为白粉病的高发区[2]。
在我国致使葫芦科作物发病的主要是单囊壳白粉菌[Sphaerothecafuliginea(syn.Podosphaeraxanthii)]与二孢白粉菌[Erysiphecichoraeearum(syn.Golovinomycescichoracearum)]。单囊壳白粉菌(Px)分化出0、1、2F、2US等11个生理小种,二孢白粉菌(Gc)分化出0号、1号2个生理小种[3]。白粉病生理小种众多,分化演替快,研究各地区白粉病生理小种的演变对葫芦科白粉病的防治与白粉病抗性育种具有重要意义[4]。
通过采集江苏淮安、南京、常熟、连云港,浙江杭州,上海青浦区、金山区等地区的甜瓜、南瓜、黄瓜等感染白粉病的叶片,利用13份甜瓜白粉病鉴别寄主鉴定这些地区白粉病生理小种类型,并对8个甜瓜品种进行苗期白粉病接种鉴定,以筛选出抗白粉病的甜瓜品种,并对接种后不同时间不同抗性品种植株中超氧化物歧物酶(SOD)、过氧化物酶(POD)、丙二醛(MDA)等的变化进行跟踪测定,研究不同抗性甜瓜材料生理生化机制。
1 材料与方法
1.1 材料
1.1.1 白粉病菌生理小种鉴定材料 采用国际通用的13份甜瓜白粉病菌生理小种鉴定的鉴别寄主(表1),分别为Iran-H、Topmark、Vedrantais、PMR 45、PMR 6、Edisto 47、PI 124112、PI 414723、PMR 5、MR-1、Nantais Oblong、WMR 29、PI 124111,由北京市农林科学院蔬菜研究中心提供。
1.1.2 抗白粉病甜瓜品种筛选 甜瓜品种玉姑(T1)、西州密25(T2)由市场购入,苏甜2号(T3)由江苏省农业科学院蔬菜研究所提供,苏乾4号(T4)、苏乾5号(T5)、1911ME133(T7)、1911ME134(T8)、苏乾1号(T9)由江苏徐淮地区淮阴农业科学研究所提供。

表1 甜瓜白粉病菌生理小种的鉴别寄主及其抗感反应
1.2 试验方法
1.2.1 白粉病菌的生理小种鉴定 2020年9月20日,甜瓜白粉病菌鉴别寄主在淮安市农业科学院科研创新基地育苗,播种于50孔穴盘。10月10—12日从江苏淮安、南京、常熟、连云港,浙江杭州,上海青浦区、金山区等地区分别采集甜瓜、南瓜、黄瓜等感染白粉病的叶片(表2),分别用毛笔刷下叶片上白粉病菌孢子至无菌蒸馏水中,高速旋转,打散孢子团[5]。在40倍光学显微镜下观察,在血球计数板上计算分生孢子数,测算浓度,调整孢子浓度值为105个/mL,加入 Tween-20,搅拌均匀。10月13日,采用喷雾接种,每个处理接种10株,3次重复。接种后,放入人工气候箱,黑暗24 h,之后光照12 h/黑暗12 h,温度为28 ℃,湿度为80%。接种后第12 天观察发病情况,计算病情指数(DI)。

表2 感染白粉病叶片的采集详情
1.2.2 病原菌形态学及分子鉴定 分别取7个地区的白粉病病原菌无性世代分生孢子于载玻片上,盖上盖玻片,显微镜下观察分生孢子形态,有纤维状体的为单囊壳白粉菌,无纤维状体的为二孢白粉菌[6]。
将叶片表面的菌丝与孢子混合物刷到1.5 mL 离心管中,用十六烷基三甲基溴化铵(CTAB)法提取白粉病菌DNA,1%琼脂糖凝胶检测DNA样品,合格后进行PCR反应,PCR反应试剂是SanTaqPlus PCR Master Mix(Sangon Biotech:B532081),引物采用通用引物ITS4。PCR 产物经1.5%琼脂糖凝胶电泳检测,合格的PCR产物送至生工生物工程(上海)股份有限公司进行测序。将测序序列在GenBank数据库(https://www.ncbi.nlm.nih.gov/)中进行比对分析。
1.2.3 抗白粉病甜瓜品种筛选 2021年3月20日,8个甜瓜品种在淮安市农业科学院科研创新基地玻璃温室育苗,播种于50孔穴盘。4月12日,3叶至4叶1心时接种,病原菌为纯化的2France,每个材料接种50株,2次重复。接种后5、7、10 d观察发病情况,第12天时统计病情指数。
1.2.4 生化指标的测定 于接种0 h和接种后24、72、120、168 h取植株的从上到下第3张完全展开的叶片,测定其丙二醛含量,超氧化物歧化酶和过氧化物酶等抗氧化酶活性的变化,每个材料3次生物学重复。MDA含量采用硫代巴比妥酸法[7]测定,SOD活性采用氮蓝四唑法[7]测定,POD活性采用愈创木酚法[7]测定。
1.2.5 白粉病病情分级 接种 12 d时待植株充分发病后,调查发病情况。病情分级标准参考耿丽华等的方法[8]并加以改进,共分6级:0级,整株无病斑;1级,仅子叶上有很少量病斑或茎上有少量病斑,白粉模糊,占整株的比例在10%以下;2 级,仅叶片上有较多白粉或子叶上有白粉,茎上有很少量白粉,白粉明显,占整株的比例为10%~20%;3 级,叶片上有很多白粉,茎上有少量白粉,白粉厚,连片,占整株的比例为21%~50%;4 级,叶片和茎上布满白粉,白粉浓厚,占整株的比例为51%~80%;5 级,植株死亡。依据上述分级标准调查病情,并计算病情指数。按病情指数进行抗、感分级,分级标准:抗病(R)为DI<20%;中抗(MR)为20%≤DI<40%;中感(SR)为40%≤DI<60%;感病(S)为60%≤DI<80%;高感(HS)为DI≥80%。

1.2.6 数据分析 采用Excel及SPSS软件对数据进行分析。
2 结果与分析
2.1 显微镜下白粉病菌形态
在显微镜下观察白粉病菌分生孢子均为椭圆形(图1-A),应为单囊壳白粉病菌,分生孢子产生的菌丝有发达的纤维状体(图1-B),而二孢白粉菌分生孢子为细细长长的圆柱形状,因此可确定7份白粉病菌均为单囊壳白粉病菌。

2.2 白粉病菌内源转录间隔区(ITS)序列
利用通用引物ITS4进行PCR扩增获得的目的片段以及基因组DNA进行琼脂糖凝胶电泳检测,随后测序,测序获得长度为514 bp的碱基序列(图2),与单囊壳白粉病菌序列进行比对,相似度达到98.83%(508/514),空白序列(Gap)为5.51%(30/544)。
2.3 白粉病菌生理小种鉴定
接种后5 d,Iran-H、Topmark、PMR 45的叶片即出现白粉病病斑,接种后7 d Vedrantais、Nantais Oblong的叶片开始出现白粉病病斑。第12 天统计的结果(图3、表3)显示,PMR6、Edisto 47、PI 124112、PI 414723、PMR 5、MR-1、WMR 29、PI 124111的叶片和茎部均无白粉病病斑,表现为抗病,Iran-H、Topmark、Vedrantais、PMR 45、Nantais Oblong的叶片均布满白粉,个别单株茎部有白粉,均表现为感白粉病。Iran-H、Topmark、Vedrantais、PMR 45、Nantais Oblong表现为感病,PMR6、Edisto 47、PI 124112、PI 414723、PMR 5、MR-1、WMR 29、PI 124111的发病指数为0,表现为抗病,根据表1中13个鉴别寄主对白粉病不同生理小种的抗、感反应对比,即可确定优势生理小种为单囊壳白粉菌Race2中的2France(表4)。
2.4 抗白粉病甜瓜品种的筛选
接种后5 d,玉姑、苏甜2号的叶片即出现白粉病病斑;接种后7 d,西州密25叶片开始出现白粉病病斑,苏乾1号叶片也出现点状病斑。第12天时调查统计的发病情况及病情指数(图4,表5)显示,玉姑、西州密25、苏甜2号的病情级别处于1~4级,病情指数分别为56.37、49.04、58.54,表现为感白粉病(SR);T9(苏乾1号)发病级别为1~2级,病情指数为23.67,表现为中抗白粉病(MR),苏乾4号(T4)、苏乾5号(T5)、1911ME133(T7)、1911ME134(T8)等4个品种的叶片、茎部均未发现白粉病病斑,表现为抗白粉病(R)。
2.5 白粉病菌对不同抗性甜瓜材料生理生化指标的影响
2.5.1 丙二醛含量的动态变化 由图5可知,接种白粉病菌后,MDA含量均表现出先升后降的趋势,在72~120 h达到峰值, 且在168 h植株中MDA含量均高于接种前的水平,4个抗病品种(苏乾4号、苏乾5号、1911ME133、1911ME134)较0 h平均增加33.33%,中抗品种苏乾1号增加37.5%,3个感病品种(玉姑、苏甜2号、西州密25)平均增加60.96%;不同抗性材料的MDA含量表现为抗病品种(苏乾4号、苏乾5号、1911ME133、1911ME134)<中抗品种(苏乾1号)<感病品种(玉姑、苏甜2号、西州密25)。说明抗白粉病品种抗膜脂过氧化作用的能力要强于感病品种,且在168 h后细胞膜结构和功能已经恢复接近正常水平。


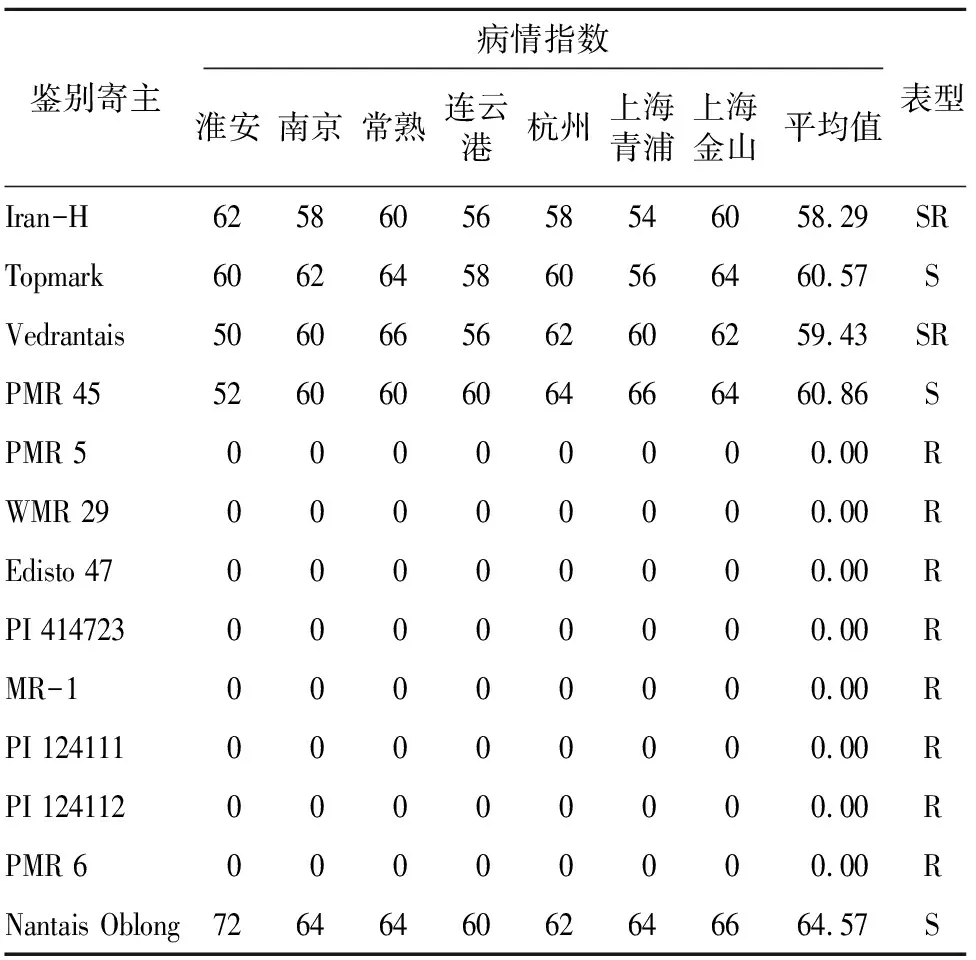
表3 甜瓜白粉病菌鉴别寄主病情指数及抗感表型
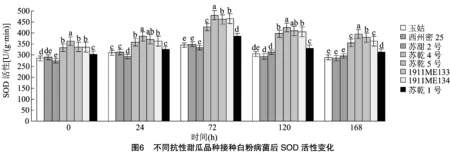
2.5.2 白粉病菌对超氧化物歧化酶活性的影响 由图6可知,接种白粉菌前感病品种(玉姑、苏甜2号、西州密25)的SOD活性低于抗病品种(苏乾4号、苏乾5号、1911ME133、1911ME134),接种后,不同抗性品种中的SOD活性均升高,在72 h时达到高峰,之后逐渐降低;在72 h时,4个抗病品种的SOD活性平均值是感病品种(玉姑、苏甜2号、西州密25)的1.34倍,是中抗品种苏乾1号的1.19倍;抗病品种的SOD活性上升幅度较大,在72 h时,4个抗病品种的SOD活性平均值较接种前增加了33.84%,而感病品种接种后其SOD活性的上升和下降趋势均较平缓,在72 h时,3个感病品种的SOD活性平均值较接种前增加了20.98%。表明接种白粉菌后,为尽快减少病菌对植株造成的损害,抗病品种植株中的SOD活性被迅速激活,直至168 h时仍处于较活跃的状态以保护植株。

表4 瓜类白粉病优势生理小种类型的判定结果
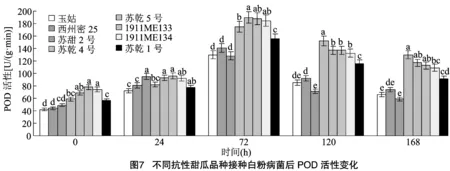
2.5.3 白粉病菌对过氧化物酶活性的影响 由图7可知,接种后,不同抗性品种POD活性均呈现先上升后降低的趋势。在72 h时达到最高峰,此时4个抗病品种(苏乾4号、苏乾5号、1911ME133、1911ME134)的POD活性平均值是感病材料的1.38倍,是中抗品种苏乾1号的1.18倍;感病品种(玉姑、苏甜2号、西州密25)的POD活性下降趋势>中抗品种>抗病品种,在168 h时,抗病品种POD活性平均值较72 h高峰期下降36.41%,感病品种下降50.38%。在接种0~24 h,抗病品种(苏乾4号、苏乾5号、1911ME133、1911ME134)的POD活性略高于感病品种(玉姑、苏甜2号、西州密25),而在接种后72~168 h,两者的POD活性数值差距明显增大,表明在受到白粉病菌侵染后,细胞组织受到损伤,为修复细胞壁损伤,POD活性迅速升高,以促进细胞愈合;抗病品种的POD反应更强且更持久,因此抵抗力更强。


表5 不同甜瓜品种接种白粉病菌的发病指数及病情鉴定

3 讨论
3.1 白粉病菌生理小种的鉴定
本试验对采集自江苏及杭州、上海等地区的甜瓜、南瓜、黄瓜等不同瓜类作物上的白粉病菌进行生理小种鉴定,首先利用显微镜观察及ITS核酸序列比对,结果证实这些地区不同瓜类作物上的白粉病菌为单囊壳白粉菌。采用国际通用的白粉病菌鉴定体系进行苗期接种鉴定,结果为P.xanthiiRace2 2France,未发现其他生理小种类型。
发达国家对瓜类白粉病菌的种类与生理小种有较长时间和较大范围的监控,苏丹中心地区夏季发现了单囊壳白粉菌的生理小种 1,冬季则发现了生理小种 2,并认为在同一地区白粉病流行的生理小种的转变可能受环境条件影响[9]。在美国东南部香瓜上单囊壳白粉菌族群由生理小种 2 向生理小种 1 演替[10]。我国地域辽阔,各地白粉菌生理小种类型和优势小种不尽相同,随着环境和种植作物的变化,不断出现新的生理小种类型,且优势小种也会随之不断地发生变化。李苹芳从江浙沪地区甜瓜植株上采集了9份白粉病菌进行鉴定,确认这9个地区甜瓜白粉病菌为P.xanthiiRace1[11]。顾海峰等的研究表明,上海地区西瓜、甜瓜上存在2个生理小种,即P.xanthiiRace 1和Race 2 France,且Race 1是生产上的优势生理小种[12]。Xu等研究认为,P.xanthii生理小种 2 是引起浙江地区甜瓜白粉病的主要小种[13]。本研究结果与之不尽相同,可能是这些地区白粉菌生理小种类型已逐渐发生变化,P.xanthiiRace 2 France目前已成为该地区的优势生理小种。因此,长期监测瓜类蔬菜作物白粉病菌生理小种类型,扩大采样范围及采样作物种类,可以为瓜类抗白粉病育种及生产提供理论依据[14]。
3.2 不同甜瓜品种白粉病苗期抗性
不同甜瓜品种白粉病苗期抗性试验结果表明,玉姑、苏甜2号接种后第5天开始发病,第12天叶片布满病斑,属于感白粉病品种,在田间生产中要预防白粉病发生,并做好及时防控;西州密25、苏乾1号接种第7天叶片出现白粉病病斑,第12天时,西州密25的发病指数为49.04%,表现为中感白粉病,苏乾1号的发病指数为23.67%,属于中抗白粉病品种,在设施栽培中均需做好白粉病预防和防治工作;苏乾4号、苏乾5号、1911ME133、1911ME134等4个品种的叶片、茎部均未发现白粉病病斑,属于抗白粉病品种,可在设施条件下引种试种。
近年来,我国甜瓜保护地栽培面积日益扩大,保护地高温高湿的环境易造成病害流行,白粉病是危害甜瓜保护地栽培的重要病害之一,因此引进和培育抗白粉病甜瓜品种具有重要意义[15]。
3.3 白粉病菌对抗感材料生理生化指标的影响
植物受到病原菌侵染后,体内会发生一系列复杂的生理生化变化,POD、SOD 等保护酶可以通过分解病原菌、溶解菌丝体、并通过清除自由基减轻膜脂过氧化引起的膜损伤来维持细胞膜的正常生理功能[16],MDA的含量可反映细胞脂质过氧化的水平以及生物膜受损伤的程度,是判断膜脂过氧化作用的一个重要指标[17]。因此,植株体内丙二醛、过氧化物酶、超氧化物歧化酶等防御酶活性的变化,可作为植物抗逆性强弱的一项重要指标[18]。本试验研究发现,接种白粉病菌后,不同抗性的甜瓜品种POD、SOD活性均呈现先上升后下降的趋势,抗性品种植株中的SOD、POD活性和增幅均高于感病材料,且在72~168 h时差异显著。与张慧君等对甜瓜、西葫芦等作物接种白粉病菌后抗病品种的SOD、 POD活性及变化趋势[18-19]相似。但与王迪对不同抗性甜瓜品种接种白粉病菌后POD活性的变化结果[20]不一致,其发现感病材料(DQ12)的POD酶活性一直高于抗病材料(DQ);而SOD研究结果相似,均表现为接种后抗感材料中的SOD活性上升,且抗病材料中的SOD活性大于感病材料。杨瑞平研究表明接种白粉病菌后,抗白粉病材料Yuntian930中SOD、POD活性升高幅度大于感病材料0544,且均在48 h时达到高峰;而抗病材料Yuntian 930的MDA含量在接种后呈现先上升后下降再上升的趋势,24 h时达到峰值,而0544的变化趋势是先降低再持续升高,48 h后持续高于Yuntian930[15]。王建明等发现,西瓜苗期感染枯萎病菌后,抗病品种克伦生根部的MDA含量在接种后1 d时高于感病品种早花,之后迅速下降,显著低于感病品种早花,表明抗病品种克伦生对枯萎病菌的侵染较感病品种更加敏感,但其自我调节、恢复正常状态及抗膜脂过氧化的能力较感病品种强[22]。
综合前人的研究结果与本研究结果可知,不同植物应对病原菌侵染时表现具有差异,其SOD、POD等防御酶活性及MDA含量等变化也不尽相同。本研究表明,接种白粉病菌后,抗性材料POD、SOD活性与植株的抗性呈正相关,MDA含量与抗性呈负相关。
