重瓣萱草AGAMOUS基因的克隆与表达分析
2023-01-10张志国丁寒雪蒋成娣张世杰王艺程秦巧平
张志国, 丁寒雪, 蒋成娣, 张世杰, 王艺程, 秦巧平, 刘 翔
(1.上海应用技术大学生态技术与工程学院,上海 201400; 2.金华花卉苗木产业研究院,浙江金华 321000)
花发育的ABC模型是一种成花模型,描述了在花的不同部位,不同转录因子对花器官形成的作用。其中C类基因主要控制心皮、雄蕊的发育,AGAMOUS(AG)是拟南芥(Arabidopsisthaliana)中唯一的C类基因,也是第一个被分离的MADS-box基因[1]。迄今,人们已经从不同植物中克隆并鉴定了很多AG同源基因,尽管这些基因在序列上存在些许差异,但功能是基本保守的[2]。AG基因的主要功能包括以下几个方面:抑制A功能基因在第3轮、第4轮中的异常表达;在前期调控雄蕊、心皮和胚珠的正常发育;在后期控制细胞分化,终止花分生组织的分化以保证花器官的特征和数量[3]。1990年Yanofsky等通过T-DNA插入突变技术,获得了AG基因突变的重瓣表型拟南芥(图1),其6枚雄蕊被6枚花瓣取代,与4枚正常的花瓣形成了具有10枚花瓣的突变体,而心皮也被4枚萼片和10枚花瓣取代,具有花中花的整体表型[1];同年,Carpenter等通过转座子诱变试验,获得了10种花器官同源异型突变的金鱼草(Antirrhinummajus),其中pleniflora-624、pleniflora-625和pleniflora-626的表型非常相似,第1轮、第2轮花器官表型与野生型相同,第3轮花器官变为花瓣状结构,且与第2轮花瓣结合在一起,第4轮花器官由2个部分组成,在野生型金鱼草心皮相对应的位置产生加厚卷曲表面蜡质的花瓣状结构,且在第4轮内有5个瓣状结构轮生[4]。1991年Coen等总结了花器官特异基因在植物4轮结构中的表达情况,并提出花发育的ABC模型,为植物花发育生物学的研究带来了里程碑式的突破[5]。之后,随着D类基因[6]及E类基因[7]的发现,花发育ABC模型不断得到补充完善。
萱草(Hemerocallisfulva)是阿福花科(Asphodelaceae)萱草属(Hemerocallis)多年生草本植物,花被片数量通常为6枚,排成2轮,外轮花被片即萼片,未开放时在花蕾外起到保护作用,颜色通常较浅,内轮花被片较外轮花被片稍大,花色鲜艳,雄蕊通常与花被片同数,子房上位常3室,即萱草共有4轮花器官,由外向内数,第1轮为花萼,第2轮为花瓣,第3轮为雄蕊,第4轮为心皮[8]。我国是萱草属植物的自然分布中心,已有3 000多年的种植历史,世界萱草育种历经1个世纪的发展,如今已经取得了卓越成就,但是目前应用于园林景观的仅有少数几个单瓣品种,因此萱草花型的补充改造是其育种的重要研究目标之一。随着花卉基因工程研究的深入开展,人们相继从萱草中分离了生物钟相关基因HcLHY[9]与成花相关基因HkTFL1、HkSVP、HkAP1[10]、糖转运蛋白相关基因HfSWEET2a[11]、衰老相关HhNAC1基因[12]等,但是对于花发育中极其重要的AGAMOUS基因在萱草中的研究尚未见报道。萱草1轮3枚花被片共2轮的单瓣表型为人们所熟知,然而随着育种工程的发展,也产生了一些重瓣表型,产生重瓣表型的原因是否与AGAMOUS突变有关仍不得而知。笔者所在课题组在转录组测序和基因组测序数据的基础上,从单瓣萱草品种秋红、重瓣材料AH6中对C类同源基因HfAG进行克隆、多序列对比分析、理化性质分析、系统进化分析和生物信息学分析,为进一步探究萱草花器官形成过程中上述基因发挥的功能提供理论基础,从而为萱草花型变异机制的研究和通过基因工程手段开展萱草重瓣育种研究奠定基础。

1 材料与方法
1.1 植物材料
供试材料采自上海应用技术大学国家萱草种质资源库(地理位置:121°5′E、30°8′N),单瓣品种名称为秋红(图2),重瓣材料田间编号为AH6(图3),于2021年7—8月盛花期采集其未开放的花蕾(直径在0.5~0.8 cm之间),分离得到花萼、花瓣、雄蕊和心皮以及四者的混合样,共10份样品,于液氮中速冻后于-80 ℃保存,用于后续RNA的提取。

1.2 试验方法
1.2.1 总RNA的提取与cDNA第1条链的合成 分别以萱草秋红、AH6的花蕾混合样为材料,用RNApre Pure Plant Kit(Polysacchairdes & Polyphenolics)试剂盒提取总RNA,用NanoDrop One超微量紫外分光光度计检测RNA的纯度、浓度,用1.0%琼脂糖凝胶电泳检测RNA的完整性,再以总RNA为模板,用M-MLV转录酶[购自宝生物工程(大连)有限公司],以Oligo(dT)为引物,反转录合成cDNA第1链,将获得的cDNA于-20 ℃保存。

1.2.2HfAG基因的克隆 参考笔者所在课题组前期建立的萱草秋红全长转录组库,筛选AG的同源基因序列,设计引物(表1)。以cDNA为模板,使用TaqDNA聚合酶[购自宝生物工程(大连)有限公司]进行PCR扩增。20 μL PCR扩增体系:2 μL 10×TaqBuffer with KCl,1.6 μL MgCl2(25 mmol/L),0.2 μLTaqDNA聚合酶(5 U/μL),0.4 μL dNTP(10 mmol/L),1 μL Primer-F(10 μmol/L),1 μL Primer-R(10 μmol/L),1 μL模板DNA,12.8 μL ddH2O。PCR反应程序:95 ℃ 5 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,35个循环;72 ℃ 10 min。
1.2.3 目的基因的回收连接转化与测序 将PCR产物用1%琼脂糖凝胶电泳检测扩增效果,对检测结果合格的PCR产物进行电泳分离,随后用DNA凝胶回收试剂盒(上海碧云天生物技术有限公司)进行回收。将PCR纯化产物连接到pMD19-T载体[宝生物工程(大连)有限公司]上,转化大肠杆菌DH5α,挑取单菌落进行菌液PCR检测,随后对阳性菌落进行基因测序。
1.2.4 实时荧光定量PCR 以萱草材料秋红、AH6同一花蕾的不同器官(萼片、花瓣、雄蕊、心皮)为材料提取的RNA为模板,用Vazyme公司的逆转录试剂盒(HiScript® Ⅲ RT Su perMix for qPCR)合成cDNA第1链。根据cDNA序列设计上、下游定量引物,HfAG基因和内参基因的引物序列见表1,其中内参基因是萱草最优内参基因HfGAPDH[13],每个样品设置3个重复,使用荧光定量试剂盒(ChamQ Universal SYBR qPCR Master Mix)进行荧光定量PCR。设置3个生物学重复和3次技术重复,用2-ΔΔCT法[14]对基因进行相对定量分析。反应体系:10 μL SYBR qPCR Master Mix、0.4 μL上游引物、0.4 μL下游引物、2 μL cDNA模板,用dd H2O补至 20 μL。扩增程序:95 ℃ 30 s,95 ℃ 10 s,56 ℃ 30 s,72 ℃ 30 s,40个循环,熔解曲线为95 ℃ 15 s,56 ℃ 1 min,95 ℃ 15 s。
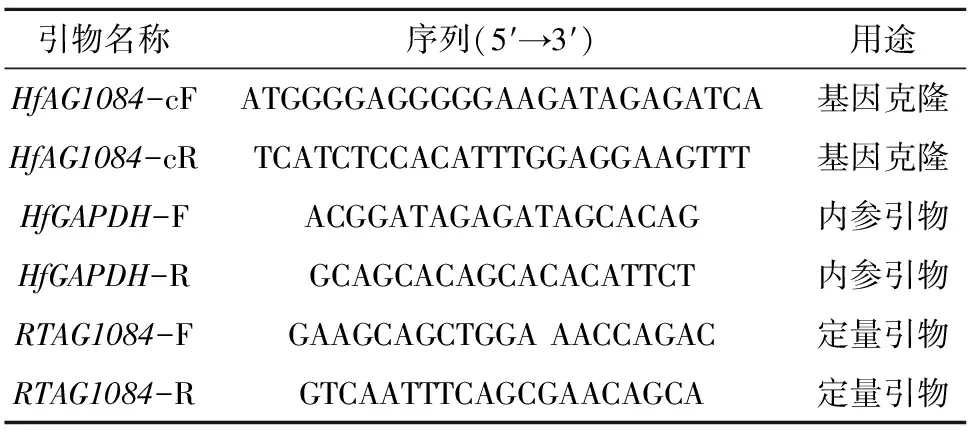
表1 ahHfAG蛋白PCR与定量PCR的引物序列
1.2.5 生物信息学分析 用DNAMAN软件分析阳性菌落的测序结果,用Primer Premier 5.0软件将核苷酸序列蛋白质编码区翻译成氨基酸序列,对蛋白进行理化性质、保守结构域、亲水性疏水性、二级结构、亚细胞定位等方面的预测和分析。基于MEGA version 7,采用邻接法构建蛋白的系统发育进化树,分析与其他物种的亲缘关系。具体分析内容和工具见表2。
2 结果与分析
2.1 基因克隆与序列分析
本研究以HfAG1084cF/cR为引物,分别以萱草秋红、AH6的花蕾混合样为材料提取RNA,反转录得到cDNA为模板进行PCR扩增。PCR产物经凝胶电泳检测,在700 bp附近出现1条特异条带(图4),与预测片段大小吻合,片段在回收后的测序结果表明,最终得到2个MADS-box基因的CDS序列。

表2 生物信息学分析网站及软件

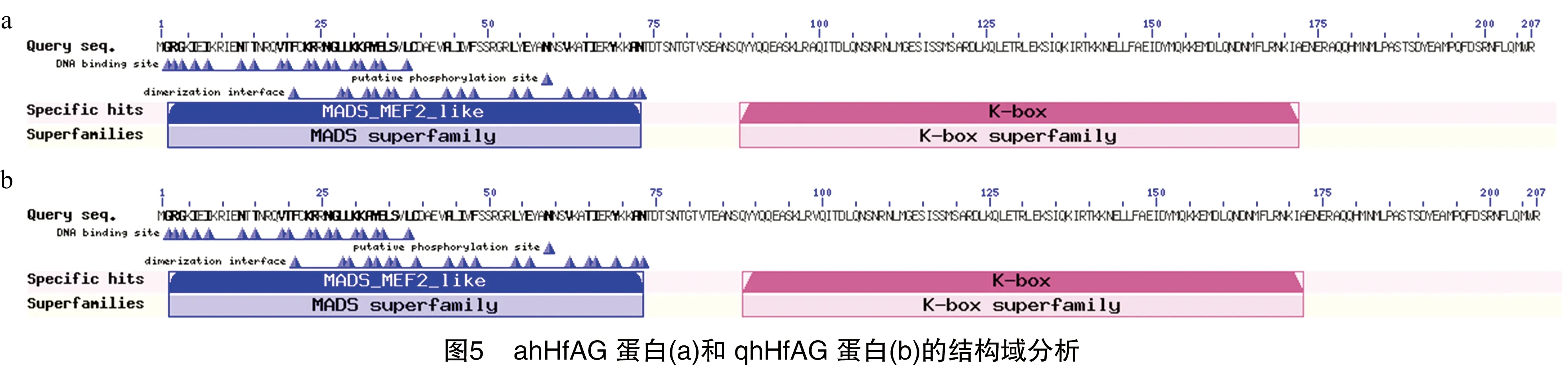
测序结果表明,ahHfAG的序列长度为624 bp。对序列进行多序列对比和结构域分析,结果(图5)表明,ahHfAG具有典型的植物MADS-box基因结构,编码肽链具有2个保守结构域,即MADS区(2~73 aa)、K区(88~172 aa)。MADS区、K区属于MIKCc型基因特征基序[15],MADS区、K区之间为长度为14个氨基酸的Ⅰ区,在二聚体的选择性形成过程中起着关键作用[16],而C端区域是位于K区下游保守性最低的转录激活区区间。虽然C末端的变化较大,但是MADS-box蛋白常含有一些保守基序,AGAMOUS基因有AG基序Ⅰ、Ⅱ这2个相对保守区[2,17],高志红等认为,这2个相对保守区是AG同源基因的特征之一[17-18]。
通过ProtParam软件对萱草AG编码氨基酸序列的理化性质进行预测,得到qhHfAG、ahHfAG编码蛋白质的分子式、理论分子质量、等电点、总平均疏水性和不稳定性指数等。ahHfAG编码蛋白质的总平均疏水性为-0.843,属于亲水蛋白,不稳定性指数为45.84,为不稳定蛋白;qhHfAG编码蛋白质的总平均疏水性为-0.855,也属于亲水蛋白,不稳定性指数为46.25,为不稳定蛋白(表3)。两者的疏水性和不稳定性略有差异。亚细胞定位预测结果显示,萱草ahHfAG和qhHfAG编码的蛋白定位于细胞核中,可知该蛋白合成后不需要分泌到细胞外,而是进入细胞核中。
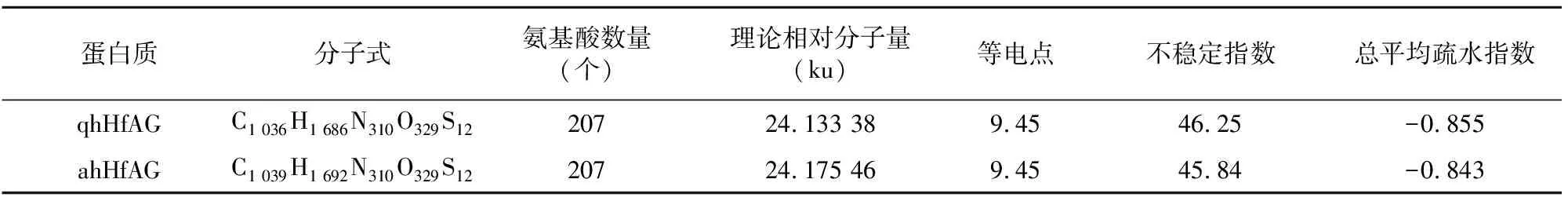
表3 qhHfAG和ahHfAG编码蛋白质的一级结构分析
2.2 同源性对比分析
将AG同源蛋白ahHfAG的氨基酸序列与美国国家生物技术信息中心(NCBI)数据库中已知的序列进行比较分析。结果显示,ahHfAG蛋白与玉簪(Hostaplantaginea)的HopAG(ACB70410.1)、莲(Nelumbonucifera)的NenAGL(XP_010272685.1)、麝香百合(Liliumlongiflorum)的LMADS10(AIJ29174.1)、小兰屿蝴蝶兰(Phalaenopsisequestris)的PeAGL(XP_020582512.1)等有较高的一致性,都在80%以上,其中与玉簪的HopAG(ACB70410.1)蛋白一致性最高,达88.78%,与拟南芥(Arabidopsisthaliana)的AG(AT4G18960)一致性为59.13%。
将重瓣萱草AG同源基因ahHfAG和单瓣萱草AG同源基因qhHfAG相比,发现有2个位点发生突变。一是第247位碱基,其突变导致位于保守性较低的Ⅰ区的第83位氨基酸产生变化,在单瓣品种秋红中为丝氨酸(Ser),而在重瓣萱草AH6中为苏氨酸(Thr)。另一个是第296位碱基,其突变导致位于半保守的K区的第99位氨基酸发生变化,在单瓣品种秋红中为丙氨酸(Ala),而在重瓣萱草AH6中为缬氨酸(Val)。
图6是ahHfAG与qhHfAG编码的蛋白质和一致性靠前的4个不同物种蛋白质序列的BLAST比较分析结果。可以看出,氨基酸序列5′端的保守性比较高,而3′端的保守性比较低。且ahHfAG与qhHfAG缺少C末端AG基序Ⅱ这个相对保守区。

2.3 系统进化分析
在NCBI中用ahHfAG蛋白进行BLASTp比对,选取不同物种中已经确认的C功能MADS-box蛋白的氨基酸序列(序列信息见表4)构建系统进化树(图7)。可以看出,AmFAR、TAG1、HmAG、PgAG2、GhMADS10和AG归为1支,属于euAG同源蛋白;FBP6、LAG、SHP1、SHP2和PLE归为1支,同属于PLE同源蛋白;而ahHfAG基因的蛋白序列则与其他序列一同被归于AG同源蛋白,即萱草的ahHfAG基因属于AG谱系。此外,萱草与天门冬目的植物聚于1支,且与扫帚芦笋(Asparagusvirgatus)的亲缘关系最近,这也与同源性对比结果一致。
2.4 ahHfAG和qhHfAG基因的蛋白二级结构预测
用SOPMA在线分析工具对ahHfAG和qhHfAG编码蛋白序列的二级结构进行分析。由表5可以看出,HfAG蛋白以α-螺旋结构为主,其次为无规则卷曲结构,延伸链占比较少,占比最少的是β-转角,其中α-螺旋结构主要集中在K区。

表4 部分被子植物C类MADS-box蛋白
相较于qhHfAG基因,ahHfAG基因编码蛋白在M区的第10位由α-螺旋变为β-转角,在M区的第56位由延伸链变为α-螺旋;ahHfAG基因编码蛋白在K区的第140~141位由无规则卷曲、延伸链变为α-螺旋;保守性最低转录激活区(C区)的第174~178位由α-螺旋变为无规则卷曲结构,第184位由α-螺旋变为无规则卷曲,第194~197位由α-螺旋变为无规则卷曲,第201~203位由无规则卷曲变为α-螺旋。
2.5 ahHfAG和qhHfAG编码氨基酸的疏水性分析
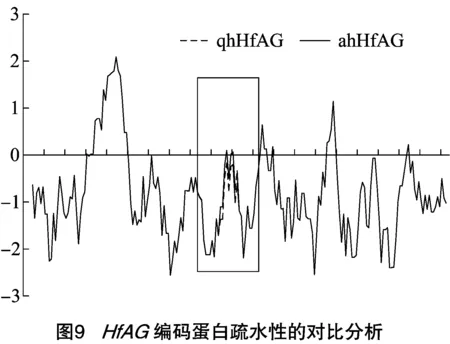
使用在线工具ProtScale对qhHfAG编码的氨基酸进行疏水性分析,结果表明,该肽链第45位点上的L疏水性最强,分值为2.089,而第71位点上的K亲水性最强,分值为-2.556,预测qhHfAG编码的氨基酸疏/亲水性值总和为-170.621,因此认为该蛋白是亲水性蛋白。而ahHfAG编码氨基酸的疏水性最高值、最低值都没有变化,但从第80~88位、第96~104位开始疏水性明显升高,总和变为-168.12(图9)。
2.6 ahHfAG编码蛋白的表达分析
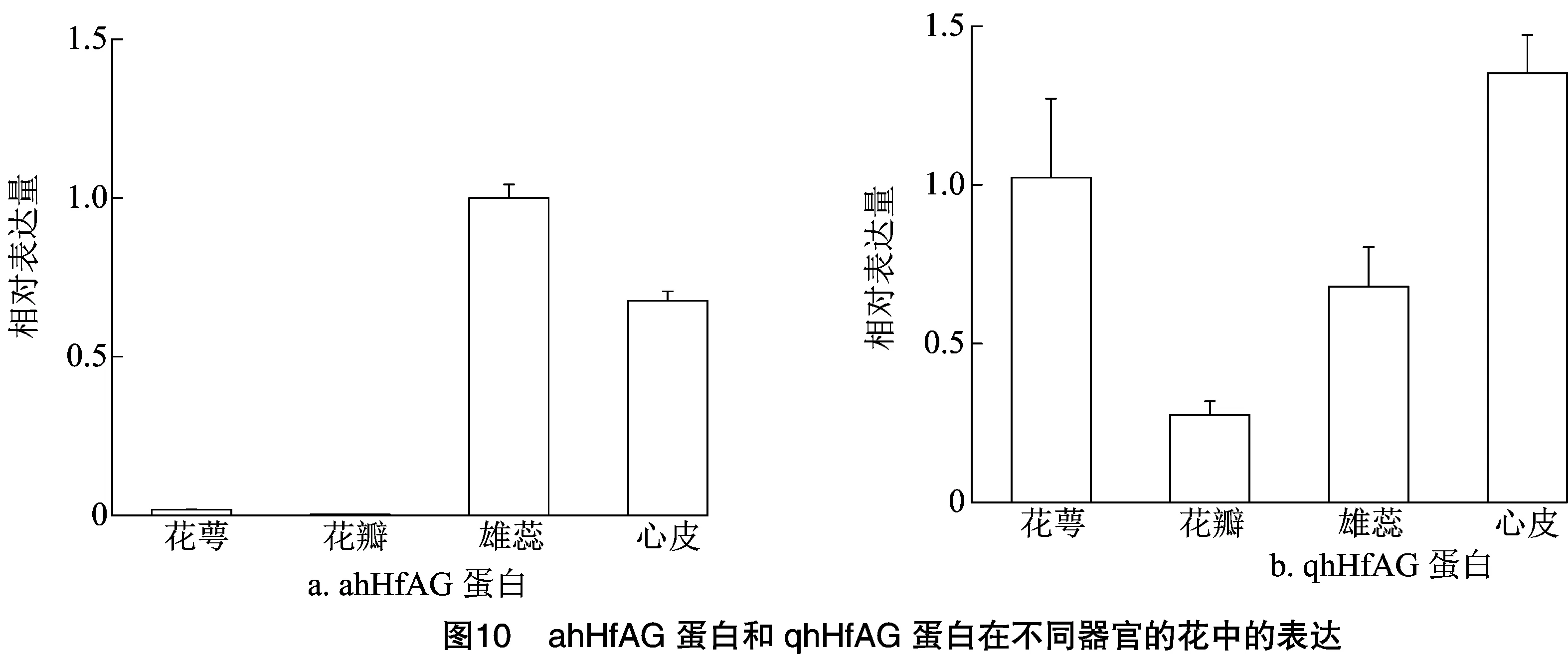
为了研究AG编码蛋白的表达模式,以单瓣品种萱草秋红、重瓣萱草AH6的同一花蕾不同花器官的cDNA为模板,以HfGAPDH为内参基因,用qRT-PCR技术对ahHfAG编码蛋白在萱草不同器官中的表达量进行分析。由图10 qRT-PCR结果表明,ahHfAG蛋白在萱草的雄蕊、心皮中均有较高的表达量,在花萼、花瓣中的表达量较低,推测该基因可能为特异性表达基因。其次,在单瓣品种秋红中,qhHfAG蛋白在4轮花器官中均有表达,且在第1轮花萼中表达明显,但是在重瓣萱草AH6中,表达范围显著收缩,在1、2轮花器官中几乎不表达。这种表达模式与ABC模型中C类基因的表达模式较为符合。上述结果表明,HfAG基因在萱草花器官发育过程中发挥着重要作用,且在不同植物中功能较为保守。
3 讨论与结论
本研究以萱草单瓣品种秋红、重瓣材料AH6为试验材料,用RT-PCR技术克隆了C类基因AGAMOUS的全长序列,用生物信息学软件分析其序列信息,通过实时荧光定量PCR技术分析表达模式。结果表明,AGAMOUS基因作为C类功能基因可调控雄蕊、心皮和胚珠的正常发育,在植物花器官中均有表达,但在不同器官中的表达量存在差异。研究重瓣花的驯化过程可以发现,C类基因的功能丧失和表达收缩都会引起生殖器官的缺失,促进额外花瓣的形成,形成重瓣花。Dubois等通过研究1个由重瓣变为单瓣的月季(Rosahybrida)突变体发现,重瓣月季的形成与C类基因RhAG表达范围缩小有关[19]。在重瓣品种中,RhAG的表达仅限于花芽的中心部位;而在单瓣突变体中,RhAG的表达范围更大。从qRT-PCR结果可以看出,在单瓣品种秋红中,qhHfAG蛋白在4轮花器官中均有表达,且在第1轮花萼中表达明显,但是在重瓣材料AH6中,表达范围显著收缩,在1、2轮花器官中几乎不表达。该研究结果与AGAMOUS基因在其他植物中的研究结果相似。

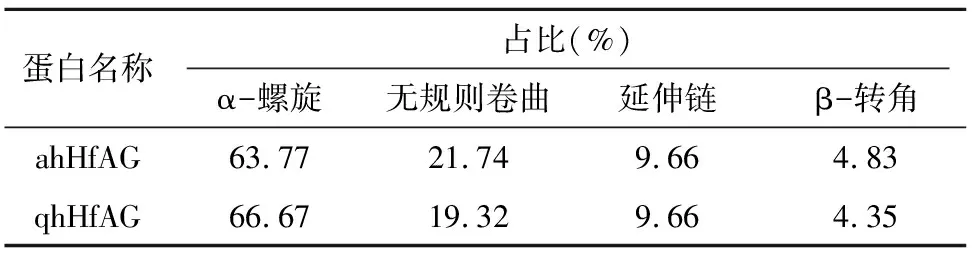
表5 萱草AG同源基因的二级结构预测分析结果

AGAMOUS基因具有典型的植物MADS-box基因结构,即MADS区(M区)、间隔区(I区)、角蛋白类似区(K区)和C末端区(C区)[20]。MADS区(第1~72位)含有C-A/T rich-GC(CArG)基序,是AG与其他DNA结合所必需的结合基元[21],也是MADS-box基因中最保守的区域[22]。半保守的K区(第88~172位)是由疏水的氨基酸残基规律性的间隔排列组成的coiled-coil结构,能够折叠形成3个连续的两性α-螺旋K1、K2、K3,参与有选择性地介导蛋白与蛋白之间的相互作用[20]。在本研究获得的萱草HfAG中,具有MADS区、K区这2个保守结构域,可以推测HfAG基因也是通过与其他基因结合来共同调控花器官发育的。Galimba等下调唐松草(Thalictrumthalictroides)栽培品种双白的AG同源基因ThtAG1的表达,导致转录组无意义衰退和选择性拼接,最终致使其蛋白的K区丢失,形成重瓣花[23]。在星花木兰(Magnoliatomentosa)中,MastAG基因发生选择性拼接,形成2种非正常的转录蛋白mastag-2蛋白(I区、K区缺失)和msatag-3蛋白(K区和C区缺失),导致星花木兰的花瓣数增加[24]。但是本研究发现,ahHfAG编码蛋白具有较为完整的MADS-box基因结构,因此材料AH6重瓣的原因不是保守结构域的丢失。C区是位于K区下游的转录激活区区间[2],AG基因编码产物结合形成同源二聚体,或者与其他MADS家族基因编码的蛋白质结合形成异源二聚体,然后特异地结合到靶基因DNA调控区,通过C末端与其他二聚体结合形成四聚体,再绑定到靶基因上游,调控下游靶基因的表达,指导花器官的形成。Mizukami等通过异位表达试验表明,C末端对AG转录因子功能的正常发挥具有重要影响[25]。C末端保守性最低,但是常含有AG基序Ⅰ、Ⅱ这2个相对保守区。Liu等从单瓣和日本晚樱(Prunuslannesiana)的栽培变种Alborosea中各分离出来1个AG基因的异构体[26],重瓣品种的Prseag-1与单瓣品种的PrseAG相比有1个 170 bp 的外显子跳跃且表达范围更广泛。Prseag-1可能因为C末端的AG基序Ⅰ、Ⅱ丢失而丧失了C类基因的功能,从而使雄蕊转变成花瓣,雌蕊转变成叶状结构。不过在本研究得到的CDS序列中,ahHfAG、qhHfAG编码肽链只含有AG基序Ⅰ而没有AG基序Ⅱ。尽管AG基序的丢失可能会造成C类基因功能的丧失,从而形成重瓣花,但是对比单瓣、重瓣萱草序列可以发现,二者均缺失基序Ⅱ,说明该基序Ⅱ的缺失并不是造成重瓣的根本原因。通过二级结构预测的对比可以发现,氨基酸的突变导致基序Ⅰ(第196位到第207位)二级结构第 194~197位由α-螺旋变为无规则卷曲,第 201~203位由无规则卷曲变为α螺旋。或许基序Ⅰ对于重瓣表达有更重要的作用,这可能是产生重瓣的原因之一。根据系统进化树可以看出,ahHfAG基因属于AGL亚家族中C类基因的AG谱系,参与雄蕊、心皮的发育,与扫帚芦笋的亲缘关系最近,说明其遗传背景较为相似。ahHfAG基因与qhHfAG基因序列有2个氨基酸的差异,该差异导致蛋白质二级结构、三级结构及疏水性发生变化,这也许是导致花型变异的一个内在因素。接下来可以将ahHfAG基因转入拟南芥和烟草中,进行进一步的功能鉴定。
本试验克隆的萱草HfAG基因为研究观花植物的重瓣机制奠定了基础,同时也为进一步通过基因工程开展萱草重瓣新品种育种提供了理论和试验依据。
