三七总皂苷对人根尖牙乳头干细胞增殖的影响
2023-01-09钱石兵孟明耀于鸿滨段开文李昌全夏志刚
钱石兵 ,孟明耀 ,于鸿滨 ,段开文 ,李昌全 ,夏志刚
(1)昆明医科大学附属延安医院 口腔科,云南 昆明 650051;2)中心实验室,云南 昆明 650051)
根尖牙乳头干细胞(stem cells from apical papilla,SCAPs)源自于根尖孔尚未闭合的恒牙牙根末端软组织,被发现含有一群大量未分化的细胞并且证实属于间充质干细胞来源,因为hSCAPs 同样能够自体更新、增殖以及多系分化。而且被视作是口腔再生医学疗法更具前景和优势的一类牙源性干细胞[1-4]。三七是一味传统中药,主要成分为三七总皂苷(Panax notoginseng saponins,PNS),临床上可治疗全身系统的多种疾病。多年来研究发现PNS 具有抗癌、降脂、保护神经元与内皮细胞、促进骨损伤修复以及抗纤维化等作用,而且PNS 对多种细胞的增殖都有积极的作用[5-7]。但关于PNS 对hSCAPs 增殖的影响尚未见报道。因此,设计本实验初步探究PNS 对hSCAPs 增殖的影响,进一步拓展PNS 的药用价值,以期为hSCAPs 治疗口腔硬组织缺损疾病等提供研究基础。
1 材料与方法
1.1 主要试剂与仪器
0.25 %胰蛋白酶(BI,德国);磷酸盐缓冲液(PBS,索莱宝);α-MEM 培养基(Gibco,美国);胎牛血清(BI,德国);CCK-8(Proteintech,美国);Human MSC Analysis Kit(BD,美 国);Human MesenCult™ Osteogenic Differentiation Kit(Stemcell,加拿大);Human MesenCult™ Adipogenic Differentiation Kit(Stemcell,加拿大);三七总皂苷(索莱宝);茜素红(索莱宝);油红O(索莱宝);细胞周期和细胞凋亡检测试剂盒(碧云天);酶联免疫检测仪(Thermo,美国);流氏细胞仪(BD,美国)。
1.2 hSCAPs 的分离、培养及鉴定
经昆明医科大学附属延安医院伦理委员会审批通过,患者监护人签字同意,在口腔外科收集新鲜拔除、无牙体牙髓及牙周疾病且根尖未发育完全的第3 磨牙。迅速用含2%双抗的α-MEM培养基保存放入冰盒中,随即在细胞工作间中处理标本。用含2%双抗PBS 冲洗彻底清除血凝块并刮除根面软组织,切取根尖牙乳头放入培养皿中,眼科剪和镊子配合下将组织剪成微小的组织块,分散组织块倒置放入37 ℃细胞培养箱中温育15 min,加入含20%FBS 的培养基,动作轻柔勿使组织块浮起,每3 d 换液,待细胞大量爬出后消化细胞传代扩大培养。
流式细胞术鉴定:取第4 代hSCAPs 消化、离心,PBS 重悬,制备成单细胞悬液计数备用。以每管5×105个细胞数加入流式管内,根据试剂操作说明,加入CD11b、CD19、CD34、CD45、HLA-DR、CD73、CD90、CD105 抗体,避光孵育30 min。加入鞘液清洗一遍,弃上清,然后加入200~300 µL 的鞘液上机,检测细胞表面抗原,进行免疫表型分析。
1.3 hSCAPs 成骨、成脂向分化
取第4 代hSCAPs,每孔5×105个细胞接种于6 孔板内,待细胞融合在80%以上时更换成骨诱导液和成脂诱导液,对照组正常培养,连续培养3 周后吸弃培养基并用PBS 漂洗,加入70%乙醇固定细胞2 h,PBS 洗3 遍,加入茜素红和油红O 染色5 min,倒置显微镜下观察染色的面积大小以及颜色深浅。
1.4 CCK-8 检测不同浓度PNS 对hSCAPs 增殖能力的影响
将10 mg PNS 溶于10 mL 完全培养基配制浓度为1 mg/mL 的PNS 母液,将培养基稀释为25 mg/L、50 mg/L、100 mg/L、200 mg/L,未 加PNS 为空白对照组。取第3 代细胞按每孔2 000 个细胞数接种于96 孔板,每组设置6 个复孔,α-MEM 培养基培养5 h,待细胞基本贴壁后,实验组更换含不同浓度的PNS 培养液,对照组正常培养,2 d 换液。在第l、3、5、7 天固定时间取出一板细胞,PBS 漂洗两次,CCK-8 液与培养基按照1∶9 配制,每孔加入100 µL 孵育液,37 ℃避光孵育2 h,酶标仪450 nm 波长下检测OD 值,绘制hSCAPs 的增殖曲线。
1.5 最适浓度下检测PNS 对细胞周期的影响
标准条件下用6 孔板培养对照组和25 mg/L组,第4 天时用胰酶消化细胞并收集到离心管内,1 000 g 离心5 min 后弃液,加入1 mL 预冷的PBS 混匀细胞后转移至1.5 mL 离心管。第2 次离心弃液,加入1 mL 预冷的70%乙醇混匀细胞,4 ℃条件下充分固定12 h。第3 次离心弃液,加入1 mL 预冷的PBS 重悬细胞。最后一次离心,弃上清。按照试剂盒操作流程配制碘化丙啶染色液,每管加入0.5 mL 碘化丙啶染色液,缓慢吹打充分混匀转移至流式管中。37 ℃避光温浴30 min 后上机检测,488 nm 激发波长处检测红色荧光。流式图采用modfit 软件分析。
1.6 统计学处理
2 结果
2.1 hSCAPs 的培养及多向分化能力鉴定
根尖牙乳头组织采用组织块法贴壁培养5 d后镜下可见类成纤维样的细胞沿着组织块边缘呈放射状爬出(图1A),传代后细胞生长速度加快(图1B)。细胞连续诱导成骨3 周后茜素红染色后可见大量明显红色的颗粒(图1C),对照组则无红色的颗粒(图1D)。细胞向成脂诱导3 周后油红O染色后可见有脂滴被染红(图1E),对照组则未见染红的脂滴(图1F)。表明hSCAPs 具有多向分化潜能,属于间充质干细胞来源。
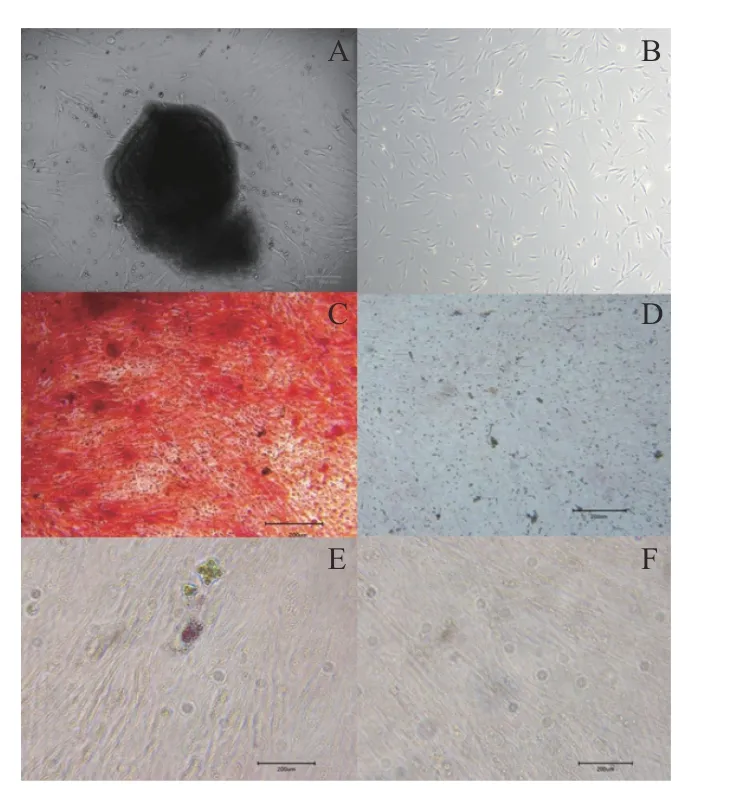
图1 hSCAPs 的培养及多向分化能力鉴定Fig.1 Culture of hSCAPs and identification of multi-directional differentiation ability
2.2 hSCAPs 表面标记物的检测
流式细胞术检测显示间充质干细胞表面标志物CD73 占99.03%,CD90 占99.94%、CD105 占99.47%,均呈阳性高表达,而造血细胞标记物CD34、CD45 以及免疫细胞表面标记物CD19、CD11b、HLA-DR 则呈阴性(0.77%),证明属于间充质干细胞家族,排除造血来源的干细胞(图2)。
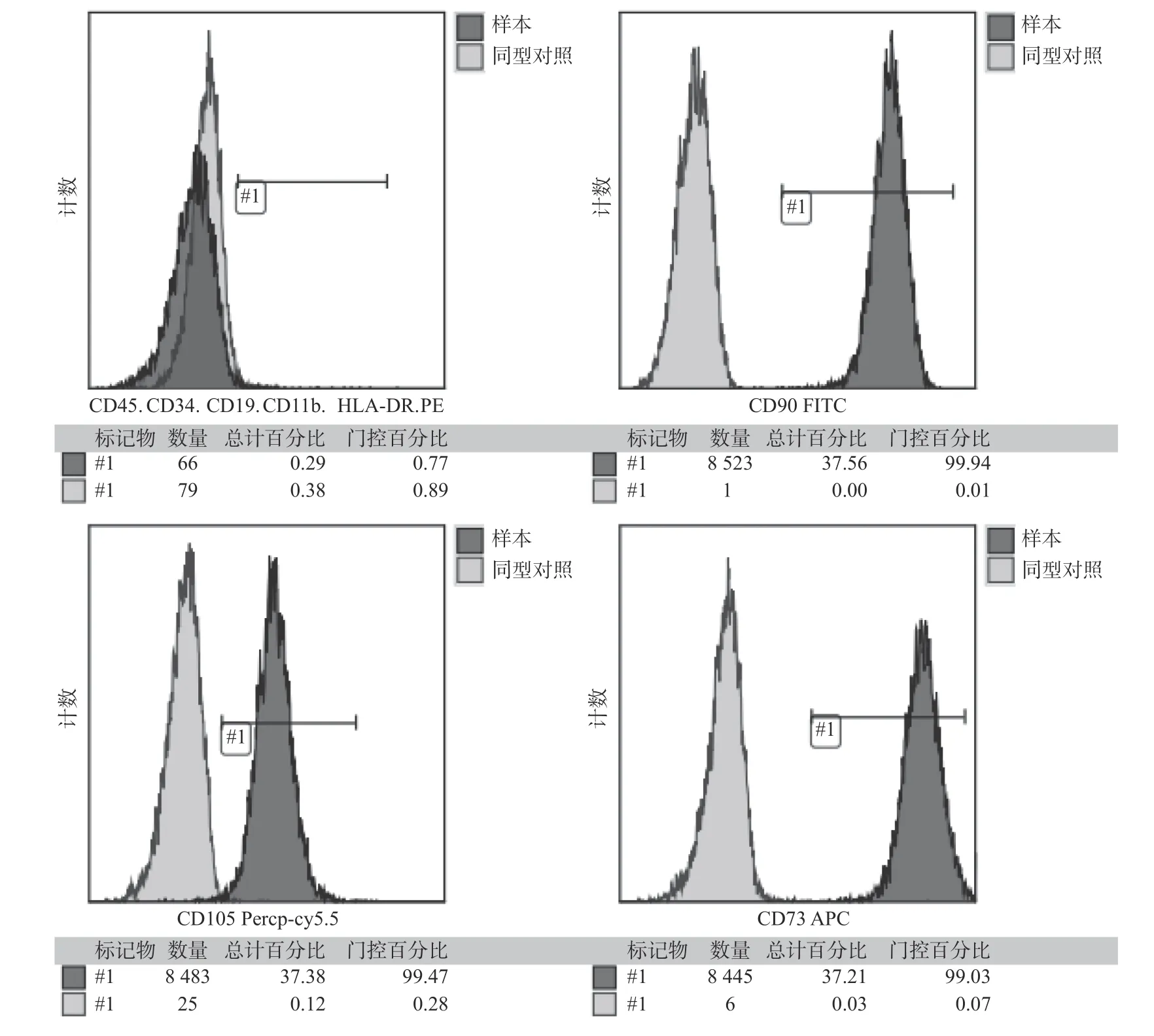
图2 hSCAPs 流式细胞鉴定结果Fig.2 Identification of hSCAPs surface antigen by flow cytometry
2.3 PNS 对hSCAPs 增殖的影响
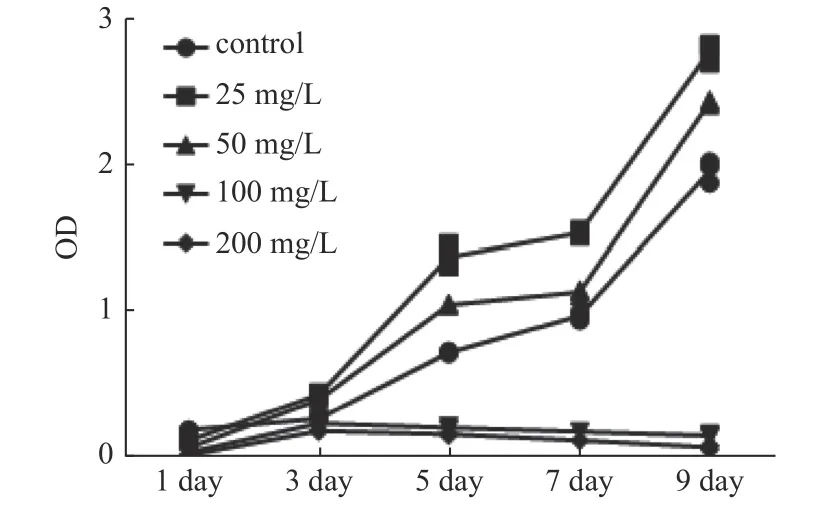
图3 不同浓度PNS 下hSCAPs 的生长曲线Fig.3 The growth curve of hSCAPs under different concentrations of PNS
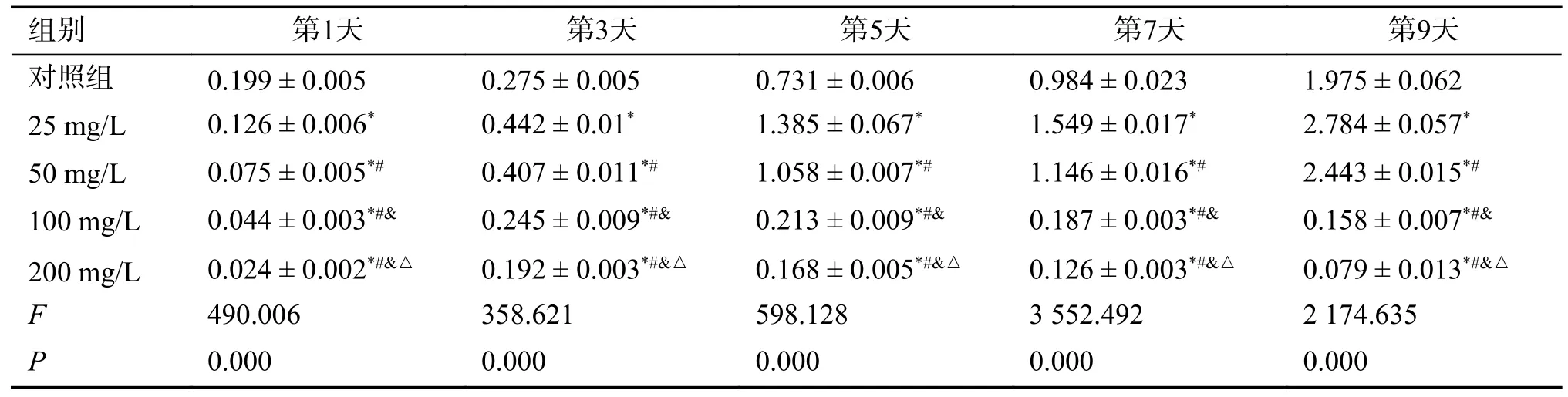
表1 不同浓度PNS 下hSCAPs 增殖的差异Tab.1 Differences in HSCAPS proliferation under different concentrations of PNS
2.4 PNS 对hSCAPs 周期的影响
25 mg/L 组的细胞和空白对照组进行的细胞增殖指数(proliferation Index,PI)分析。PI=G2/M+S,对照组PI=5.82%+5.43%=11.25%(图4),25 mg/L 组PI=12.17%+3.46%=15.63%(图5),且P< 0.05,差异有统计学意义,见图6。进一步证明25 mg/L 的PNS 显著促进hSCAPs 的增殖。
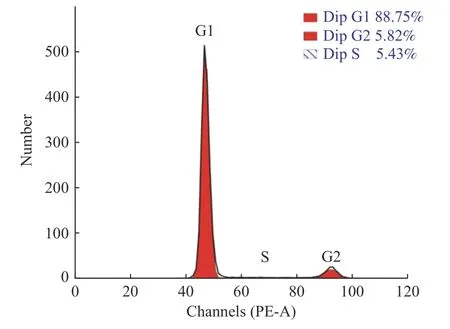
图4 对照组细胞周期分布Fig.4 Cell cycle distribution of control group

图5 25 mg/L 组细胞周期分布Fig.5 Cell cycle distribution of 25 mg/L group

图6 细胞增殖指数差异Fig.6 Difference in cell proliferation index
3 讨论
口腔门诊中存在着大量颌面骨组织缺损的患者,对患者的生理功能和美观功能影响极大,甚至危害全身生理健康和心理健康[8]。目前临床主流的诊疗手段难以完美恢复缺损组织的生理功能。组织工程以间充质干细胞为中心要素,其研究和发展正方兴未艾,是一种新兴的治疗手段。hSCAPs 属较晚发现的牙源性干细胞,其增殖速度快、分化能力强且在不同的诱导分化条件下能够向成骨细胞、成牙本质细胞、神经细胞、脂肪细胞、软骨细胞和肝细胞等分化[1,3]。课题组自行分离培养的原代细胞经过流式细胞检测以及多向分化能力鉴定,具有间充质干细胞的生物学特性,而且增殖和分化能力强,可作为种子细胞进行后续实验。有报道称hSCAPs 的增殖速率、迁移能力和多向分化能力较同一牙齿来源的牙髓干细胞(dental pulp stem cells,DPSCs)和牙周膜干细胞明显更强,hSCAPs 抵抗感染的能力更强,还能够保留一部分活性[9-10]。因此,hSCAPs 可作为颌面骨缺损骨组织再生治疗具有巨大潜力的干细胞。
干细胞治疗领域的文献表明,单纯将干细胞移植到损伤组织中,由于移植细胞的存活能力差,再生活性降低,治疗效果较差。因此提高移植干细胞的细胞活力、分化和治疗效果是一个棘手的问题[11-12]。PNS 被广泛应用于临床,在心脑血管疾病、骨关节疾病上具有良好的疗效,研究发现PNS 可以对多种干细胞的增殖起到积极的作用。PNS 在适宜浓度下能够促进大鼠BMSCs 的增殖,同时VEGFmRNA 的表达和分泌升高[13]。另外,PNS 还可以上调VEGF、bFGF、VE-钙粘蛋白、WNT3a、β-连环蛋白和 TCF4 mRNA 的表达,促进内皮祖细胞增殖和血管形成[14]。同时,PNS 还可以上调抗凋亡基因Bcl-2 和Bcl-xl 的表达,降低 Bax/Bcl-2 比值,从而抑制大鼠BMSCs 的凋亡[15]。
本实验研究发现在第1 天时三七总皂苷对于hSCAPs 的增殖均显示具有一定的抑制作用,说明hSCAPs 对外源性的物质需要一个适应的过程。而从第3 天开始25 mg/L 和50 mg/L 2 组对于hSCAPs 均有明显的促进作用,呈指数生长,第5天以后生长逐渐达到平台期,第7 天以后又开始进入下个增殖周期。但25 mg/L 组的促进增殖作用更加明显。而在100 mg/L 组和200 mg/L 组则发现在3 d 内细胞数目有增多,而在3 d 以后细胞的增殖被抑制,镜下观察发现细胞数目逐渐变少,时间越长则死亡的细胞越多,说明高浓度的PNS不仅抑制细胞增殖,更可以促进细胞的死亡。
细胞周期是一次细胞分裂的完整历程,包括细胞间期(G0 期、G1 期、S 期、G2 期)和细胞分裂期(M 期)[16]。由于G0 和G1 期时DNA 含量均保持二倍体状态,所以G0 与G1 期难以区分。S期是整个细胞周期中功能最为活跃的阶段,DNA开始合成含量增加,处于G1 期和G2 期的过渡阶段,还有合成DNA 所需要的各种蛋白和酶参与到此阶段。G2 期是DNA 合成后期,介于S 期和M期的之间,G2 期与M 期DNA 均是四倍体状态,因此无法在DNA 含量上直接区分。G1 到S 和G2到M 是最为重要的两个阶段,因其DNA 含量变化,所以S 期和G2/M 期也被视作细胞增殖的标志[17]。因为此时分子水平变化非常活跃且复杂,外界环境条件的改变非常容易影响细胞的增殖状态,若能够给与适当的干预措施,则对于调控细胞的生长与增殖周期具有非常积极的生理意义[18-19]。经流式细胞分析后显示,25 mg/L 组处于S 期和G2/M 期的细胞数占比明显高于对照组,进一步说明PNS 浓度为25 mg/L 时可以显著促进细胞增殖的生长,三七作为常见且经济的药物,其药理作用对于组织工程具有积极的意义。
综上所述,hSCAPs 作为一类生长能力强的干细胞,状态可能更为接近原始干细胞,相对脆弱,对于PNS 具有很高的敏感性,即25 mg/L 的浓度即可以显著促进hSCAPs 的增殖和分化。三七作为一种已经成熟使用的药物,安全性得以保证,hSCAPs 作为良好的种子细胞显示出很大的临床应用前景。但是本实验仅是初步探明了PNS 对hSCAPs 具有显著的促进增殖作用,对于其具体的机制以及对细胞凋亡的影响需要进一步探究。
