灯盏花素调控急性肺栓塞大鼠右心室CINC-1、CINC-2 的mRNA 及蛋白水平
2023-01-09李振坤白团丽杨璘宇
李振坤 ,白团丽 ,杨璘宇 ,王 颖
(1)昆明医科大学第二附属医院呼吸与危重症医学科,云南 昆明 650101;2)昆明医科大学第二临床医学院,云南 昆明 650500)
肺栓塞(pulmonary embolism)是一种常见且可能致命的肺血管疾病[1],寻找新的药物一直是临床研究热点。急性右心衰竭是肺栓塞患者主要死亡原因,右心的炎症因子改变在肺栓塞发病中非常重要,可以作为肺栓塞的发生、发展及预后评估指标[2]。肺栓塞与中性粒细胞趋化因子(cytokine-induced neutrophil chemoattractants,CINC)相关的炎症效应密切相关[3-4],中性粒细胞相关的炎症在肺栓塞后的多种并发症中发挥作用。灯盏花素广泛用作治疗心血管疾病,具有强大的心血管药理作用。多项药理研究表明,灯盏花素对缺血性疾病及肺外的血栓性疾病具有治疗作用[5-6]。本课题前期研究显示:灯盏花素有抗急性肺栓塞的作用,灯盏花素可以下调肺组织单核细胞趋化蛋白-1(monocyte chemoattractant-1,MCP-1)、白细胞介素-13(interleukins-13,IL-13)基因、蛋白水平发挥肺栓塞保护作用[7],但灯盏花素对右心的炎症因子影响如何还不得而知。本研究拟通过大鼠肺栓塞模型评估灯盏花对其右心室的保护作用,并通过检测右心室 CINC-1、CINC-2 基因及蛋白表达水平,验证灯盏花对肺栓塞后右心室炎症损伤的保护作用机制。
1 材料与方法
1.1 药物与试剂
灯盏花素购自广东彼迪药业有限公司(批号:20180101);医用低分子肝素购自河北常山生化药业股份有限公司(批号:F402180807);PCR 引物设计:Beacon Designer 7.90;引物合成:广州invitrogen Trizol Reagent:Lifetech 15 596026;WB试剂:RIPA 裂解液、BCA 蛋白浓度测定试剂盒、SDS-PAGE 蛋白上样缓冲液(6X)均购自碧云天,内参一抗:β-actin 抗体购自 abcam 生物医药公司,CINC1 抗体批号 ab86436、CINC2 抗体批号ab 220431;检测二抗:山羊抗小鼠(HRP 标记)通用型二抗,购自美国 CST 公司,批号 cst 7074,7076。
1.2 动物
SD 雄性大鼠30 只,周龄7~9 周,体重250~300 g,购自昆明医科大学,许可证号:SCXK(滇)K2015-0002,标准喂养室 温 20 ℃,湿度 60%。本研究符合昆明医科大学实验动物伦理委员会所制定的伦理学标准 。
1.3 仪器
上海UNICO 全波长分光光度计;Thermo 酶标仪;ABI StepOne 定量PCR 仪;BIO-RAD 凝胶成像仪;BIO-RAD 垂直电泳槽;BIO-RAD 湿式转膜槽;威恒电子天平;其林贝尔静音混合仪。
1.4 方法
1.4.1 制备自体血栓每组大鼠标记称重并记录,大鼠尾静脉取血 600 µL,立马注入外径 1 mm 导管,37 ℃温箱进行孵育 30 min,放入-20 ℃冰箱中 1 min,进行血栓凝固,30 min 后将导管置入 70 ℃水浴锅 10 min。取出导管并将导管用刀片切成 2 mm 长度,显微镊取出血栓,放入装有0.002 L 生理盐水离心管中,制备自体静脉血栓。
1.4.2 肺栓塞模型建立及给药处理(1)SD 大鼠随机分为 5 组(每组6只):假手术组(Control),模型组(Model),灯盏花素低剂量组(Bre10 g/L),灯盏花素高剂量组(Bre 20 g/L),低分子肝素阳性药组(LMWH 10.250 IU/L),使用小动物生理仪监测大鼠的心率与呼吸次数。(2)造模 用 2% 戊巴比妥钠进行动物麻醉后,所有组均沿颈前正中线做长约 2 cm 的切口,钝性分离大鼠右侧的颈总静脉,并用导管将混有自体血栓 20 个栓子的0.002 L生理盐水注入到颈总静脉,缝合切口。假手术组:右侧颈总静脉注射0.002 L 生理盐水;模型组及给药各组:右侧颈总静脉注射0.002 L 生理盐水+血栓块(20 个)。(3)给药处理 经大鼠肺栓塞灯盏花素量效实验确定灯盏花素最佳低、高剂量分别为10 g/L 及20 g/L(表1),于建立模型前 2 h,假手术组与模型组腹腔注射0.002 L 生理盐水,灯盏花素低剂量、高剂量与低分子肝素阳性药组腹腔分别注射低剂量灯盏花素(10 g/L)、高剂量灯盏花素(20 g/L)及低分子肝素(10.250 IU/L)。血栓输注 24 h 后,再次记录大鼠的心率与呼吸次数,观察大鼠一般情况。打开腹腔切断下腔动静脉放血处死动物,取右下肺组织 HE 染色;右心室组织放入 0.001 L trizol 裂解液(-80 ℃保存),后期进行 Q-PCR 及 WB。
表1 灯盏花素对大鼠肺栓塞影响的量效关系( )Tab.1 Dose-effect relationship of breviscapine on pulmonary embolism in rats()
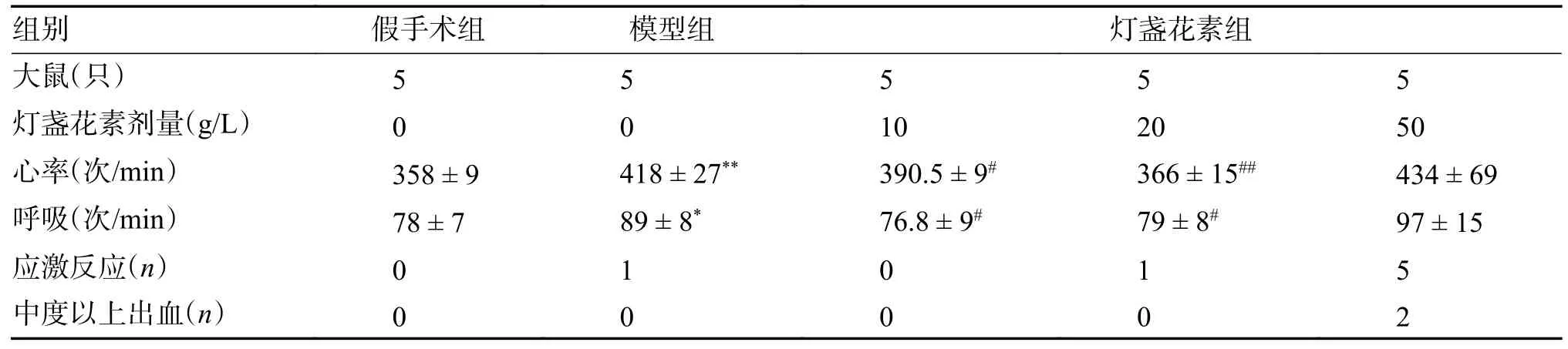
表1 灯盏花素对大鼠肺栓塞影响的量效关系( )Tab.1 Dose-effect relationship of breviscapine on pulmonary embolism in rats()
与假手术组比较,*P < 0.05,**P < 0.01;与模型组比较,#P < 0.05,##P < 0.01。
1.4.3 HE 染色右下肺组织放入 50 mL 4% 多聚甲醛(常温固定备用),脱水包埋制备切片,经苏木精-伊红染色后于显微镜下观察肺组织的病理变化,普通光学显微镜下观察显色结果并分别在4 倍镜、10 倍镜下拍照。每组6例大鼠,每张切片随机选5 个高倍视野。
1.4.4 Q-PCR 检测mRNA 表达Q-PCR 引物序列如下(F 代表上游引物forward;R 代表下游引物reverse),见表2。
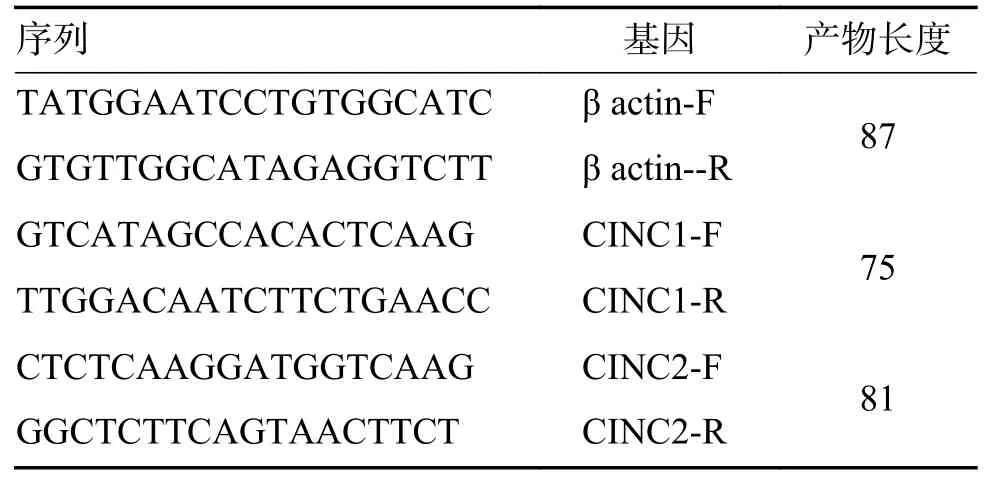
表2 Q-PCR 引物序列Tab.2 Q-PCR primer sequences
取20 mg 大鼠右心室组织,液氮研磨后,提取总RNA,逆转录合成cDNA,反应体积为20 µL,42 ℃ 温育60 min,70 ℃ 加热10 min 后终止反应,冰浴冷却,得到逆转录的cDNA 第一条链。进行Q-PCR 扩增,放入ABI Stepone 仪器中。
设置PCR 循环反应条件,预变性,变性(95 ℃)15 s,退火及延伸(60 ℃)30 s,共40~45 循环,对循环产物进行溶解曲线分析,反应结束,收集信息,做Ct 值分析。Q-PCR 的实验结果采用2-△△Ct法进行分析,> 1,参考公式2-△△Ct==2^-[(Ct 实验组目的基因-Ct 实验组内参基因)-(Ct 对照组目的基因-Ct 对照组内参基因)],得到Ct 数据后再与内参作除法比较。
1.5 Western-blot 检测蛋白表达
取-80 ℃ 的肺栓塞大鼠左下肺,每100 mg组织中加入500 µL 的RIPA 裂解液(含50 µL 蛋白酶抑制剂),剪碎组织后,冰浴环境下用超声细胞破碎仪匀浆20 s,冰浴上静置裂解 20 min。4 ℃,12 000 r/min 离心10 min,收集上清液,根据BCA 试剂盒测定蛋白浓度。10% 的 SDS-聚丙烯酰胺凝胶,每孔加入蛋白样品 50 µg,进行电泳;然后进行湿转转膜(260 mA 转膜 70 min 至PVDF 膜上);5% 脱脂奶粉室温封闭 2 h;特异性一抗(1∶1 000)封闭 4 ℃ 过夜,TBST 洗膜3 次;二抗IgG-HRP(1∶5 000)室温封闭 1 h,TBST 洗膜3 次,每次15 min。将 PVDF 膜置于化学发光成像仪进行成像,采用 Image Lab 分析软件对各组条带的光密度值进行分析。
1.6 统计学处理
研究数据采用SPSS 18.0 统计学软件进行分析,计量资料采用均数±标准差()表示,两组间比较使用独立样本t检验,多组间的比较使用单因素方差分析(One-way ANOVAs),统计结果采用Graphpad Prism 8.0 作柱状图,P< 0.05 为差异有统计学意义。
2 结果
2.1 大鼠一般状况,生命体征情况
模型组大鼠心率、呼吸次数增快、面色青紫,各组分别给与灯盏花素低、高剂量及低分子肝素后有所改善。心率监测显示:假手术组(356±14)次/min,模型组(428±31)次/min,灯盏花素低剂量组(374±25)次/min,灯盏花素高剂量组(357±19)次/min,低分子肝素组(385±33)次/min。模型组大鼠与与假手术组相比,模型组心率增快有明显统计学意义(t=5.15,P< 0.01);灯盏花素低剂量组与模型组比较,心率下降有明显统计学意义(t=3.30,P< 0.01);灯盏花素高剂量组与模型组比较,心率下降有明显统计学意义(t=4.75,P< 0.01);低分子肝素组与模型组比较,心率下降有明显统计学意义(t=2.30,P< 0.01),见表3,图1。
表3 灯盏花素对大鼠肺栓塞生命体征影响( )Tab.3 The effect of breviscapine on the vital signs of pulmonary embolism in rats()

表3 灯盏花素对大鼠肺栓塞生命体征影响( )Tab.3 The effect of breviscapine on the vital signs of pulmonary embolism in rats()
与假手术组比较,*P < 0.05,**P < 0.01;与模型组比较,#P < 0.05,##P < 0.01。
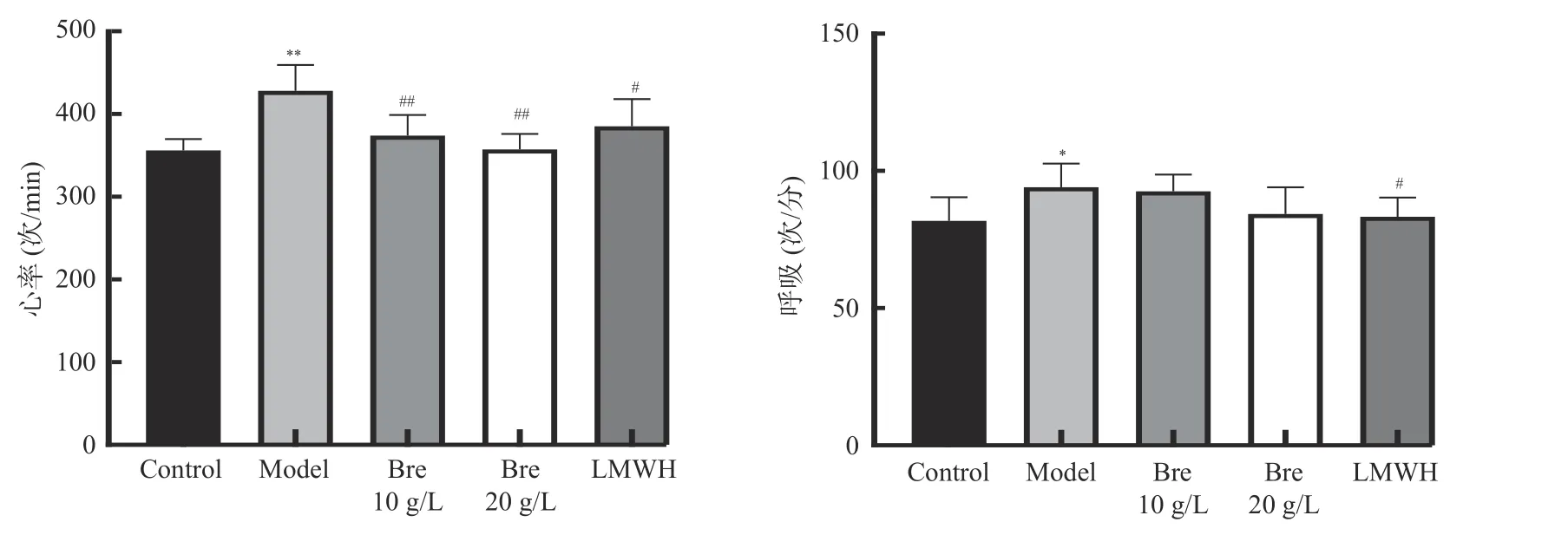
图1 给药后大鼠心率、呼吸变化Fig.1 Changes in heart rate and respiration in rats after administration
呼吸监测显示:假手术组呼吸(82±9)次/min,模型组(94±9)次/min,灯盏花素低剂量组(76±37)次/min,灯盏花素高剂量组(84±10)次/min,低分子肝素组(83±7)次/分。模型组大鼠与与假手术组比较,模型组呼吸增快有统计学意义(t=2.44,P< 0.05);低分子肝素组与模型组比较,呼吸下降有统计学意义(t=2.34,P< 0.05),见表3,图1。
2.2 病理学改变
HE 染色肺组织病理的变化显示:假手术组肺动脉内干净无血栓,模型组肺小动脉内血管内多发血栓,肺动脉内血管内间质炎症反应明显,肺泡内红色炎症样物质渗出,右心室扩张,可确定肺栓塞模型组大鼠上述指标相比正常组有损伤,造模成功。分别给予高、低剂量灯盏花素后,上述病理改变分别在4 倍镜、10 倍镜下好转,肺血管内多发血栓减轻、间质炎症反应减轻、肺泡内红色炎症样物质减少,见图2。
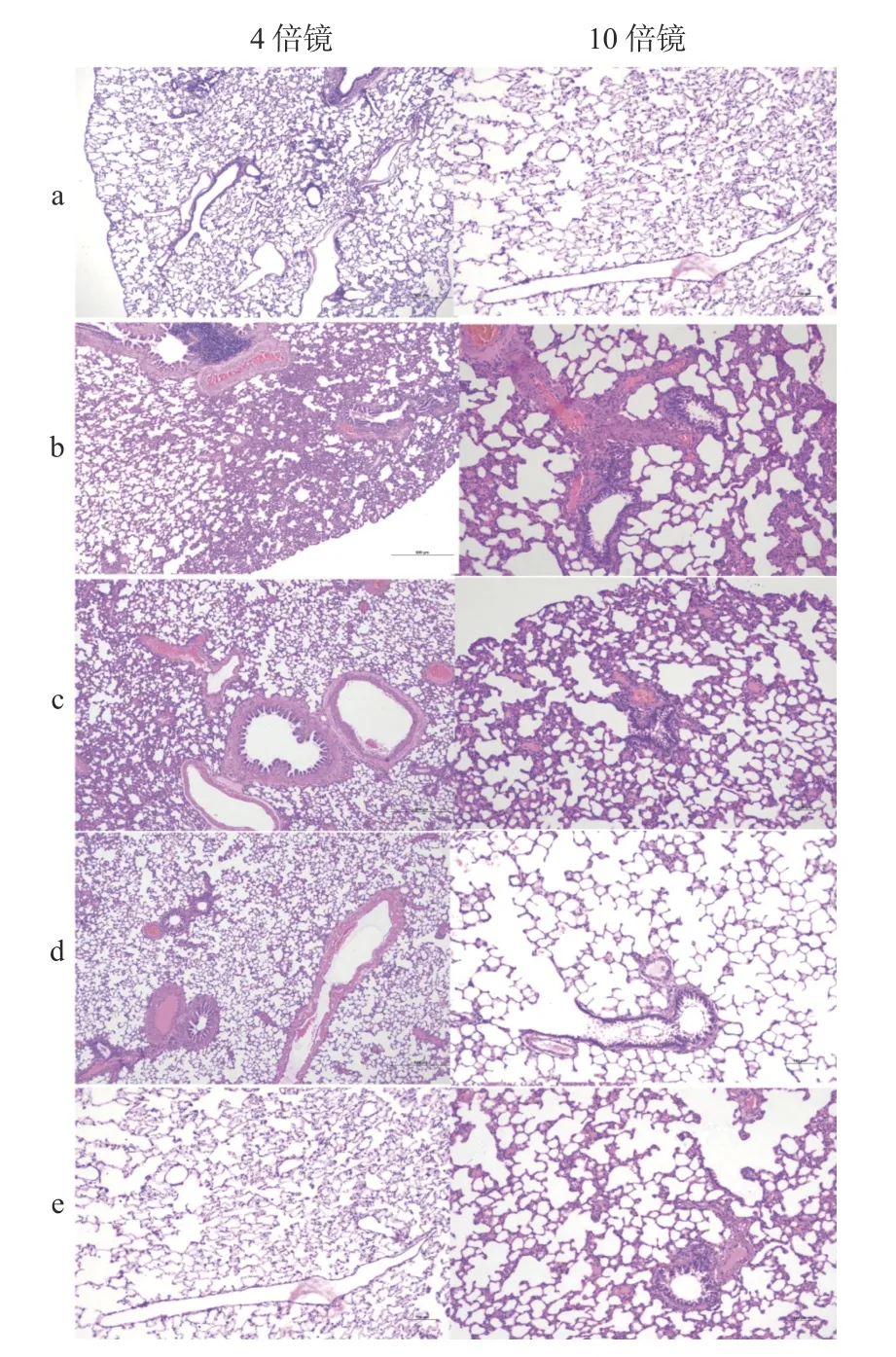
图2 各组大鼠肺组织病理检查Fig.2 Pathological examination of lung tissue of rats in each group
2.3 Q-PCR 显示基因水平改变
各组右心室Q-PCR 结果:CINC-1 的溶解曲线Ct 值与内参比值显示假手术组(1.19±0.18),模型组(15.11±2.35),灯盏花素低剂量组(7.40±1.50),灯盏花素高剂量组(2.27±0.45),低分子肝素组(3.20±0.58)。与假手术组比较,模型组比值明显升高,差别具有明显统计学意义(t=14.46,P< 0.01);与模型组比较,灯盏花素低剂量组比值明显降低,差别具有明显统计学意义(t=6.77,P< 0.01);与模型组比较,灯盏花素高剂量组比值明显降低,差别具有明显统计学意义(t=13.13,P< 0.01);与低分子肝素组比较,灯盏花素高剂量组比值明显降低,差异具有统计学意义(t=3.06,P< 0.05),见图3。
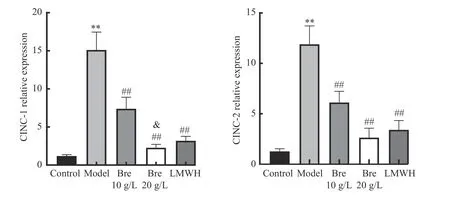
图3 Q-PCR 检测灯盏花素干预肺栓塞大鼠右心室CINC-1、CINC-2 基因表达Fig.3 Q-PCR detection of right ventricular CINC-1 and CINC-2 gene expression in rats with breviscapine intervention with pulmonary embolism
各组右心室Q-PCR 结果:CINC-2 的溶解曲线Ct 值与内参比值显示假手术组1.27±0.26,模型组11.89±1.82,灯盏花素低剂量组6.12±1.11,灯盏花素高剂量组2.63±0.94,低分子肝素组3.41±0.92。与假手术组比较,模型组比值明显升高,差别具有明显统计学意义(t=14.14,P< 0.01);与模型组比较,灯盏花素低剂量组比值明显降低,差别具有明显统计学意义(t=6.62,P< 0.01);与模型组比较,灯盏花素高剂量组比值明显降低,差别具有明显统计学意义(t=11.06,P< 0.01);与低分子肝素组比较,灯盏花素高剂量组比值没有统计学意义(t=1.45,P> 0.05),见图3。
2.4 Western-blot 显示蛋白表达水平改变
各组右心室CINC-1 的Western-blot 结果:CINC-1 蛋白表达水平与内参比值显示假手术组(0.393±0.168),模型组(0.879±0.132),灯盏花素低剂量组(0.616±0.145),灯盏花素高剂量组0.411±0.74,低分子肝素组0.576±0.138。与假手术组比较,模型组比值明显升高,差别具有明显统计学意义(t=5.57,P< 0.01);与模型组比较,灯盏花素低剂量组比值明显降低,差别具有明显统计学意义(t=3.29,P< 0.01);与模型组比较,灯盏花素高剂量组比值明显降低,差别具有明显统计学意义(t=7.58,P< 0.01);与低分子肝素组比较,灯盏花素高剂量组比值明显降低,差别具有统计学意义(t=2.58,P< 0.05),见图4,图5。
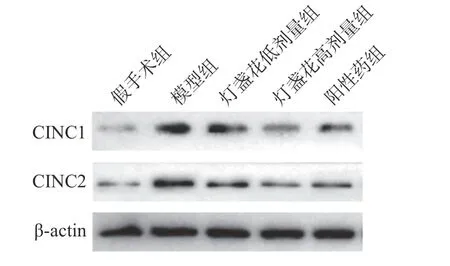
图4 WB 检测肺栓塞大鼠右心室CINC-1、CINC-2 蛋白表达Fig.4 The protein expression of CINC-1 and CINC-2 in the right ventricle of rats with pulmonary embolism detected by WB
各组右心室 CINC-2 的 Western-blot 结果:CINC-2 蛋白表达水平与内参比值显示假手术组0.462±0.229,模型组 0.934±0.250,灯盏花素低剂量组0.730±0.220,灯盏花素高剂量组 0.506±0.171,低分子肝素组 0.677±0.199。与假手术组比较,模型组比值明显升高,差别具有明显统计学意义(t=3.41,P< 0.01);与模型组比较,灯盏花素高剂量组比值明显降低,差别具有明显统计学意义(t=3.47,P< 0.01);与模型组比较,灯盏花素低剂量组比值差别无统计学意义(t=1.50,P> 0.05);与低分子肝素组比较,灯盏花素高剂量组比值差别无统计学意义(t=1.60,P> 0.05),见图4,图5。

图5 WB 检测灯盏花素干预肺栓塞大鼠右心室CINC-1、CINC-2 蛋白表达Fig.5 WB detection of right ventricular CINC-1 and CINC-2 protein expression in rats with breviscapine intervention withpulmonary embolism
3 讨论
随着各地诊断水平的提高,肺栓塞被越来越多的重视,每年的肺栓塞确诊病例不断增加。在美国,每年诊治超过 600 000 例 急性肺栓塞病例,肺栓塞是急诊科的常见疾病[8]。来自发达国家的一项十年的研究显示:肺栓塞和深静脉血栓的在癌症患者中高发,而且发生肺栓塞后死亡风险极高[9]。肺栓塞危害极大,常常引起急性右心衰竭、呼吸衰竭、呼吸困难、胸痛甚至猝死等严重并发症。基于western-blot 和蛋白组学的研究,肺栓塞导致肺动脉高压和肺部损伤,激活炎症系统,导致肺部、右心多种炎症微蛋白表达差异,炎症因子可以作为肺栓塞很好的评估指标。肺栓塞的治疗一直是临床棘手的问题,主要的治疗方案包括抗凝和溶栓药物治疗,但是核心的抗凝药物肝素可能诱导血小板减少症、致命性出血、截肢,急性心肌梗塞和中风等致命的并发症[10],而溶栓治疗大规模 meta 分析甚至显示其导致的主要器官出血率高达 6%,颅内出血率高达 2%[11]。新的治疗肺栓塞的药物开发很有必要。
CINC 系列因子包括中 CINC-1、CINC-2(α、β)等,在嗜中性粒细胞浸润的炎症中扮演重要角色[12]。Watts 等[13]报道肺栓塞使中性粒细胞右心导致功能障碍,CINC-1、CINC-2 的巨噬细胞聚集在右心衰肌细胞损伤的心脏地区,电子显微镜显示肌细胞坏死和炎症细胞的吞噬作用,CINC系列炎症因子可以作为肺栓塞评估指标。本研究显示:肺栓塞模型组大鼠心率、呼吸有增快,差别具有统计学意义,病理示大鼠肺组织内见动脉血栓、右心室扩张,提示肺栓塞可以导致右心衰,诱发大鼠生命体征恶化。Q-PCR、WB 显示模型组大鼠右心室心肌 CINC1 及CINC-2 基因、蛋白水平明显升高,结果有明显统计学差异(P< 0.01),可能的机制为急性肺栓塞广泛堵塞下游肺血管床,诱发肺动脉高压及急性右心衰相关炎症反应,而急性右心衰继发右心室明显增大、扩张、炎症反应,增加了炎症因子 CINC-1 及 CINC-2 水平。
灯盏花素对缺血性疾病及肺外的血栓性疾病具有治疗作用。也有较强的抗炎效应。灯盏花素还有有抗急性肺栓塞的作用,HU 等在大鼠急性肺栓塞模型中证实了灯盏花素对肺栓塞动物动脉血气的氧分压、二氧化碳分压水平异常具有改善作用,但具体机制及药物作用的靶点未明确[14]。本课题前期研究显示灯盏花素有肺内抗肺栓塞作用[7],但对肺栓塞继发右心损伤的炎症机制未知。本研究显示灯盏花素高、低剂量组及低分子肝素组均能改善肺栓塞大鼠心率、呼吸次数及显著下调明显升高的 CINC-1 及 CINC-2 基因和蛋白水平,提示灯盏花素具有改善肺栓塞后大鼠心率及呼吸增快的效应,CINC-1 及 CINC-2 可能作为灯盏花素发挥抗肺栓塞炎症作用的新靶点。另外,在大鼠右心 CINC-1 基因和蛋白表达水平上,灯盏花素高剂量组优于阳性药低分子肝素组和灯盏花素低剂量组,灯盏花素具有剂量相关性。这一结果证实了灯盏花素在肺栓塞大鼠模型中具有改善右心室中性粒细胞驱化因子的作用可能优于低分子肝素。
灯盏花素可以下调急性肺栓塞大鼠右心室CINC-1、CINC-2 的基因和蛋白表达水平,可能发挥抗肺栓塞炎症的作用。
