基于数据挖掘和网络药理学探讨中医药治疗甲状腺功能减退症的用药规律及作用机制*
2023-01-09陈艳奇
吕 艳,陈艳奇,范 源
(1.云南中医药大学,云南 昆明 650500;2.云南中医药大学第一附属医院,云南 昆明 650021)
甲状腺功能减退症(hypothyroidism),简称甲减,是由于甲状腺激素合成和分泌减少或组织利用不足,以机体代谢和多系统功能减退为特征的低代谢综合征,其常见临床表现有畏寒肢冷、乏力、手足肿胀感、嗜睡、记忆力减退、少汗、关节疼痛、脱发、体重增加、便秘、女性月经紊乱、性功能减退、皮肤和头发干燥等症状[1-5]。甲减的发病率约为1%~3%[1],以原发性甲减最多见,自身免疫、甲状腺手术和甲亢131I治疗占原发性甲减的90%以上[2]。其患病率随着年龄的增长而增加,发病率呈现逐渐上升趋势[3-4]。该病可能会引起消化、呼吸、心血管、脑血管、肾上腺、性腺等多系统多脏器损害,病情严重者可发生甲减危象、心肾功能衰竭等严重并发症[3,6]。研究发现甲状腺功能减退可诱发血脂异常及其相关的心脏代谢紊乱疾病[7],增加患心血管疾病的风险[8]。甲减的患病与饮食、环境、遗传、药物及手术等因素密切相关,西医学认为其病理特征是皮肤和组织内的糖胺聚糖沉积,临床表现为黏液性水肿,重度甲减患者可能导致黏液水肿、昏迷和死亡,严重者影响生活质量和加重心血管疾病发生的风险[9-10]。西医对于甲减的治疗主要以口服药物为主,常用左旋甲状腺素(L-T4)替代性治疗,疗效确切,但长时间服药不良反应较多,严重者可诱发心律失常、心绞痛及心力衰竭和骨质疏松症[6]。临床研究发现,对于甲减的治疗,中西医结合治疗较单纯西药疗效更佳,在临床症状改善和促进甲功恢复正常方面优势显著[11-13]。
本研究采用文献研究,通过收集中医药治疗甲状腺功能减退症的文献,借助数据挖掘和网络药理学的研究方法,初步阐述其药物的用药规律和作用机制。
1 资料与方法
1.1 数据来源 检索自建库以来CNKI、万方医学网、CBM中国生物医学文献数据库公开发表的关于中医药辨治甲状腺功能减退症的文献,分别以“甲状腺功能减退症”“甲减”为主题检索词,并含“温阳”“补阳”进行高级检索,检索时间设置为建库到2022年3月31日。
1.2 数据筛选 将检索到的文献参照纳入标准及排除标准进行数据筛选,共筛选出377篇文献,412首中药处方,涉及中药300味。
1.2.1 纳入标准 将明确诊断为甲状腺功能减退症且有明确疗效评价的文献纳入,其中包括临床观察文章、专家经验总结、医案医话、治疗体会、辨证论治的文献(具体举例说明);配方颗粒、膏剂、复合制剂、丸剂等制剂中,中药组成及剂量完整时同样纳入。
1.2.2 排除标准 诊断及疗效不明确的文献;诊疗过程不连续的处方;动物类实验文献。
1.3 数据库的建立、规范与数据分析
1.3.1 数据库的建立 将上述文献中筛选出的处方录入中医传承辅助平台(V2.5),选择中医传承辅助平台系统中的“平台管理系统”→“数据分析系统”→“方剂分析”模块录入数据,录入并核查。
1.3.2 数据库的规范 将处方中的中药参照《中药学》[14]、《中华人民共和国药典》[15]录入,其中中药名称不一样的同一味中药,将其名称规范化,“双花”统一为“金银花”,“仙灵脾”统一为“淫羊藿”,“夜交藤”统一为“首乌藤”,“薯蓣”统一为“山药”,“大云”“淡大芸”统一为“肉苁蓉”,“云苓”统一为“茯苓”,“熟附子”“黑附子”统一为“制附子”。
1.3.3 数据分析 采用频次统计、关联规则、熵聚类算法等数据挖掘方法,通过“中医传承辅助平台(V2.5)”,对药物的使用频次、性味、归经及组方规律进行聚类分析,得到潜在的核心药物组合,并在此基础上挖掘出新处方。
1.4 基于网络药理学分析核心药物治疗甲减的作用机制
1.4.1 核心药物活性成分收集 利用中药系统药理学分析平台(traditional Chinese medicine systems pharmacology database and analysis platform,TCMSP)以口服利用度(oral bioavailability,OB)≥30%,药物相似性(drug-like properties,DL)≥0.18,筛选出核心药物的有效成分。
1.4.2 核心药物靶点收集 (1)根据药物有效成分的MOL ID检索TCMSP数据库中有效成分对应的药物作用靶点名称。(2)根据药物作用靶点名称借助UniProt数据库中的UniProt KB查询靶点对应的UniProt ID及基因名称,构建药物有效成分-靶点基因数据库。
1.4.3 疾病靶点收集 以“hypothyroidism”作为关键词,搜索GeneCards数据库、TTD数据库及OMIM数据库,检索及筛选靶点基因,得到甲减的疾病潜在靶点基因。
1.4.4 基因映射 将甲减的疾病潜在靶点基因与核心药物靶点基因,输入Venn Diagrams系统制作疾病药物韦恩图,筛选出核心药物与甲减的共同作用靶点基因,即潜在的治疗靶点基因。
1.4.5 PPI网络构建与核心靶点基因筛选 将交集靶点基因上传至STRING数据库,选择属性为人类,构建核心药物治疗甲减的靶基因蛋白相互作用(protein-protein interaction,PPI)网络图。借助 Cytoscape 3.9.1软件对网络进行拓扑结构分析,通过Centiscape插件筛选出核心靶点基因。
1.4.6 GO富集分析和KEGG信号通路分析 应用DAVID数据库将核心靶点信息进行基因本体GO富集分析与KEGG信号通路富集分析,GO富集分析包括 生 物过 程 (biological process,BP)、分 子 功 能(molecular function,MF)及细胞组分(cellular component,CC)3个功能层次。使用微生信平台对结果进行可视化处理。依据P值筛选核心药物治疗甲减的靶点生物过程及信号通路,进一步阐明该核心药物治疗甲减的作用机制。
1.4.7 核心药物-成分-疾病-靶点-通路复合网络的构建 将疾病与核心药物的交集靶点、核心药物成分及KEGG中信号通路导入到 Cytoscape 3.9.1软件,构建核心药物治疗甲减的药物-成分-疾病-靶点-通路网络图。
2 结果
2.1 用药频次统计 通过数据筛选,共有412首方剂符合筛选条件,涉及300味中药,对其进行药物频次分析,可得出频次最高的10味中药为:茯苓(253次)、黄芪(226次)、白术(171次)、淫羊藿(161次)、熟地黄(158次)、当归(149次)、党参(142次)、山药(135次)、山茱萸(130次)、肉桂(119次)。
2.2 四气、五味、归经分析 对处方中的300味中药进行统计分析,四气中温性药占44.49%,平性药占24.34%,寒性药占21.08%,热性药占7.91%,凉性药占2.19%。五味中甘味药占44.39%,辛味药占24.89%,苦味药占20.49%,酸味药占4.51%,咸味药占3.47%,涩味药占2.25%。归经中脾(2 414次)、肾(2 320次)、肝(2 242次)、肺(1 507次)、心(1 453次)、胃(887次)、胆(350次)、膀胱(340次)、大肠(221次)、小肠(115次)、心包(72次)、三焦(39次)。
2.3 用药规律分析 基于关联规则的组方规律分析,选择数据分析,设置“支持度”为25,“置信度”为0.6,支持度个数为82,常用中药药对的用药模式为18组,通过用药模式分析,可得药物组合出现的频次。通过关联规则分析,药物组合中置信度为60%的关联药物共16组。见表1、表2。

表1 常用药对及频次

表2 常用中药关联规则分析
2.4 基于无监督的熵层次聚类的新处方 通过药物之间相关性发现其隐性规律,进入数据分析页面,选择新方分析,设置“相关度”为5,“惩罚度”为2,点击聚类,共有250条数据,提取出8个常用核心药物组合;进一步演化为4个治疗甲状腺功能减退症的新处方。见表3、表4。

表3 常用核心药物组合

表4 无监督的熵层次聚类的新处方组合
2.5 基于网络药理学的作用机制研究
2.5.1 核心药物活性成分及靶点的筛选 在获得的核心药物组合及新方组合中,淫羊藿、熟地黄、山药、山茱萸4味中药在用药频次统计中出现频次最高,因此,将此4味药作为核心药物配伍进行网络药理学探讨。通过TCMSP数据库检索淫羊藿-熟地黄-山药-山茱萸配伍组所有活性成分,设置药代动力学参数后得到符合条件的活性成分62个,其中淫羊藿24个、熟地黄2个、山药16个、山茱萸20个。根据有效成分的MOL ID检索TCMSP数据库相关靶点活性成分对应的药物作用靶点淫羊藿195个、熟地黄27个、山药72个、山茱萸63个,去除重复靶点,发现淫羊藿-熟地黄-山药-山茱萸的作用靶点为215个。其中化合物 MOL000449、MOL001771、MOL000359为 4味中药的共同成分。见表5。

表5 核心药物共同活性成分表
2.5.2 核心药物与甲减共有靶点的筛选 以“Hypothyroidism”作为关键词,搜索GeneCards数据库、TTD数据库及OMIM数据库,检索去重得到甲减相关疾病靶点1 062个。将1 062个疾病靶点与215个核心药物的作用靶点数据输入Venn Diagrams系统,制作疾病药物韦恩图,获得核心药物与甲减共有靶点39个。见图1。

图1 核心药物与甲减共有靶点韦恩图
2.5.3 PPI网络与核心靶点分析 将39个共同靶点通过STRING数据库进行蛋白互作网络分析,PPI网络中包含39个有效节点,174条边,平均节点度8.92。将STRING数据库中的结果导入Cytoscape软件中,将PPI网络可视化,利用Centiscape插件筛选关键子模块,关键子模块中包括VEGFA、ESR1、PTEN、TP53、TNF、APP 等 6个靶点基因,推测这些可能是核心药物治疗甲减的核心靶点基因。见图2。

图2 核心药物治疗甲减的靶基因PPI互作网络图
2.5.4 生物过程及通路富集结果 将39个共同靶点基因输入DAVID数据库进行KEGG富集分析及GO富集分析。结果显示,GO-BP结果195个,GO-CC结果22个,GO-MF结果32个。富集到的生物过程主要有细胞凋亡、基因表达、miRNA的产生和调控、一氧化氮生物合成过程调控、炎症反应、细胞增殖、MAPK级联、MAP激酶活性调节、微胶质细胞激活、对缺氧的反应等。富集到的细胞组分主要有大分子复合体、线粒体、细胞膜、细胞因子等。富集到的分子功能主要有酶结合、肝素结合、类固醇结合、血红素结合、蛋白结合、RNA聚合酶II转录因子活性与配体激活序列特异性DNA结合等。KEGG分析结果显示:富集的通路主要包括癌症中PD-L1表达和PD-1关卡通路、T细胞受体相关信号通路、调节Th1和Th2细胞分化、脂质和动脉硬化、JAK-STAT信号通路、MAPK信号通路、PI3K-AKT信号通路等。见图3、图4、图5。
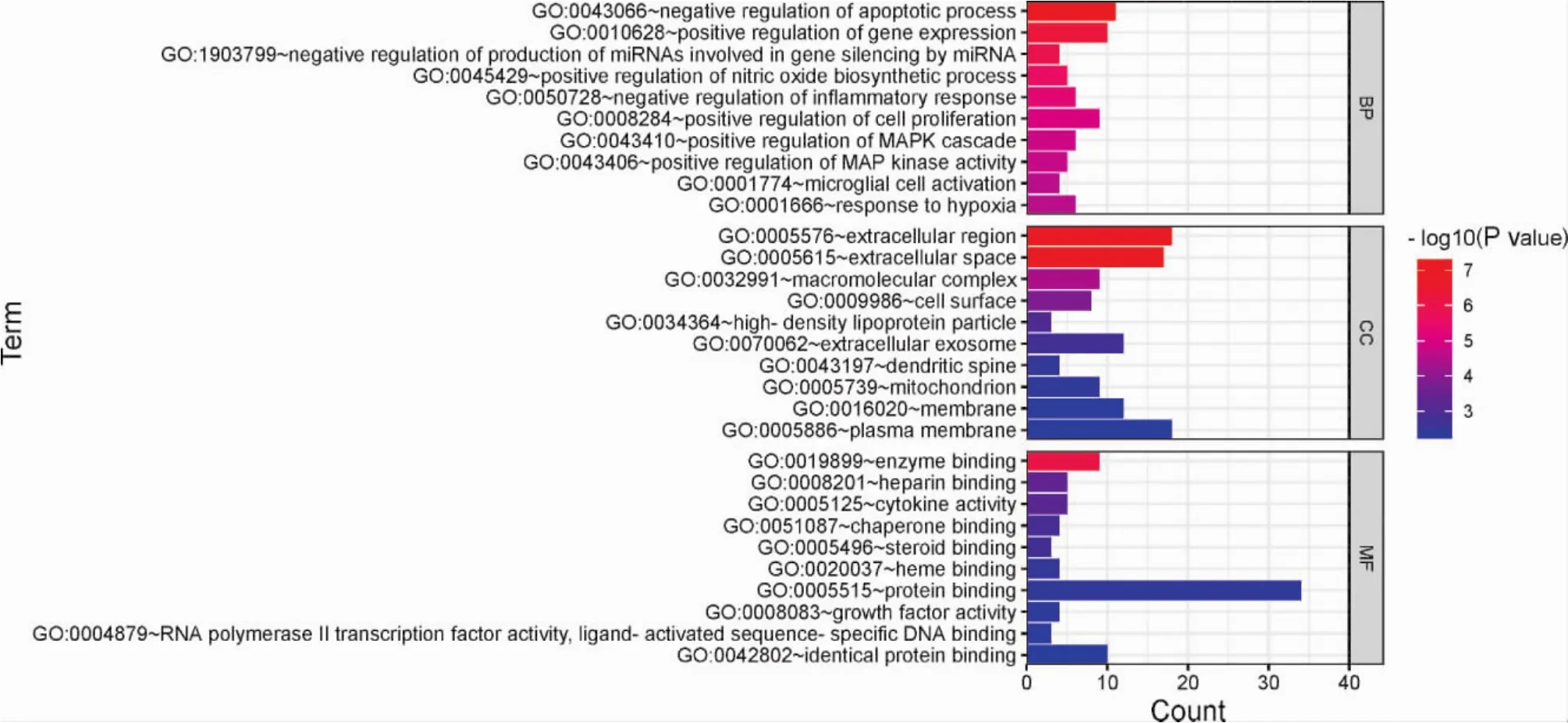
图3 GO富集的柱状图

图4 GO富集气泡图

图5 KEGG富集气泡图
2.5.5 核心药物-成分-疾病-靶点-通路复合网络的构建 将甲减与核心药物的交集靶点、核心药物成分及KEGG中信号通路导入到 Cytoscape 3.9.1软件,构建核心药物治疗甲减的药物-成分-疾病-靶点-通路网络图。见图6。
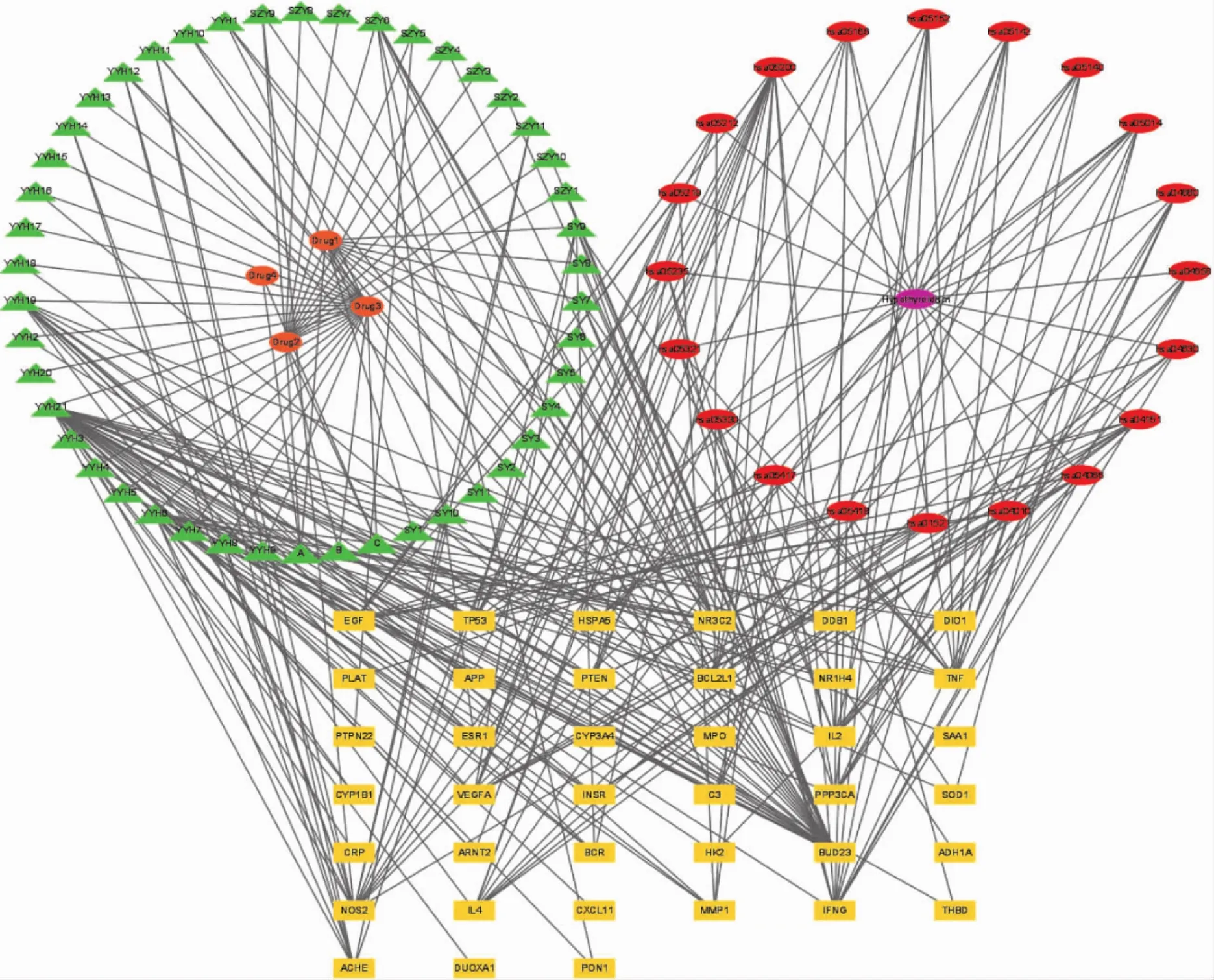
图6 药物-成分-疾病-靶点-通路网络图
3 讨论
甲减根据其临床症状,属于中医“瘿病”“虚劳”“水肿”“劳瘿”等范畴,其发病与饮食水土、情志不遂、先天禀赋不足、体虚劳累、用药不当等因素密切相关。其病机以阳虚、气虚为主,因阳气不足,导致推动、温煦、固摄功能的异常,进而出现水湿、痰浊、气滞、血瘀等变化。总体而言,本病病性属本虚标实或虚实夹杂,病位主要在脾、肾,随着病情的进展逐渐涉及心、肝。其治疗上以温补脾肾为主,辅以利湿、化痰、疏肝理气、活血化瘀之法[16-20]。
3.1 药物频次、性味归经分析 对412首中药处方中的中药进行药物统计分析可知,治疗甲减的药物多选用补益药。排名前三的是茯苓、黄芪、白术,均为补气健脾之药;其次为淫羊藿温补肾阳,熟地黄、当归补血之品,党参、山药健脾益肺生津,最后取山茱萸补益肝肾,肉桂助阳温经通脉。其中茯苓、白术、黄芪、当归,常与人参、甘草等药配伍,如归脾汤为补益气血之良方;淫羊藿、肉桂与补气健脾之药相伍可治疗脾肾阳虚之病证。四气中温性药占比最多为44.49%,其次为平性药占24.34%。温性药具有温里散寒,温补阳气作用,治疗甲减阳虚、气虚、虚寒证;平性药性味平和,调和诸药,与温性药相辅相成,共同治疗甲减。五味中甘味药占比最多为44.39%,其次为辛味药占比24.89%。甘味药,“能补能和能缓”,具有补益、和中、调和诸药和缓急止痛作用;辛味药,“能行能散”,具有发散、行气、行血作用,甘辛同用,具有补益气血、疏肝行气作用[21]。归经中以脾、肾、肝经为主,其中脾经2 414次,肾经2 320次,肝经2 242次。脾为后天之本、气血生化之源,脾虚则气血生化不足,四肢肌肉不能濡养,故见疲乏无力;脾虚气血生化不足,妇女可见月经量少、月经不调。肾为先天之本,肾阳亏虚,累及脾脏,脾肾阳虚并见,温煦失司,阳虚则寒冷,临床上可见畏寒怕冷;肾精亏虚,腰府失养,可见腰膝酸软等症状。肝失疏泄,气机不畅,可见急躁易怒;肝疏泄失常,不能推动气血运行,津液输布失常,气滞、血瘀、痰凝结于颈前,而见颈部肿大。甲减的治疗以温补肾阳,疏肝健脾益气为主,用药多使用辛、甘,温、平之药。
3.2 基于关联规则组方用药分析 根据药物配伍频次统计结果可知,高频次用药组合以茯苓、黄芪、白术、淫羊藿、熟地黄为主要药物,功效温补肾阳、益气健脾,配伍当归、党参、山药补益气血,山茱萸补益肝肾,桂枝温补阳气,高频用药模式与高频次单药物相吻合,再次证明甲减治疗中温补肾阳、益气健脾、补益肝肾的重要性。通过关联规则分析,排名前三依次为:山茱萸→山药;黄芪,白术→茯苓;桂枝→茯苓。山茱萸性微温,味酸、涩,归肝肾经,具有补益肝肾,收涩固脱作用;山药味甘,性平,具有益气养阴,补脾肺肾,涩精止带作用;两药合用,具有补益肝脾肾,代表方如六味地黄丸。黄芪味甘,性微温,归脾肺经,具有补气养血作用;白术味甘、苦,性温,归脾胃经,具有补气健脾作用;茯苓味甘淡,性平,归肺脾肾经,具有利水渗湿,健脾宁心作用;三药合用增强补益气血,健脾宁心作用,代表方如归脾汤。桂枝味辛、甘,性温,具有温通经脉,助阳化气作用,与茯苓配伍,两药合用温阳以助行水,治疗脾肾阳虚证。温补脾肾法能明显改善脾肾阳虚型甲状腺功能减退症患者的临床症状,改善甲状腺功能[22-24]。黄芪、白术两药合用,具有益气养血、补气健脾功效,常用于治疗甲减患者气虚、疲乏、头晕、四肢无力等气血两虚症状。
3.3 基于无监督的熵层次聚类的新处方分析 基于无监督的熵层次聚类分析中,可以得到8个核心药物组合、4个新处方。新方中应用熟地黄、菟丝子、鹿角胶、山药、山茱萸、牡丹皮、玄参、夏枯草、浙贝母、栀子、巴戟天、淫羊藿、肉苁蓉、山茱萸、肉桂、白芥子、炮姜等药物。其中熟地黄、菟丝子、鹿角胶、巴戟天、淫羊藿、肉苁蓉、山茱萸、肉桂、炮姜等具有补肾阳、益肝肾的作用,对于临床治疗甲减中补肾温阳药物选用提供一个更广泛的思路,不局限于某一部分药物。牡丹皮、栀子具有清热凉血、散结消瘀作用,常用于治疗肝经郁热兼有血瘀病证;山药、玄参具有益气滋阴作用;白芥子具有温中散寒、理气化痰散结作用;夏枯草、浙贝母具有软坚散结之功效。新方中单味药物在甲减治疗中的运用具有参考价值,但新方药物组合的配伍比例及剂量不明确,尚不完整,需要进一步临床实践证明。
3.4 网络药理学作用机制探讨 根据核心药物组合及新方组合,结合用药频次统计,筛选出淫羊藿、熟地黄、山药、山茱萸4味中药作为核心药物配伍进行网络药理学探讨。通过TCMSP数据库相关靶点核心药物有效活性成分筛选,可知化合物MOL000449(豆甾醇)为山药、山茱萸、熟地黄共有成分;化合物MOL001771(茯香-5-烯-3β-醇)为山茱萸、淫羊藿共有成分;化合物MOL000359(谷甾醇)为山茱萸、熟地黄、淫羊藿共有成分。豆甾醇是一种具有抗炎和抗分解代谢特性,能够结合软骨细胞膜的植物甾醇[25],其可能通过调节激素信号通路上MAPK3和PRKACA靶点的表达,调控细胞因子水平,从而发挥抗炎作用[26];同时,豆甾醇的抗分解代谢特性,也能够改善甲减患者脂代谢等功能。β-谷甾醇具有抗菌、抗炎、抗氧化、抗动脉粥样硬化、降脂、调节骨代谢等多方面作用[27],故核心药物有效成分中的β-谷甾醇,能够有效改善甲减患者血脂异常及骨质疏松等疾病。运用Cytoscape 3.9.1软件筛选出PPI互作网络中VEGFA、ESR1、PTEN、TP53、TNF、APP 等 6 个核心药物为治疗甲减的核心靶点基因。
对39个核心药物与甲减的共同靶点基因进行KEGG富集分析及GO富集分析。GO富集分析结果显示,核心药物主要通过影响以下生物调节过程来治疗甲减:细胞凋亡、基因表达、炎症反应、细胞增殖等生物过程;大分子复合体、线粒体、细胞膜、细胞因子等细胞组分;酶结合、类固醇结合、蛋白结合等分子功能。研究发现[28]:随TSH升高,甲减患者炎症介质分泌增多,脂代谢紊乱,可能影响脂蛋白氧化修饰及炎症介导等途径,导致脑组织处于缺血缺氧状态,造成能量物质生成减少,导致甲减患者认知功能受损。GO富集结果不仅与甲减复杂的发病机制有关,而且也体现中药治疗疾病多靶点的特色及其优势。
KEGG分析结果显示,核心药物治疗甲减主要通过调节癌症中PD-L1表达和PD-1关卡通路、T细胞受体信号通路、调节Th1和Th2细胞分化、脂质和动脉硬化通路、JAK-STAT信号通路、MAPK信号通路、PI3K-AKT信号通路等发挥作用。研究发现[29]:TSH、年龄和低密度脂蛋白为甲减患者发生动脉粥样硬化的独立危险因素和严重程度的影响因素。甲状腺功能减退加速动脉粥样硬化的可能机制是甲状腺激素通过激活TRα1-Erk1/2通路,抑制氧化应激,减轻氧化低密度脂蛋白诱导的巨噬细胞凋亡[30]。甲状腺激素缺乏会影响睾丸功能。甲状腺功能减退可能通过干扰雄激素受体的表达,改变Ca2+-ATP酶的活性,诱导氧化应激,进而激活睾丸线粒体中P38MAPK和JNK信号通路来影响男性生殖功能[31]。甲状腺功能减退也可通过抑制内质网表达来抑制ERK1/2和PI3K-AKT信号通路,诱导睾丸细胞凋亡[32]。研究发现[33]:艾灸关元穴能够调控PI3K-AKT通路,调节Bcl-2和Bax的平衡,抑制甲状腺滤泡上皮细胞的凋亡,调节甲状腺激素水平,改善甲状腺功能。消瘰丸治疗大鼠甲状腺功能减退伴有甲状腺肿大,可能通过调节PI3K-AKT、RAS等信号通路来调节甲状腺激素水平,缩小肿大的甲状腺[34]。进而推测核心药物主要通过对动脉硬化、JAK-STAT信号通路、MAPK信号通路、PI3KAKT信号通路的调控,从而达到治疗甲状腺功能减退症的目的。
4 结论
本研究基于中医传承辅助平台(V2.5),通过对CNKI、万方医学网、CBM中国生物医学文献数据库治疗甲状腺功能减退症的文献分析,归纳总结中医药治疗甲状腺功能减退症的遣方用药规律,对甲减-方-药之间的内在联系进行探索,基于核心药物运用网络药理学分析治疗甲减的可能作用机制。治疗甲状腺功能减退症的中药以性温、平,味甘、辛,归脾、肾、肝经,药效温补肾阳、益气健脾、补益肝肾为主。通过运用TCMSP、GeneCards、OMIM、TTD 数据库查找以“淫羊藿-熟地黄-山药-山茱萸”为首的核心药物基因及甲状腺功能减退症的基因,运用Venn Diagrams系统制作疾病药物韦恩图,应用STRING数据库、Cytoscape 3.9.1软件制作PPI互作网络图,发现核心药物可能通过 VEGFA、ESR1、PTEN、TP53、TNF、APP 等核心基因,调控细胞凋亡、基因表达、炎症反应、细胞增殖等生物过程,动脉硬化通路、JAK-STAT信号通路、MAPK信号通路、PI3K-AKT信号通路等环节发挥作用,提示中医药治疗甲减具有多成分、多靶点、多通路的作用特点。此次数据挖掘和网络药理学研究为中医药治疗甲减提供指导和理论依据,同时,该数据分析方法有一定的局限性,研究结果仍需结合中医理论基础、临床实践及药效实验验证,进行综合分析。
