环纹奥斯特线虫PCR-ELISA快速检测方法的建立
2023-01-08李永光文育胜刘雯雯赵涛魏芳祁光宇
李永光,文育胜,刘雯雯,赵涛,魏芳,祁光宇
(1.甘肃农业大学应用技术学院,甘肃 定西 730500;2.甘肃省定西市临洮农业学校,甘肃 定西 730500;3.中农威特生物科技股份有限公司,甘肃 兰州 730046)
奥斯特线虫主要分布在温带和气温较凉爽的地区,主要感染牛、绵羊、山羊和其他家养和野生反刍动物,也可以感染人。给养殖业带来巨大的经济损失,并且危害人类身体健康[1-2]。奥斯特线虫通常和东方毛圆线虫、捻转血矛线虫、羊仰口线虫、甘肃食道口线虫等消化道线虫混合感染,对上述消化道线虫的诊断,具有重要的经济学意义[3]。传统上对线虫的诊断主要依靠第3阶段幼虫(L3)的孵化和其形态差别,费时费力[4-6],且特异性和敏感性较低[7-8],传统形态学方法对形态相似的虫种进行鉴别存在较大的局限性。电镜虽可以将不同虫种准确区分,但需要专业人员,成本高,不适用于大样本研究[9]。奥斯特线虫寄生于牛羊皱胃和十二指肠,粪便抗原免疫学检测可以作为其诊断方法之一,Agneessens等2001年建立了一种关于胃部感染线虫检测粪便虫体抗原的捕获ELISA方法,敏感性较好,但是特异性较差,很难在临床上应用[10]。奥斯特线虫虫卵随牛羊粪便排出体外,粪便虫卵检测在一定程度上可以对奥斯特线虫感染做出定性诊断[11]。为克服形态学和免疫学诊断的局限性,分子生物学方法已经用于小反刍动物[12-15]和牛[16-18]的重要胃肠道线虫的鉴别诊断。
PCR-ELISA方法具有更快的诊断速度和更高的灵敏度,为寄生虫的鉴别诊断、分类和流行病学调查提供了简便的方法[19-20]。目前该方法已经广泛应用于动植物检疫、医学、食品等多个学科[21-24]。核糖体DNA中介于5.8S,18S和28S之间的内转录间隔区(ITS),包括ITS-1和ITS-2 2段序列,由于ITS区受到的选择压力较小,进化速度快且长度不大,加上协同进化使该片段在基因组不同单元间极其一致,且5.8S,18S和28S rDNA的高度保守,便于设计引物进行动物寄生虫的种间以及株间的分类鉴定,可以利用ITS的基因结构特点建立特异的检测方法[25-26]。因此,本研究以环纹奥斯特线虫的ITS-2为靶基因,通过条件筛选,旨在建立环纹奥斯特线虫PCR-ELISA的快速检测方法,为临床环纹奥斯特线虫病的批量诊断服务。
1 材料与方法
1.1 材料
1.1.1 试验样品环纹奥斯特线虫、东方毛圆线虫、捻转血矛线虫、羊仰口线虫、甘肃食道口线虫由中国农业科学院兰州兽医研究所家畜寄生虫病创新团队提供。
1.1.2 试剂与耗材链霉亲和素和辣根过氧化物酶标记的抗地高辛抗体购于Sigma公司;BSA、TMB显色液购于Solarbio公司;质粒提取试剂盒和胶回收试剂盒购于OMEGA公司;pMD 19-T载体和DNA提取试剂盒购于Takara公司;引物由生工生物工程(上海)股份有限公司;其余试剂均为化学分析纯。
PCR仪购于Bio-Rad公司;电泳仪、电泳槽及凝胶成像仪购于北京六一生物科技有限公司。
1.2 方法
1.2.1 引物设计与合成根据GenBank数据库检索到的Ostertagia circumcincta间隔区ITS-2基因序列,在NCBI对ITS-2基因序列进行比对,用Oligo 6引物分析软件,设计1对特异性引物。引物由生工生物工程(上海)股份有限公司合成。

1.2.2 样品寄生虫DNA提取及环纹奥斯特线虫ITS-2基因PCR产物克隆鉴定、测序取1.1.1中的环纹奥斯特线虫、东方毛圆线虫、捻转血矛线虫、羊仰口线虫、甘肃食道口线虫样品,按TaKaRa DNA提取试剂盒操作步骤提取上述寄生虫基因组DNA,4℃保存备用。用设计合成的引物对环纹奥斯特线虫的基因组DNA进行PCR扩增,反应程序:95℃预变性5 min;95℃变性30 s,57℃退火30 s,72℃延伸30 s,35个循环;72℃延伸10 min。将回收后的DNA连接到载体pMD 19-T构建pMD 19-T-ITS-2质粒。将鉴定为阳性的质粒送生工生物工程(上海)股份有限公司进行序列测定,对序列进行比对和分析。
1.2.3 引物标记以及PCR扩增在引物的上下游5'端分别标记上地高辛(DIG)和生物素(BIO),由生工生物工程(上海)股份有限公司合成1对PCRELISA所需要的引物。

反应程序:95℃预变性5 min;95℃变性30 s,57℃退火30 s,72℃延伸30 s,35个循环;72℃延伸10 min。
1.3 环纹奥斯特线虫ITS-2基因PCR-ELISA检测方法的建立
1.3.1 链霉亲和素最佳包被浓度的确定用0.05 mol/L、pH为9.6的碳酸盐缓冲液,把链霉亲和素(1 mg/mL)倍比稀释为10、5、2.5、1.25、0.625、0.3125、0.156 25 μg/mL,200 μL/孔包被酶标板,4℃湿盒过夜,按照稀释后的浓度进行PCR-ELISA检测,依据D450nm以及P/N值确定链霉亲和素的最佳包被浓度。
1.3.2 最佳封闭液浓度和封闭时间的确定按照1.3.1筛选出的链霉亲和素的最佳包被浓度包被酶标板,分别用1%、2%、3%、4%、5%、6%和8%的BSA封闭液封闭,以标记引物所扩增出的PCR产物作为一抗,用1∶2 000稀释的HRP标记的抗地高辛抗体作为二抗,将封闭时间设定为10、20、30、45、60、90、120 min,进行PCR-ELISA检测,确定最佳封闭液浓度和封闭时间。
1.3.3 一抗最佳反应时间的确定按照1.3.1和1.3.2筛选出的最佳包被浓度和最佳封闭条件,以标记引物所扩增出的PCR产物作为一抗,将PCR产物加入酶标板的反应时间分别设定为5、l0、20、30、40、50、60 min,进行PCR-ELISA检测,确定一抗最佳反应时间。
1.3.4 酶标二抗最佳反应条件的确定根据1.3.3筛选出的最佳反应条件进行PCR-ELISA,将HRP标记的抗地高辛抗体(1 mg/mL)按照1∶500依次倍比稀释至1∶32 000,将二抗反应时间依次设定为5、l0、20、30、40、50、60 min,根据结果确定最佳反应条件[27]。
1.3.5 最佳显色时间的确定根据上述最佳反应条件进行PCR-ELISA的测定,37℃条件下,将显色时间设置为1、3、5、10、15、20 min,根据结果确定最佳反应条件。
1.3.6 PCR最佳循环次数的确定以Ostertagia circumcincta间隔区ITS-2设计的引物,进行PCR扩增,将PCR循环数分别设置为5、10、15、20、25、30和35,进行PCR-ELISA检测,根据结果确定最佳循环次数。
1.3.7 PCR-ELISA临界值的测定利用建立好的PCR-ELISA检测方法,对己知的42份环纹奥斯特线虫阴性样品进行检测,根据测得的D450nm值进行统计分析。
1.3.8 敏感性试验用超纯水将环纹奥斯特线虫阳性DNA进行10倍梯度稀释,稀释浓度分别为4.1 ng/μL、410 pg/μL、41 pg/μL、4.1 pg/μL、410 fg/μL、41 fg/μL,按所建立的PCR-ELISA方法进行检测,与常规PCR作比较,评价其敏感性。
1.3.9 特异性试验对环纹奥斯特线虫、东方毛圆线虫、捻转血矛线虫、羊仰口线虫、甘肃食道口线虫基因组DNA,按所建立的PCR-ELISA方法进行检测,评价其特异性。
1.3.10 重复性试验用同一批次包被的酶标板对环纹奥斯特线虫病的4份阳性样品和1份阴性样品进行重复性试验,每份样品重复检测5次,评价其批内重复性。用不同批次包被的酶标板对环纹奥斯特线虫病的4份阳性样品和1份阴性样品进行重复性试验,每份样品重复检测5次,评价其批间重复性,测定其D450nm值,计算变异系数。
2 结果与分析
2.1 PCR产物克隆鉴定与测序
对环纹奥斯特线虫基因组DNA PCR产物和重组克隆质粒pMD19-T-ITS-2 PCR产物,用1.5%琼脂糖凝胶电泳,90 V电压电泳40 min,均可以检测到大小约196 bp的条带,与预期大小相符(图1)。

图1 重组质粒pMD19-T-ITS-2的PCR鉴定结果(196 bp)Figure 1 PCR results of pMD19-T-ITS-2 plasmid
测序结果显示,重组质粒pMD19-T-ITS-2基因中的目的基因片段大小为196 bp,与试验预期结果相符,其序列与GenBank中己经发表的Osterta⁃gia circumcincta间隔区ITS-2基因序列同源性为99%,用BLAST软件对序列进行分析比对结果如图2所示。

图2 重组克隆质粒pMD19-T-ITS-2测序结果Figure 2 Sequencing results of pMD19-T-ITS-2 plasmid
2.2 环纹奥斯特线虫ITS-2基因PCR-ELISA检测方法的建立
2.2.1 链霉亲和素最佳浓度的确定由表1可知,当链霉亲和素浓度为1.25 μg/mL时,P/N=17.29的值最大,确定链霉亲和素的最佳包被浓度为1.25 μg/mL。

表1 链霉亲和素包被浓度的确定Table 1 Screening of the suitable concentration of streptavidin
2.2.2 最佳封闭液浓度和封闭时间的确定由表2可知,当封闭液浓度为3%,封闭时间为30 min时,P/N=14.57值最大,确定BSA封闭液最佳封闭浓度为3%,最佳封闭时间为30 min。

表2 封闭液各工作浓度及时间的确定Table 2 Screening of sealing solution concentration and sealing time
2.2.3 一抗最佳反应时间的确定由表3可知,当PCR产物反应20 min时,P/N=20.40值最大,确定一抗反应最佳时间为20 min。

表3 一抗最佳反应时间的确定Table 3 Screening of the optimum reaction time of pri‐mary antibody
2.2.4 酶标二抗条件的确定由表4可知,当HRP标记的抗地高辛抗体浓度为1∶2 000,反应时间为20 min时,P/N=14.09值最大,确定二抗最佳稀释浓度为1∶2 000,最佳反应时间20 min。
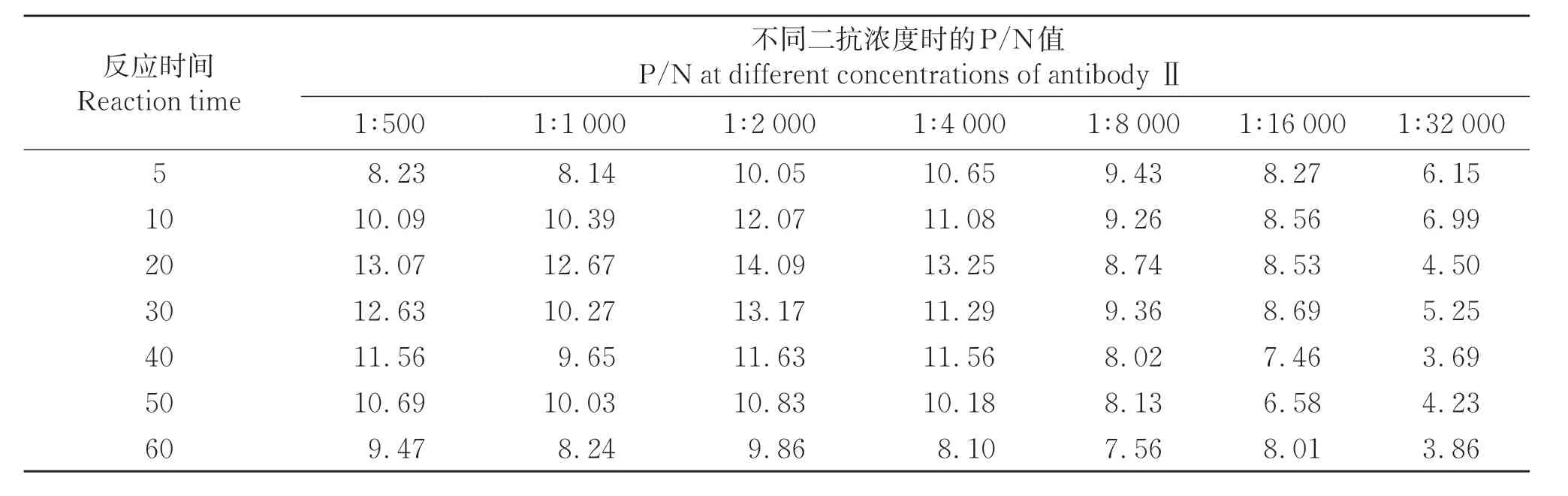
表4 二抗最佳反应浓度和反应时间的确定Table 4 Screening of the optimum reaction concentration and time of antibodyⅡ
2.2.5 最佳显色时间的确定根据上述最佳反应条件进行PCR-ELISA,由表5可知,当显色时间为5 min时,P/N=15.50值最大,符合检测要求。
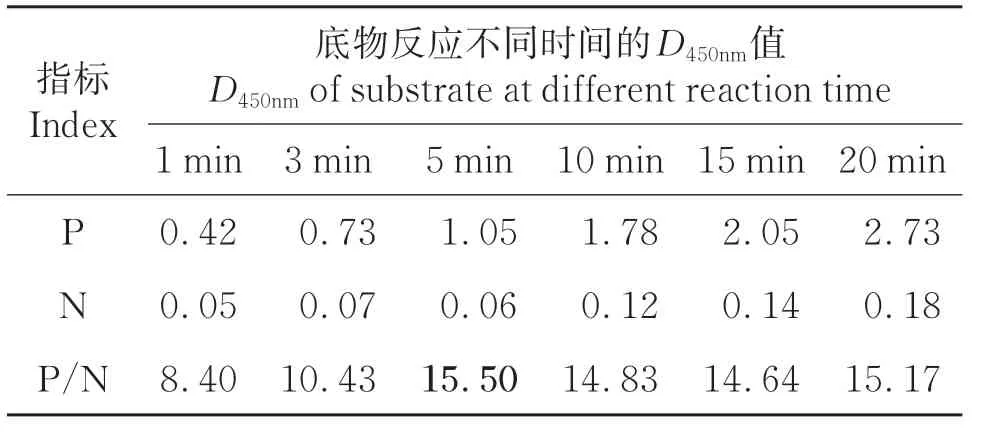
表5 最佳显色时间的确定Table 5 Screening of the optimal reactive time of the substrate
2.2.6 PCR最佳循环次数的确定由表6可知,当循环数为30个循环时,P/N值=19.50最大。确定PCR扩增的最佳循环次数为30个循环。

表6 PCR扩增最佳循环次数的确定Table 6 Screening of the optimal cycle times for PCR amplification
2.2.7 PCR-ELISA临界值的测定对42份样品数据统计分析,根据SPSS软件计算得到平均值X=0.17,标准方差SD=0.05,校正值=X+3SD=0.32,当样品PCR-ELISA检测D450nm≥0.32时,判定为环纹奥斯特线虫阳性,当D450nm<0.32时,判定为阴性样本。
2.2.8 敏感性检测由图3和表8可知,PCRELISA可检测出环纹奥斯特线虫DNA的最低浓度为410 fg/μL,而常规PCR可以检测最低模板浓度为4.1 pg/μL,证明PCR-ELISA的敏感性比常规PCR高10倍。

表8 PCR-EL1SA敏感性试验Table 8 The sensitivity test of PCR-ELISA
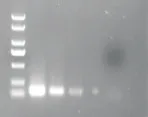
图3 PCR敏感性检测Figure 3 The Sensitivity of PCR

表7 PCR-ELISA临界值确定Table 7 Determination of PCR-ELISA threshold values
2.2.9 特异性检测用所建立的PCR-ELISA检测方法对奥斯特线虫、东方毛圆线虫、捻转血矛线虫、羊仰口线虫、甘肃食道口线虫DNA进行检测,结果如表9所示。奥斯特线虫D450nm为0.36,大于校正值0.32,检测结果为阳性,其他病原体D450nm均小于0.32,结果为阴性。证明本研究建立的PCR-ELISA检测方法特异性好,无交叉反应。

表9 PCR-ELISA特异性试验Table 9 The Specificity test of PCR-ELISA
2.2.10 重复性试验用同一批次包被的酶标板进行批内重复性试验,由表10可知,5份样本的变异系数分别为4.00%,2.70%,3.00%,5.10%,7.90%,变异系数均低于8%,说明建立的PCR-EL1SA检测方法的批内重复性良好。

表10 PCR-EL1SA批内重复性试验Table 10 The within-run repetive experiments of the PCR-EL1SA
用同一批次包被的酶标板进行批间重复性试验,由表11可知,5份样本的变异系数分别为3.80%,5.80%,7.10%,4.50%,7.80%,变异系数均低于10%(表11),说明建立的PCR-EL1SA检测方法的批内重复性良好。

表11 PCR-EL1SA批间重复性试验Table 11 The between-run repetive experiments of the PCR-EL1SA
3 讨论
PCR-ELISA检测是将PCR扩增目的基因与ELISA准确定量相结合的一种检测方法,该方法将PCR检测的快速性与ELISA检测的敏感性有机结合,使生物信号逐级放大,具有敏感、特异、可大量检测样品等优点[28-30],为医疗、兽医和农业等行业重要的检测方法[31]。该方法可直接通过读取D450nm值判断结果,减少了人为因素对结果的影响,同时无需接触溴化乙锭(EB)致癌物质,减少了对试验人员和环境的潜在危险。
本试验对奥斯特线虫ITS⁃2基因的保守序列设计引物,在上下游引物的5’端分别标记生物素和地高辛,利用生物素和链霉亲和素特异性结合的原理,带有标记的PCR产物与链霉亲和素结合,酶标二抗与地高辛结合。链霉素和生物素的结合能力是普通抗原抗体结合能力的106倍,“链霉亲和素-生物素”系统是PCR-ELISA检测的最好搭档[32-35]。通过对链霉亲和素的包被浓度、包被条件、封闭液浓度及封闭时间、PCR产物反应时间、二抗工作浓度以及反应时间等条件进行优化,最终筛选出最佳奥斯特线虫PCR-ELISA反应条件。
本试验对PCR扩增的平台期摸索确立了最佳循环次数,分别以5、10、15、20、25、30和35循环数进行扩增并检测,结果显示30个循环数时,扩增效率己经达到最高,确定最佳循环数为30个循环,此时最为省时高效。同时,在试验过程中对各个反应条件进行优化,最终确定最佳包被条件为1.25 μg/mL的链霉亲和素4℃包被过夜,3%的BSA封闭液37℃条件下封闭20 min,PCR产物37℃作用20 min,HRP标记的抗地高辛抗体2 000倍稀释的酶标二抗(1 mg/mL)37℃反应20 min,显色5 min。经过条件优化,本试验建立的PCR-ELISA检测方法比原来节省了0.5~1 h左右。
本试验建立的奥斯特线虫PCR-ELISA可检测出样本的最低浓度为410 fg/μL,而常规PCR可以检测最低模板浓度为4.1 pg/μL,证明PCR-ELISA的敏感性比常规PCR高10倍,并与东方毛圆线虫、捻转血矛线虫、羊仰口线虫、甘肃食道口线虫无交叉反应,说明其特异性好。对相同模板进行批间和批内重复性进行检测,检测结果显示变异系数均低于10%,说明建立的PCR-ELISA方法批内批间重复性良好,证明本试验建立的PCR-ELISA检测方法稳定性高。本试验所建立的PCR-ELISA检测方法具有高效、快速、灵敏、特异、安全等优势,可以快速、准确的检测奥斯特线虫,为调查和预警提供技术支持。
