外源6-BA对干旱胁迫下苹果砧木M26的生理效应
2023-01-08李彩龙李毛毛高彦龙张仲兴张德王双成缐旭林王延秀
李彩龙,李毛毛,高彦龙,张仲兴,张德,王双成,缐旭林,王延秀
(甘肃农业大学园艺学院,甘肃 兰州 730070)
干旱胁迫下,植物通过关闭气孔,降低生理活动来减少水分散失,并通过增加渗透调节物质维持正常生理活动[1]。气孔关闭会阻碍光合气体交换,造成光合作用下降[2-3]。在我国西北干旱和半干旱地区,水分短缺是果树生长的主要限制因子[4]。研究表明,外源添加肌醇[5]、褪黑素[6]、水杨酸、脱落酸和海藻提取物[7]等均可不同程度提高苹果的耐旱性。因此,筛选缓解干旱胁迫适宜浓度的外源物,对西北地区苹果产业的发展具有重大意义。
6-BA属广谱型植物生长调节剂,在促进细胞生长和营养物质运输方面具有重要作用[8]。前人在黄柏[9]、辣椒[10]上的研究表明,6-BA可以提高植物对低温弱光环境的抵抗性。Chen等[11]研究认为,施用6-BA能增加芥菜的生长量和总叶绿素含量。有学者发现,6-BA通过调节脂肪酸代谢的相关过程,进而平衡蛋白质代谢,改善植物生理状态[12]。杨艳华等[13]在水稻上的研究表明,缺镁胁迫会对植物代谢造成一定的破坏,而喷施6-BA可在一定程度上缓解缺镁胁迫对植物造成的伤害,改善缺镁造成的植物营养缺乏症。盐胁迫下,6-BA可通过清除体内多余的自由基,减轻盐害,增强植物的耐盐性[14]。刘凯歌等[15]发现,喷施外源6-BA可有效降低高温胁迫下甜椒幼苗叶片的超氧阴离子产生速率、MDA含量以及相对电导率,进而维持甜椒正常的光合作用和生长。目前已有诸多6-BA在作物抗性上的研究报道,但在苹果砧木上研究报道较少,因此本试验以此为切入点,展开研究。
20世纪60年代,我国从欧洲引进M26,其树势中庸,生根较好,嫁接亲和性良好,较抗寒,具有良好的早实性和丰产性等特点,但其耐旱性差[16]。本试验以树龄2 a的M26自根砧为材料,探讨干旱胁迫下M26对外源6-BA的生理响应,以期为外源6-BA处理下苹果砧木抗旱性研究及栽培生产提供科学依据。
1 材料与方法
1.1 材料与处理
本试验选用树龄2 a生长势一致的M26自根砧苗72株,栽入装有3 kg基质,质量0.7 kg的花盆中,每盆1株,培养30 d后,采用称重法控制土壤含水量,进行干旱胁迫处理,保持干旱处理的含水量为田间持水量的(50±2)%。干旱胁迫前花盆浇透水,然后使其自然落干,每天称重补水,使土壤含水量控制在设定的相对含水量,连续控水。试验设6个处理,以土壤含水量为田间持水量的80%为对照(CK)、干旱胁迫(T1)、干旱胁迫+25 mg/L6-BA(T2)、干旱胁迫+50 mg/L6-BA(T3)、干旱胁迫+75 mg/L6-BA(T4)、干旱胁迫+100 mg/L 6-BA(T5),每处理3次重复,每次重复4株(4盆)。其中,6-BA溶液以叶片喷施的方式于每日18∶00喷施,每盆均匀喷施25 mL,每隔5 d喷施1次,共喷施3次,CK喷施等量清水。干旱胁迫处理次日开始计算胁迫时间,于胁迫第0、5、10、15、20天时选取生长一致的中上部相同节位叶片进行各项指标测定。
1.2 测定指标与方法
1.2.1 生理指标的测定叶绿素含量测定:分别在干旱胁迫第0、5、10、15、20天时采样,用蒸馏水将叶片表面清洗干净,用80%丙酮浸泡24 h后提取,测定665、649 nm下的吸光度,代入公式计算Chl a和Chl b的含量,两者之和为Chl(a+b),两者之比为Chl a/b[17]。
光合参数:采用便携式光合仪(LI-6400,LICOR,Linco ln,NE,USA),于干旱胁迫的第0、5、10、15、20天上午9∶00~11∶00,选取向阳成熟叶片测定净光合速率(Pn)、蒸腾速率(Tr)、胞间CO2(Ci)、气孔导度(Gs),每个处理选取3株。
荧光参数:采用IMAG-ING-PAM叶绿素荧光成像仪测定荧光参数,与光合参数测定同步,经30 min暗处理后测定。并用Imaging Win Geg E software(Walz,Ef-feltrich,Germany)软件(Walz,Ef‐feltrich,德国)分析数据。
其他参数:分别在胁迫第0、5、10、15、20天取植株中上部功能叶片,擦洗干净,去掉叶脉进行相关指标测定。相对电导率(REC)采用电导仪法[18],游离脯氨酸(Pro)含量采用酸性茚三酮法[19],超氧化物歧化酶(SOD)采用氮蓝四唑光化还原法[20],过氧化物酶(POD)采用愈创木酚法[21],过氧化氢酶(CAT)采用紫外吸收法[21],丙二醛(MDA)含量采用硫代巴比妥酸(TBA)法[22],可溶性糖(SS)含量采用蒽酮比色法[23]测定。
1.2.2 主成分分析综合得分主成分分析综合得分(F)是每个主成分得分与对应贡献率乘积之和。
1.3 数据处理与分析
试验用Origin 2018和Excel 2016进行数据处理及作图,采用SPSS 22.0单因素ANOVA的LSD法比较差异显著性(α=0.05)。
2 结果与分析
2.1干旱胁迫下外源6-BA对M26叶片叶绿素含量的影响
由图1-A可得,随着胁迫时间的延长,Chl a含量呈不断下降趋势。胁迫第5天时,随外源物浓度升高,Chl a含量呈现先升后降的趋势。胁迫至第20天时,各处理Chl a含量均达到最小值,分别为16.52(T1)、21.07(T2)、26.23(T3)、22.74(T4)、18.37 mg/g(T5),显著低于38.04 mg/g(CK)。其中T3降幅最小,为30.99%;T1降幅最大,为56.02%。
图1-B表明,Chl b与Chl a的趋势相同,胁迫期间呈下降趋势。胁迫至第10天时,Chl b含量出现明显的下降。胁迫至第20天,各处理的Chl b含量均达到最低值,且均显著低于CK。其中,T3的降幅最小,为13.89%。
同Chl a与Chl b变化趋势一致,Chl(a+b)含量随胁迫时间的延长不断下降(图1-C)。胁迫至第10天时,随6-BA浓度的增加,Chl(a+b)含量呈先升后降的趋势。至第20天时,各处理Chl(a+b)含量均达最小值,均显著低于CK,但不同处理的降幅不同。T3的降幅最小,为23.64%。
在干旱胁迫下,随时间延长,M26叶片的Chl a/b呈下降的趋势(图1-D)。胁迫至第20天时,各处理Chl a/b含量均达到最小值,分别为T1(0.95)、T2(1.12)、T3(1.21)、T4(1.11)和T5(1.03),均显著低于CK(1.50)。T3的降幅最小,为19.33%;T1降幅最大,为35.37%。
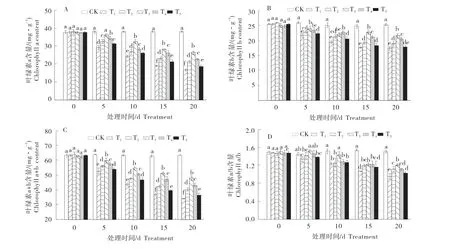
图1 干旱胁迫下外源6-BA对M26叶片光合色素含量的影响Figure 1 Effects of exogenous 6-BA on photosynthetic pigment content of M26 leaves under drought stress
2.2 干旱胁迫下外源6-BA对M26叶片光和特性的影响
图2-A表明,随处理时间延长,M26叶片的Gs呈逐渐降低的趋势,CK无明显变化。胁迫至第20天时,各处理的Gs均达到最小值,较CK分别降低47.81%、49.33%、46.13%、42.74%、44.61%,T4降幅最小。
由图2-B可知,胁迫时间至第20天,不同处理下的Pn均降到最低,分别为7.55(T1)、7.51(T2)、7.50(T3)、7.31(T4)、7.45(T5),均显著小于CK(9.12)。
与Gs和Pn变化趋势相反,随着处理时间的持续,M26叶片的Ci呈不断上升趋势(图2-C)。胁迫至第10天时,Ci已出现明显的增加。第20天时,各处理的Ci均达最大值,均显著高于CK。其中,T5升幅最大,为26.08%;T3升幅最小,为24.56%。
M26叶片Tr的变化趋势同Pn大致相似,呈逐渐降低趋势(图2-D)。胁迫至第10天时,随6-BA浓度增加,Tr呈先升后降的趋势。第20天时,各处理Tr出现大幅度下降,达到最低值,均显著低于CK。与CK相比,T3降低26.50%,T5降低28.55%。
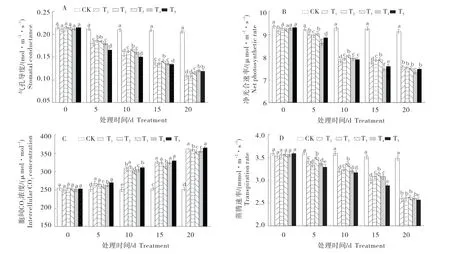
图2 干旱胁迫下外源6-BA对M26叶片光合特性的影响Figure 2 Effects of exogenous 6-BA on photosynthetic characteristics of M26 leaves under drought stress
2.3 干旱胁迫下外源6-BA对M26叶片荧光参数的影响
由图3-A可知,随着处理时间的延长,F0呈现持续下降的趋势,CK无明显变化。胁迫至第20天时,各处理的F0分别下降到0.17、0.17、0.17、0.16、0.14,均显著小于CK(0.25)。其中,T5的降幅最大,为44.58%。
图3-B显示,随着胁迫时间的延长,Fm值出现逐渐下降的趋势,具有浓度效应,不同浓度处理下降幅不同,CK无明显变化。胁迫至第10天时,Fm出现明显的下降趋势。第20天时,各处理均达最低值,较对照分别下降47.54%、46.97%、51.61%、51.67%、48.15%。
与F0和Fm的变化趋势相同,随着处理时间的延长,Fv/Fm呈现不断下降的趋势(图3-C)。在处理的各时间段,T3处理下Fv/Fm下降最小,表明T3浓度可能为缓解干旱胁迫较适宜的浓度。胁迫至第20天时,各处理下降到最小值,分别为0.40(T1)、0.47(T2)、0.46(T3)、0.42(T4)、0.41(T5),均 显 著 低 于CK。

图3 干旱胁迫下外源6-BA对M26叶片荧光特性的影响Figure 3 Effect of exogenous 6-BA on fluorescence characteristics of M26 leaves under drought stress
2.4 干旱胁迫下外源6-BA对M26叶片MDA含量和相对电导率的影响
由图4-A显示,随干旱胁迫时间的延长,MDA含量不断上升。随着外源6-BA浓度不断增加,胁迫第5天时,MDA含量变化幅度较小,在第10、15、20天时出现明显的先降后升。胁迫至第20天时,各处理MDA含量达到最大,分别为6.02(T1)、5.88(T2)、5.55(T3)、5.44(T4)、5.69(T5)μmol/g(T5),与CK相比分别提高41.99%、40.61%、37.15%、35.88%、38.63%。
由图4-B表明,随着胁迫时间的持续,M26叶片的REC呈上升趋势,胁迫至第10天时,REC呈先降后升的趋势,前5 d变化幅度不大,随时间的延长,变化趋势越来越明显,且T4为最低值。胁迫至第20天时,各处理REC达到最大值。其中,T1升幅最大,T4升 幅 最 小,较CK(26.47)分 别 升 高96.11%和27.96%。

图4 干旱胁迫下外源6-BA对M26叶片MDA含量和相对电导率的影响Figure 4 Effects of exogenous 6-BA on MDA and REC in M26 leaves under drought stress
2.5 干旱胁迫下外源6-BA对M26叶片渗透调节物质含量的影响
由图5-A可知,随胁迫时间的延长,Pro含量不断增加,CK无显著变化。在胁迫第5天时,随浓度增加Pro含量先升后降。胁迫至第20天时,各处理上升到最高点。其中,T4处理升幅最大,T1处理升幅最小,相比于CK分别升高37.86%和24.51%。
由图5-B可得,在干旱胁迫至第15天时,各处理的SS含量达到最大值,分别为9.78(T1)、11.85(T2)、14.33(T3)、16.69(T4)、13.01 μmol/g(T5)。与CK相比,T1增 幅 最 小,为38.22%;T4增 幅 最 大,为63.80%。

图5 干旱胁迫下外源6-BA对M26叶片Pro、SS含量的影响Figure 5 Effects of exogenous 6-BA on Pro and SS in M26 leaves under drought stress
2.6 干旱胁迫下外源6-BA对M26叶片抗氧化酶活性的影响
由图6-A可知,随着胁迫的持续,各处理的SOD活性呈现先升后降的趋势。胁迫至第5天时,SOD活性达到最大值。胁迫至第20天时下降到最小值,其中降幅最大和最小的为T1和T3处理,分别较CK降低31.09%和16.43%。
由图6-B可以看出,随胁迫时间的延长,CAT活性呈不断下降趋势。胁迫至第5天时,不同浓度处理下,CAT活性呈先升后降的趋势。除第15天和第20天时T2和T5为最小值,其余胁迫时间段最小值均为T1。胁迫至第20天时CAT活性最小,其中T4活性最大,为170.15 U/g;T5活性最小,为146.31 U/g,且均显著小于CK。
同SOD的变化趋势相似,随着处理时间的持续,POD活性呈现先升后降的趋势(图6-C)。胁迫至第5天时,各处理达最大值。胁迫至第20天时,各处 理 的POD下 降 到 最 低,分 别 为129.65(T1)、136.26(T2)、161.65(T3)、148.26(T4)、143.51 U/g(T5),显著小于CK(205.96 U/g),相比于CK分别下降37.05%、33.84%、21.52%、28.02%、30.32%。

图6 干旱胁迫下外源6-BA对M26叶片SOD、POD、CAT活性的影响Figure 6 Effects of exogenous 6-BA on SOD,POD and CAT in M26 leaves under drought stress
2.7 干旱胁迫下外源6-BA对M26叶片生理效应的综合评价
2.7.1 相关性分析对干旱胁迫后M26的18个指标进行相关性分析,见表1。结果表明,M26叶片的Pn与Gs、F0、Fm、Fv/Fm呈极显著正相关(P<0.01);与Chl a、Chl(a+b)、Chl a/b、SOD呈显著性正相关(P<0.05);与Ci、Pro呈极显著负相关(P<0.01);与MDA呈显著负相关(P<0.05)。
2.7.2 主成分分析对所有处理中的18个指标进行主成分分析,提取特征值大于1的3个主成分,其特征值分别为14.38、1.87、1.49,累计方差贡献率为98.55%,符合分析要求。表2显示,第一主成分(PC1)综合Gs、Tr、Fm、Fv/Fm等指标;第二主成分(PC2)综合Ci、Chl a、Chl b、Chl(a+b)、Chl a/b、Pro、SS、POD、SOD等指标;第三主成分(PC3)综合Pn、MDA、REC、CAT、F0等指标。由表3知,各处理的综合得分分别为1.555(CK)、-0.563(T1)、-0.234(T2)、0.073(T3)、-0.152(T4)、-0.679(T5)。M26在不同浓度6-BA处理下的综合得分排名为CK>T3>T4>T2>T1>T5。

表2 主成分分析方差解释Tab2 Total variance explained
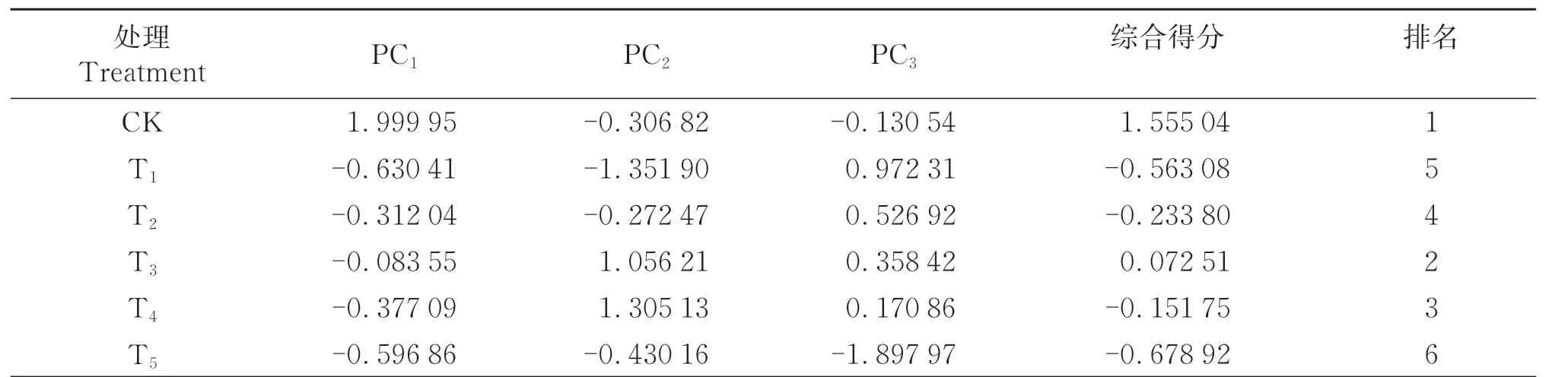
表3 M26在不同处理下的综合得分及排名Table 3 comprehensive scores and ranking of M26 under different treatments
3 讨论
叶绿素是叶片吸收和转化光能的主要光合色素,若植物长时间处于胁迫条件下,叶绿素与叶绿体蛋白结合就会变得松弛,从而叶绿素被分解,光合速率下降[24]。胡雪琴等[25]在水稻上的研究中发现,在干旱胁迫下,适宜浓度的6-BA可使水稻叶内形成气腔,促使叶增厚,减少叶肉细胞内叶绿体及叶绿素的降解。本研究表明,随着干旱胁迫的持续,各处理叶绿素含量均有所下降。其原因可能是干旱胁迫破坏了叶绿体结构,影响了叶绿素合成。通过喷施不同浓度的6-BA,叶绿素含量下降速率有所减缓,表明6-BA可以缓解这种伤害,缓解的效果与6-BA施用浓度有关。

光合系统的正常运转对植物生长发育具有重要意义[26]。研究表明,胁迫对植物光合作用的影响分为气孔限制和非气孔限制[27],其不同之处在于Gs与Ci的变化趋势是否相同,若一致则是气孔因素造成,反之则是由非气孔因素引起[28]。本试验中,当Gs下降的同时Ci升高,表明光合作用受非气孔因素影响,可能是胁迫导致光和电子传递受阻,影响卡尔文循环相关酶的活性,减慢CO2同化效率,使Gs下降、Ci升高[29]。叶绿素荧光技术可作为测定植物光合作用的无损探针[30]。一般认为,F0降低表明PSII天线色素的热耗散增加,而F0升高表明PSII反应中心受到伤害[31]。Fm是PSⅡ反应中心处于完全关闭时的荧光产量,可反映经过PSⅡ的电子传递情况。Fv/Fm的变化反映胁迫下PSII的损伤程度,Fv/Fm下降越多,表示PSII损伤越大[32]。持续干旱,F0不断下降,这可能是M26叶片为减轻光抑制,避免伤及PSII反应中心所致。Fm逐渐下降,可能是干旱胁迫使光合电子传递受阻。Fv/Fm也持续下降,说明PSII反应中心可能受到更严重的伤害[33]。喷施不同浓度外源6-BA后,M26叶片的F0、Fm、Fv/Fm都在不同程度上有所提高,说明外源6-BA可能增强了干旱胁迫下PSII电子传递活性和通过热耗散实现光保护机制。然而,光合系统运转是一个复杂的过程,6-BA具体作用机制还需进一步研究。
细胞膜对于维持细胞代谢具有重要意义。干旱胁迫可以改变细胞膜的通透性,细胞内电解质外渗,相对电导率升高。相对电导率是反映植物细胞膜稳定性的一项重要生理指标[34]。本试验中,随着干旱胁迫的持续,REC呈升高的趋势,是由于干旱胁迫使膜的通透性增大,电解质外渗[35]。喷施6-BA后,减缓了REC的上升速率,且随着6-BA浓度的增大,REC呈先降后升的趋势,说明外源6-BA对干旱胁迫引起的膜透性变化具有保护作用,且浓度过低或过高,保护作用减弱。在逆境条件下,常常发生膜脂过氧化作用,MDA是其产物之一,能反映膜系统受损程度[36]。本研究中,随着干旱胁迫的持续,MDA呈升高趋势,这表明膜系统受损,质膜发生过氧化。喷施6-BA后,MDA上升速率减慢,可能是6-BA增强了保护酶活性和生物膜稳定性,缓解了干旱对M26植株的伤害。
植物长时间生存在逆境环境下,渗透平衡会受到严重破坏,此时植物自身会合成渗透调节物质,保证植物正常生长。本试验中,随胁迫时间延长,M26植株体内Pro大量积累,说明M26可以通过积累渗透调节物质来抵抗干旱胁迫,喷施外源6-BA后Pro含量进一步升高,从而缓解干旱对M26造成的伤害,这与张晓燕等[37]的研究结果相似。SS可作为渗透调节因子,调节细胞渗透势,提高组织保水能力,进而维持细胞形态[38]。本研究发现,在干旱胁迫至第20天时,SS含量相比CK有所升高。相比干旱处理,喷施6-BA后SS含量上升更高,说明外喷6-BA能促进胁迫处理后M26幼苗渗透调节物质的合成积累。
干旱胁迫下植物会产生大量活性氧,对植物产生毒害,影响其正常生长,而SOD、POD、CAT作为植物体内重要抗氧化防御系统,可清除植物体内的活性氧,使膜脂过氧化程度及膜受损程度降低[39]。本试验中,随着干旱胁迫时间的延长,SOD和POD活性呈先升后降的趋势,而CAT活性则是不断降低,这可能是干旱胁迫导致过氧化程度加剧,质膜受损。喷施外源6-BA后,SOD、POD、CAT的活性显著高于未喷施的处理,表明喷施外源6-BA可以提高SOD、POD和CAT的活性,保持活性氧清除系统的动态平衡,维持植物在干旱条件下的生长。这与前人在油茶[40]、水稻[41]、紫花苜蓿[42]研究中得到的结论相似。
植物的抗旱性受多种因素影响,单个指标不能准确反映植物抗旱的主要机制,因此,本试验中选用M26的18个指标进行耐旱性的综合评价。相关性分析表明,M26叶片的Pn与Gs、F0、Fm、Fv/Fm呈极显著正相关(P<0.01),与Chl a、Chl(a+b)、Chl a/b、SOD呈显著正相关(P<0.05),这说明Gs、F0、Fm、Fv/Fm的降低是M26适应干旱胁迫的重要机制,且Chl a、Chl(a+b)、Chl a/b、SOD含量的降低也是影响Pn降低的原因。Pn与Ci、Pro呈极显著负相关(P<0.01),与MDA呈显著负相关(P<0.05),这说明当Pn下降时,M26还通过积累Ci、Pro、MDA等物质来调节干旱胁迫对M26植株的伤害[43]。因此,可用Gs、F0、Fm、Fv/Fm、Ci、Pro、Chl a、Chl(a+b)、Chl a/b、SOD、MDA等指标来评价M26的耐旱性。主成分分析显示,第一、第二、第三主成分方差贡献率分别为79.866%、10.386%、8.299%。累计方差贡献率达到98.554%,根据方差累计贡献率>85%的原则,符合分析要求。综合得分排名为CK>T3>T4>T2>T1>T5。第一主成分(PC1)综合Gs、Tr、Fm、Fv/Fm等指标,第二主成分(PC2)综合Ci、Chl a、Chl b、Chl(a+b)、Chl a/b、Pro、SS、POD、SOD等指标。第一主成分中,Gs、Tr是调节光合作用的重要指标,Fm、Fv/Fm是损伤的重要指标,这说明在干旱胁迫下,M26主要通过调节光合作用来适应干旱胁迫。第二主成分中,Chl a、Chl b、Chl(a+b)、Chl a/b是损伤的重要指标,Pro、SS是主要的渗透调节指标,POD、SOD是抗氧化酶,这说明在干旱胁迫下,M26还通过积累Pro、SS等渗透物质,提高POD、SOD等抗氧化酶活性来缓解伤害[44]。此外,通过综合分析可得出,喷施外源6-BA后,可以缓解干旱对M26植株造成的损伤,且50 mg/L 6-BA为较为适宜的浓度。
4 结论
干旱胁迫能显著抑制苹果砧木M26幼苗的生长,外源6-BA可以减少干旱胁迫下M26叶绿素的分解,维持光合作用,增强抗氧化酶活性,积累渗透调节物质,提高生物膜稳定性来缓解干旱胁迫对植株的伤害。通过综合分析得出,50 mg/L6-BA缓解M26干旱胁迫的效果最好。
