用于多尺度高分辨率三维成像的双环光片荧光显微技术
2023-01-07赵宇轩
王 鹏,周 瑶,赵宇轩,费 鹏,2
(1. 华中科技大学 光学与电子信息学院, 湖北 武汉 430074;2. 华中科技大学 武汉光电国家研究中心, 湖北 武汉 430074)
1 引 言
荧光显微成像技术的诞生与发展为人们探索生物微观世界的构造与运行机制提供了强大的观测手段,并极大地推动了生命医学领域相关研究的进展[1]。近些年来,随着物理光学、分子生物学、材料化学、计算机等学科的发展,荧光显微成像技术也在交叉学科研究中得到了广泛的创新与应用。其中,拥有良好光学层析能力的光片荧光显微成像技术因其具备传统宽场和共聚焦这两种成像方式无法比拟的高轴向分辨率、高通量、低光毒性等优势在生物细胞和组织器官的三维荧光成像中得到了越来越广泛的应用[2-3]。
根据光片产生的方式,可以将光片显微镜分为选择平面照明显微镜(Selective Plane Illumination Microscopy, SPIM)[4]和数字扫描光片显微镜(Digital Scanned Light Sheet Microscopy, DSLM)[5]。选择平面照明显微镜是在照明光路中引入一个圆柱透镜对光束进行单维度压缩,在探测物镜焦面位置形成一个二维平面静态光片来照亮样本,让样本移动,通过光片就可以依次获得逐层的图像信息。数字扫描光片显微镜是先将激发光束聚焦成为光线,再用振镜扫描的方式在成像面快速生成一个虚拟光片来照亮样本。
目前主流的光片技术中生成光片所用的光束类型主要是高斯光片和贝塞尔光片两种。高斯光片的厚度与瑞利距离成平方反比,也就是轴向分辨率与成像视野两者之间存在相互制约。虽然可以利用轴向扫描的方式扩增成像视野,但这种方法显著降低了时间分辨率[6]。贝塞尔光片是具有自愈特性的无衍射光束,在传播时能够保持截面轮廓与光强不变,其干涉可用范围较长,故可以具有更大的成像视野[7-9]。但光的干涉效应会引入较重的旁瓣,从而导致出现额外的离焦激发与光漂白,这也是贝塞尔光片无法进行活体三维长时程观测的重要原因。
晶格光片显微镜(Lattice Light Sheet Microscopy, LLSM)[10]通过利用空间光调制器产生多束并行排列的贝塞尔光束,再让它们相干叠加产生一个传播不变的二维光学晶格,最后沿横向方向进行一小段距离的快速抖动以形成时间平均的光片,这在一定程度上抑制了无衍射光束的旁瓣效应。但晶格光片无法同时进行多色成像,而且由于对波长敏感、所用设备昂贵、需要二维扫描且能量利用率低等原因尚未在常规实验室普及。场合成(Field Synthesis)[11]的方法是在特制掩模上扫描线光束再经中继透镜将光线图案共轭到照明物镜的后瞳,这样任意扫描或抖动形成的光片都可作为其瞬时强度分布的非相干总和,但这种方式对扫描的硬件控制和精度提出了更高的要求且降低了时间分辨率和光能利用率。不同于传统的光片成像系统,单物镜光片显微镜不是采用照明物镜与探测物镜正交放置解耦合的方式,而是利用同一个物镜作为激发与收光单元,这一点与宽场和共聚焦类似,但同时又保留了光片显微镜层析能力强、光毒性低、具有高通量的优势,这大大解放了光片显微镜固有的空间限制,解决了传统光片显微系统光路结构复杂的问题[12-13]。
然而,每一种光片显微成像系统往往仅是针对某种特定应用场景进行设计搭建的,无法同时满足多尺度样本不同的成像需求。比如,以接近衍射极限的超高空间分辨率观测单细胞尺度精细结构的成像系统无法快速地获取全器官尺度下整个组织或器官的三维图像数据,而适用于全器官亚细胞分辨率图像采集的高通量成像系统无法达到接近衍射极限的分辨率水平。所以能够兼容单细胞超高分辨率成像乃至打破衍射极限的超分辨成像、针对大体积样本的高通量成像等不同应用场景,实现多尺度成像的光片荧光显微成像系统对于节约系统搭建资源、拓宽系统应用领域、提高成像效率有着极其重要的意义,这也是科研工作者们一直致力研究的科研目标。
本文提出一种双环掩模调控的方法不仅能够抑制传统贝塞尔光片旁瓣,而且能够产生不同尺度类型的无色差静态光片。基于此方法,设计搭建了双环调控光片荧光显微镜(Double-Ringmodulated Light Sheet Fluorescence Microscopy,DR-LSFM)。该光片系统具备轴向分辨率从数百纳米跨越到数微米的能力,并能够结合不同尺度应用场景的具体成像需求,完成对活细胞、膨胀细胞和全器官尺度透明化样本的多种成像应用[14]。
2 原 理
传统贝塞尔光片由于自身严重的旁瓣效应会造成较强的离焦激发,这会显著降低图像的对比度并给样本带来额外的光漂白与光毒性。本研究中在激发物镜后瞳共轭处放置双环形掩模,通过干涉两个同轴贝塞尔光片的方法来降低旁瓣能量占比并产生无色差的静态光片[15],其光束整形方案如图1(a)(彩图见期刊电子版)所示:沿光束传播路径依次放置柱透镜、双环强度调制掩模和球透镜,柱透镜与球透镜组成4f系统,双环掩模放置在二者焦点重合处;柱透镜将入射的圆高斯光束在掩模位置单维度汇聚为线高斯光束,双环掩模对该线光束进行二元强度调制以得到分段线光束,分段线光束由于球透镜的汇聚作用发生多级干涉从而在焦点位置左右形成无色差的低旁瓣静态贝塞尔光片;之后再接入套筒透镜和物镜组成的4f系统即可产生符合具体应用需求的光片类型。

图1 光束整形原理和光片性能表征。(a)双环掩模调控生成低旁瓣贝塞尔光片;(b)不同尺度类型光片性能表征及对比Fig. 1 Principle of double-ring beam reshaping and its comparative performance. (a) Lowsidelobe Bessel light sheet obtained by the modulation of a double-ring mask; (b) characterization and comparison of performance of our multi-scale low sidelobe light sheet
为了表征该方法产生的低旁瓣贝塞尔光片的具体特征参数,基于以下理论并结合MATLAB仿真展开相关研究[16-17]。假设入射线光束的光场分布是U0, 掩模的光学透过率函数是P,可以得到掩模后的光场分布为:

由菲涅尔衍射可以得到球透镜前表面处的光场分布U2:
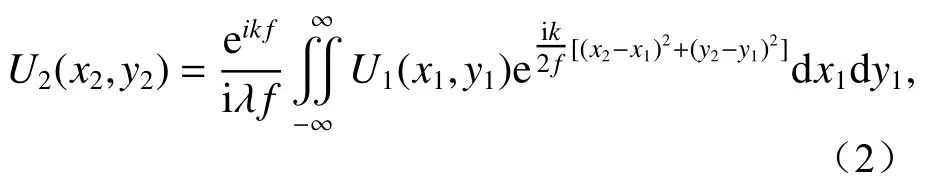
其中λ是入射光波长,之后球透镜会对入射光进行相位调制,那么经过球透镜相位变换后的光场分布U3为:

同理,从球透镜到后焦面处的传播过程也可以由菲涅尔衍射过程进行推导,则球透镜后焦面处的光场分布U4为:

将上式中的焦距值f替换为变量d时就能得到距透镜任一距离d处的光场分布,进而可以实现低旁瓣贝塞尔光片三维强度信息的重构。通过观察屏上的光强分布发现其主要受双环强度调制掩模的光学透过率函数P影 响,而P由双环的几何尺寸决定,也就是内环与外环的4个半径参数:Router_max、Router_min、Rinner_max与Rinner_min,所以其透过率函数P应为:
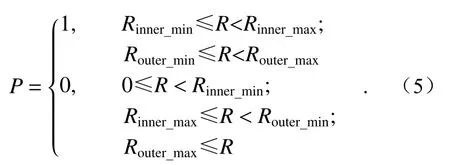
精细调整双环掩模4个半径之间的数值关系,也就是改变其透过率函数,采用上述整形方案不仅可以得到高斯、单环贝塞尔、双环贝塞尔这些不同类型的光片,同时也可以得到不同厚度与旁瓣占比的多尺度双环贝塞尔光片。
图1(a)中的光束整形方法会在球透镜后焦面位置形成初级双环贝塞尔光片,实际应用中会在该球透镜后接入套筒透镜与照明物镜组成的4f系统,从而将初级光片放缩至照明物镜的工作距离处以产生实际可用的双环贝塞尔光片。由于球透镜与套筒透镜也按照4f系统放置,二者的功能是将掩模处调制后的光束图案传递至物镜后焦面,因此可以将图1(a)中的球透镜视作照明物镜来执行上述光学衍射传递过程。
通过MATLAB仿真重构出双环贝塞尔光片的三维强度分布模型,提取(x4,y4)面的强度分布信息如图1(b)所示,在该面中心位置沿y方向做强度归一化曲线即可得到光片的旁瓣占比;另外,将归一化曲线的中央主峰数值做高斯拟合:

得到拟合方程后,计算强度下降到最大值一半时所覆盖的范围即是光片的厚度参数h:

图1(b)是基于Special Optics公司的一款长工作距离水镜(焦距为7 mm,工作距离为3.74 mm)在不同的掩模参数下获得的多种类型光片的仿真结果。当换用不同的照明物镜时,最终产生的光片的整体尺寸会根据焦距值的变化产生数倍的放缩。
3 基于双环调控的多尺度光片显微成像系统
显微成像系统大体分为4个模块,包含光片整形及照明模块、双色同时探测模块、样本运动及时序控制模块和宽场模块。系统光路如图2(a)(彩图见期刊电子版)所示。
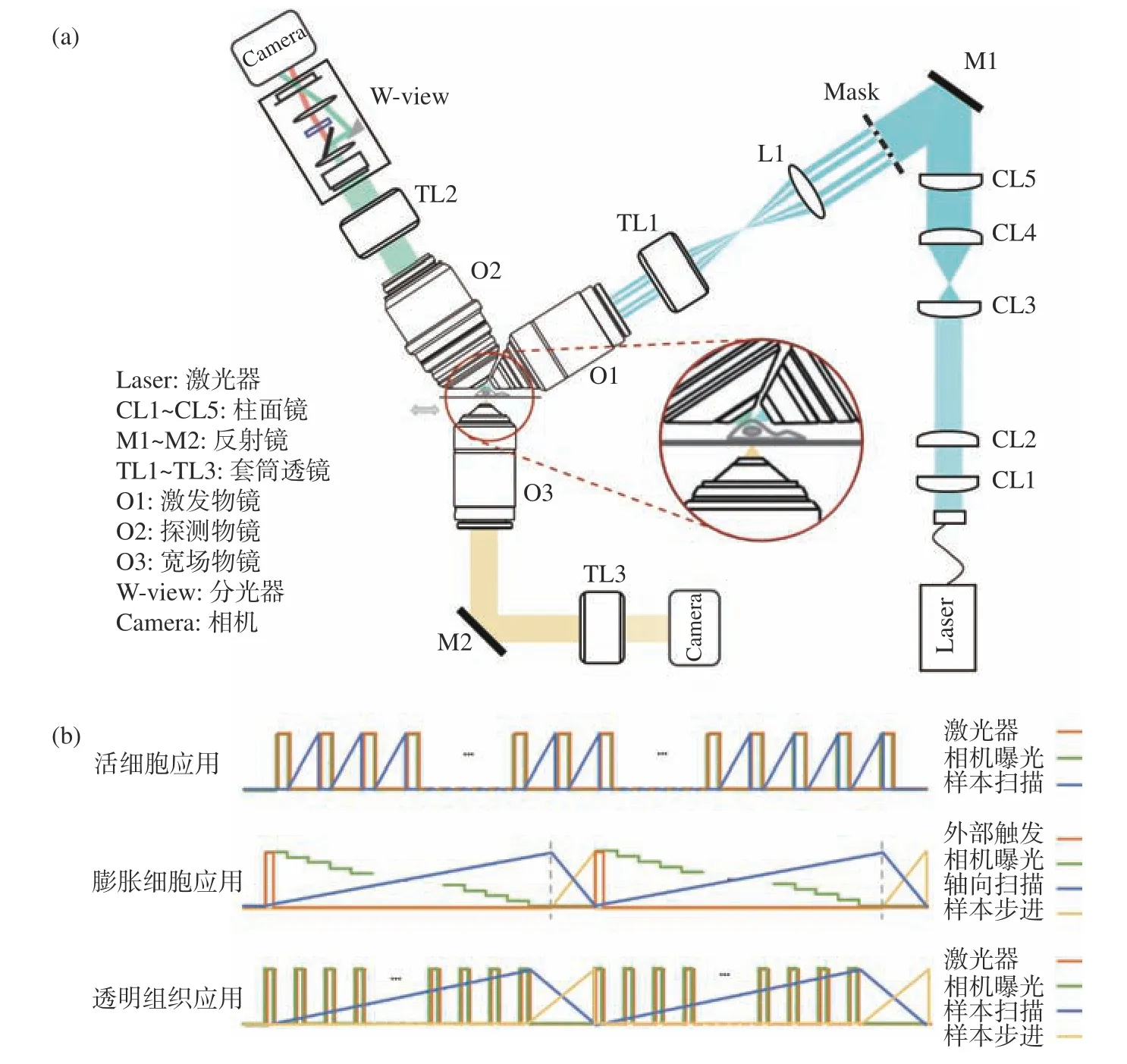
图2 系统光路图与时序控制图。(a)多尺度光片显微成像系统光路图;(b)不同应用场景的时序控制图Fig. 2 Schematic diagrams of the proposed system and the timing control flow charts. (a) The optical design of our multi-scale light sheet fluorescence microscope; (b) the control charts for different imaging applications
3.1 光片整形及照明模块
该模块包括激光产生模块、光束整形模块以及光片激发模块3个部分。
3.1.1 激光产生模块
考虑到系统需要进行多色同时成像应用以及光学元件对入射光的衰减作用,需要峰值功率较高且稳定并且能够进行多波长激发的激光器。这里选用Cobolt Skyra系列的一款四波长合一激光器,能够同时进行405、488、561、633 nm 4个波段的激发并且每个通道都能够达到50 mW的出射功率。
3.1.2 光束整形模块
如图2(a)(彩图见期刊电子版)所示,入射激光由光纤准直头准直后引入光路,先经过两组柱透镜分别在两个维度进行5倍扩束,再经一个柱透镜聚焦为线高斯光束,掩模放置于该柱透镜焦面处形成衍射图案,之后经过一组中继透镜将衍射图案投影在照明物镜的后瞳面上,照明物镜对其进行傅立叶变换并在其焦点附近产生光片。通过移动掩模板位置让线高斯光束入射到不同尺寸的双环图案上,从而产生不同厚度类型的低旁瓣贝塞尔光片。
3.1.3 光片激发模块
光片激发模块中,核心元件是照明物镜。在单细胞尺度的成像应用中,选用Special Optics公司的28.6倍水镜作为照明物镜,考虑到系统搭建过程中各个元件的空间位置及角度摆放,将照明光轴设计为与水平面成31.5°角倾斜。在更大尺度的膨胀细胞成像应用中,在照明物镜端安装物镜扫描器增加光片的轴向扫描功能,实现扫描范围和深度的数倍扩增。在全器官尺度样本的高通量成像应用中用Olympus的4倍长工作距离空气镜作为照明物镜,一方面给样本在大范围内的扫描移动提供足够的空间,另一方面可在保证入射光能量利用率的前提下产生数微米厚度的光片。此外,搭配自主设计定制的树脂隔离罩以避免折射率匹配液对镜头的损伤。
为了让该系统具备优异的多色成像能力,系统搭建时选用的所有透镜元件与物镜均具备良好的消色差功能,可以让不同波长的激发光能够在光轴上的同一位置形成双环贝塞尔光片。这样不同波长的激发光形成的光片在空间位置上就具有高度的重合性,使得探测端不同波长通道内的信号拥有一致焦面与成像视野。
3.2 双色同时探测模块
图像的光学分辨率与探测物镜的数值孔径(Numerical Aperture, NA)直接相关,物镜的NA值越大收光能力越强,获取的图像分辨率越高。在单细胞尺度的成像应用中,对分辨率有着较高的要求,选用Olympus的60倍水镜(LUMFLN×60/1.1 W, Olympus)作为探测物镜,可为图像提供较高的横向分辨率。通过在探测光路中加入消色差分光器件(W-View),使得相机的上下靶面能同时记录不同通道的荧光信号。全器官尺度的高通量成像应用中图像只需达到三维亚细胞分辨率水平,所以选用Olympus的10倍水镜(UMPLFLN×10/0.3 W, Olympus)作为探测物镜,最大程度提高成像通量。
3.3 样本运动及时序控制模块
光片成像系统中需要针对不同应用场景编写合适的时序控制程序来协同控制扫描位移台、相机、激光器等硬件设施,图2(b)(彩图见期刊电子版)是该系统在不同应用场景下的时序控制原理示意图。活细胞成像应用中,扫描位移台为压电陶瓷线性精密定位器,膨胀样本应用中增加探测物镜扫描器,全器官尺度样本高通量成像应用中增加步进位移台(步进方向与扫描方向垂直)。基于LabVIEW软件编写对应的时序控制程序来完成成像目标的三维数据获取。
3.4 宽场模块
在活细胞和膨胀细胞的成像应用中,基于光片的荧光探测光路可以实现极高的空间分辨率,但是高倍物镜下的成像视野有限,不利于快速筛选合适的成像样本及成像区域。因此在系统中加入宽场光路,选取低倍率空气镜作为宽场照明及探测物镜,利用大视野实现对样本的高速筛选与定位。
4 多尺度高分辨率三维成像应用
4.1 单环贝塞尔光片与双环贝塞尔光片成像性能对比
为了验证DR-LSFM相对于单环贝塞尔光片旁瓣减弱的效果,在该系统上分别使用厚度同为2.5 μm的双环贝塞尔光片与单环贝塞尔光片对直径为100 nm的荧光微球进行三维成像,获取可以验证光片性能的点扩散函数。
在该对比实验中,掩模位置的光入射功率保持一致,曝光时间均为30 ms。由于双环掩模光能量利用率更高,获得的图像对比度更好,这一点
在图3(彩图见期刊电子版)的成像结果中也得以验证。另外,更重要的一点,由图3可见,单环贝塞尔光片的旁瓣能量占比严重,而DR-SPIM的旁瓣抑制效果明显,这不仅可以提升生物样本三维体成像的图像质量,而且能够降低光片激发给样本带来的光漂白与光毒性。

图3 单环贝塞尔光片与双环贝塞尔光片成像性能对比。(a)使用旁瓣占比73%的2.5 μm单环贝塞尔光片获得的点扩散函数x-z面最大强度投影;(b)使用旁瓣占比18%的2.5 μm双环贝塞尔光片获得的点扩散函数x-z面最大强度投影Fig. 3 Comparison of imaging results between single-ring Bessel light sheet and DR-SPIM. (a) x-z plane max intensity projection of point spread function by 2.5 μm single-ring Bessel light sheet with 73% side lobes; (b) x-z plane max intensity projection of point spread function by 2.5 μm DR-SPIM with 18% side lobes
4.2 线粒体外膜的高速低光毒性成像
为了证明DR-LSFM可以对活细胞的动态过程进行高速、长时程成像,以1 vol/s的体成像速度对U2OS细胞中的线粒体外膜进行了连续数百个时间节点的观测。
由图4(彩图见期刊电子版)的可视化结果可以看出,该系统能够以1 vol/s的体成像速度快速获取整个细胞内线粒体外膜的三维图像数据,对样本进行连续180 s的观测后图像信噪比没有明显降低,说明该长时程成像过程并没有给细胞带来严重的光漂白或光损伤。

图4 U2OS细胞中线粒体外膜的分布及其运动变化。(a)整个细胞中线粒体外膜的三维分布图,比例尺:10 μm;(b)局部线粒体外膜的运动变化过程,比例尺:2 μmFig. 4 3D dynamics of mitochondrial outer membrane in U2OS cell. (a) Three-dimensional distribution of mitochondrial outer membrane in a whole live cell, scale bar: 10 μm; (b) the movement of local mitochondrial outer membrane, scale bar: 2 μm
4.3 线粒体外膜与Drp1相互作用的双色成像
细胞能够保持正常的生理功能得益于细胞器间的协同工作,功能各异的细胞器形成互作网络,它们之间发生相互作用,可实现快速的物质交换和信息交流,为生命体的正常运转提供保障;而一旦细胞器互作网络紊乱,就会随之引起多种疾病的发生。因此研究细胞器之间的互作方式,对于分析复杂生命活动的调控机制、理解细胞器互作在生理功能和疾病发生中的作用有着十分重要的帮助。
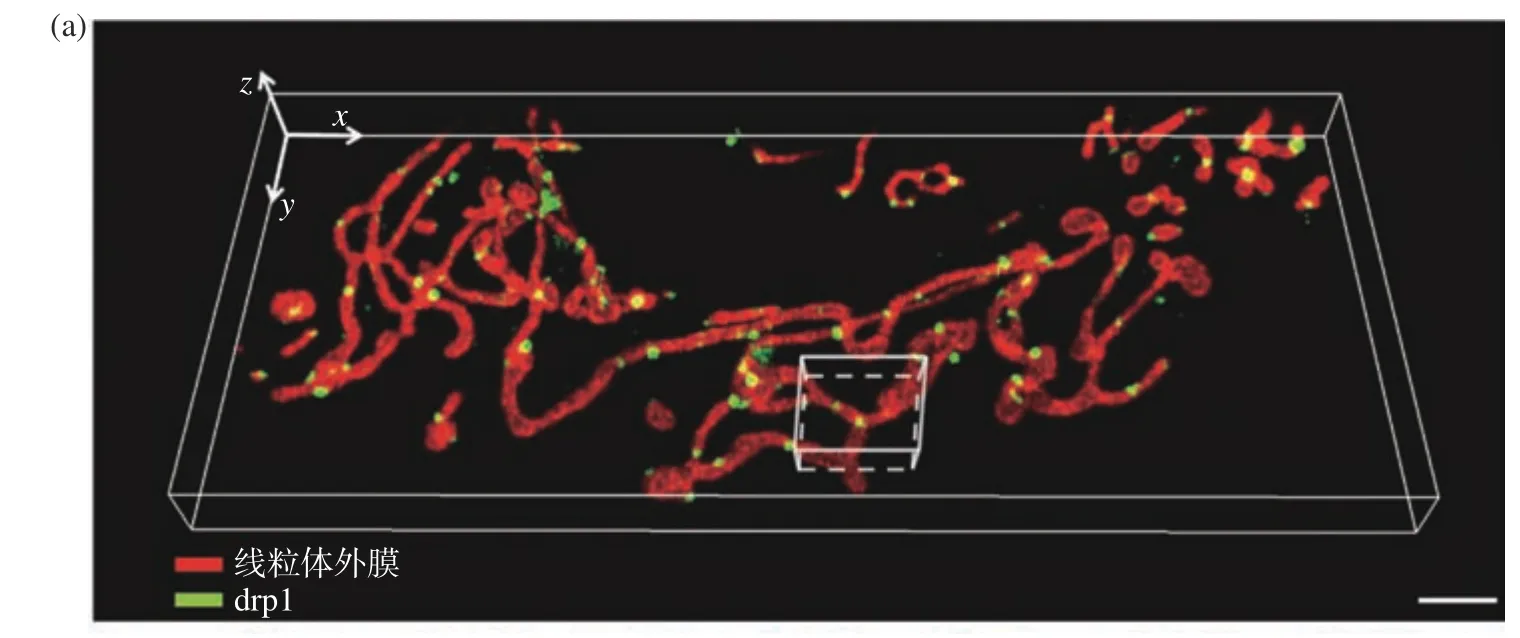
线粒体的分裂与一种动力相关蛋白1(Dynamin-related Protein 1, Drp1)有关,虽然Drp1光敏性强,但DR-LSFM的时空分辨率和低光毒性可以让人们观测到Drp1与线粒体相互作用的动态过程,见图5(a)(彩图见期刊电子版)。在具体实验中分别用mCherry和EGFP标记U2OS细胞中的Drp1与线粒体外膜,采用1 vol/s的体成像速度进行了连续400 s的双色同时成像,并成功观测到Drp1调控分裂线粒体现象。虽然在连续400 s的时间跨度内由于光漂白的作用信号亮度存在一定程度的下降,但总体还是在一个良好的信噪比水平上完整观测了此次动态互作过程,在观测范围内的其他区域也存在类似的调控分裂现象,仅选择白色框区域做放大展示,图5(b)(彩图见期刊电子版)是此次相互作用的过程。本次实验也证明了该光片系统具备优异的双色同时成像能力。

图5 U2OS细胞中线粒体外膜与Drp1的分布与相互作用。(a)线粒体外膜与Drp1的三维分布图,比例尺:3 μm;(b)感兴趣区域内线粒体外膜与Drp1相互作用过程,比例尺:1 μmFig. 5 Interactions between mitochondrial outer membrane and Drp1 in U2OS cell. (a) Three-dimensional co-localization of mitochondrial outer membrane and Drp1, scale bar: 3 μm; (b) interactions between mitochondrial outer membrane and Drp1 in a region of interest, scale bar: 1 μm
4.4 膨胀细胞以及全器官尺度样本的多尺度成像
超分辨显微成像技术的出现为人们打开了探索衍射极限下微观世界的大门[18-25]。与光学硬件系统上的创新突破不同,细胞膨胀技术是通过对样本结构进行物理放大,将衍射受限下的微观结构特征放大至常规光学显微镜所能观察到的尺寸范围,以此实现超分辨效果[26-27]。膨胀样本的放大倍率一般在4~10倍之间,与活细胞相比,其需要在更大体积范围内进行数据采集。而DR-LSFM不仅能以超高的空间分辨率(280 nm×280 nm×500 nm)完成活细胞尺度的高速、长时程多色成像,还可以利用轴向扫描的方式实现膨胀细胞这种更大尺度样本的三维超分辨数据获取。
在膨胀细胞的成像应用中选用光片厚度为500 nm的超薄光片以满足较高的轴向分辨率,但在干涉可用范围只有约12 μm的情况下样本扫描深度受限,这严重限制了数据采集效率。为了在一次扫描中获得更深层范围内的样本信息,使用物镜扫描器将光片沿传播光轴进行轴向扫描,配合相机的卷帘曝光模式,使得靶面上有效信息的覆盖范围达到1 024行像素。这样可以充分利用相机的画幅,扩大成像视野,在保证轴向分辨率的同时又提升了成像效率,可以获取更多的信息。本文所用压电陶瓷的行程范围为100 μm,一次可以采集280 nm(x) ×280 nm(y) ×500 nm(z)的空间分辨率获取约5×105μm3体积内的样本信息,经过4倍的膨胀倍率折算后所达到的实际分辨率约为70 nm(x)×70 nm(y)×125 nm(z)。图6(a)~6(e)(彩图见期刊电子版)是由该系统采集的4倍膨胀核孔数据的三维可视化结果,从所选小区域的x-y面的最大强度投影可以明显观察到核孔的中空结构,而该结构一般需要100 nm左右的分辨率才可以解析[28]。这说明该光片系统结合细胞膨胀技术成功获取了突破衍射极限的超分辨数据。
多种透明化方法的发展为实现大体积样本深层组织荧光成像提供了强大的助力,其与光片成像技术结合能够实现全器官尺度样本的高通量数据采集[29-33]。而利用DR-LSFM自身可以产生多尺度光片的能力也可以完成透明化鼠脑这种全器官尺度样本的高通量数据获取。
对于全器官尺度的透明化鼠脑,选用厚度为3.5 μm的光片照明与10倍物镜探测来满足亚细胞空间分辨率水平,此时光片的干涉可用范围可以覆盖约相机画幅的一半,获取的单张图像对应的真实视野约为1.2 mm×0.6 mm。扫描方式不再使用短行程的步进模式,而是换用长行程的匀速扫描模式,进行大体积样本的数据获取,设置合适的曝光时间来避免运动模糊。扫描方向的位移距离取决于样本的长度(约为12 mm), 这样每次扫描可以获取约12 mm(x) × 0.6 mm(y) ×0.3 mm(z)体积内的样本信息,再依次进行逐行、逐层扫描最终得到整个鼠脑的三维图像数据。根据奈奎斯特采样定律设置扫描方向的采样步长为2 μm,在60 Hz的图像采集帧率下可以用5小时的纯数据采集时间完成整个鼠脑约480 mm3(12 mm×8 mm×5 mm)体积内的信号采集。使用ImageJ插件“Stitching”对获取的图像进行横向与轴向拼接,对原始数据每个维度进行4倍降采样后再进行拼接以降低计算机负荷。图6(f)(彩图见期刊电子版)是拼接后的整个鼠脑神经元信号的三维可视化结果,其中在皮层区域与丘脑区域分别选取两个小块进行放大展示,成像效果如图6(g)~6(h)所示。
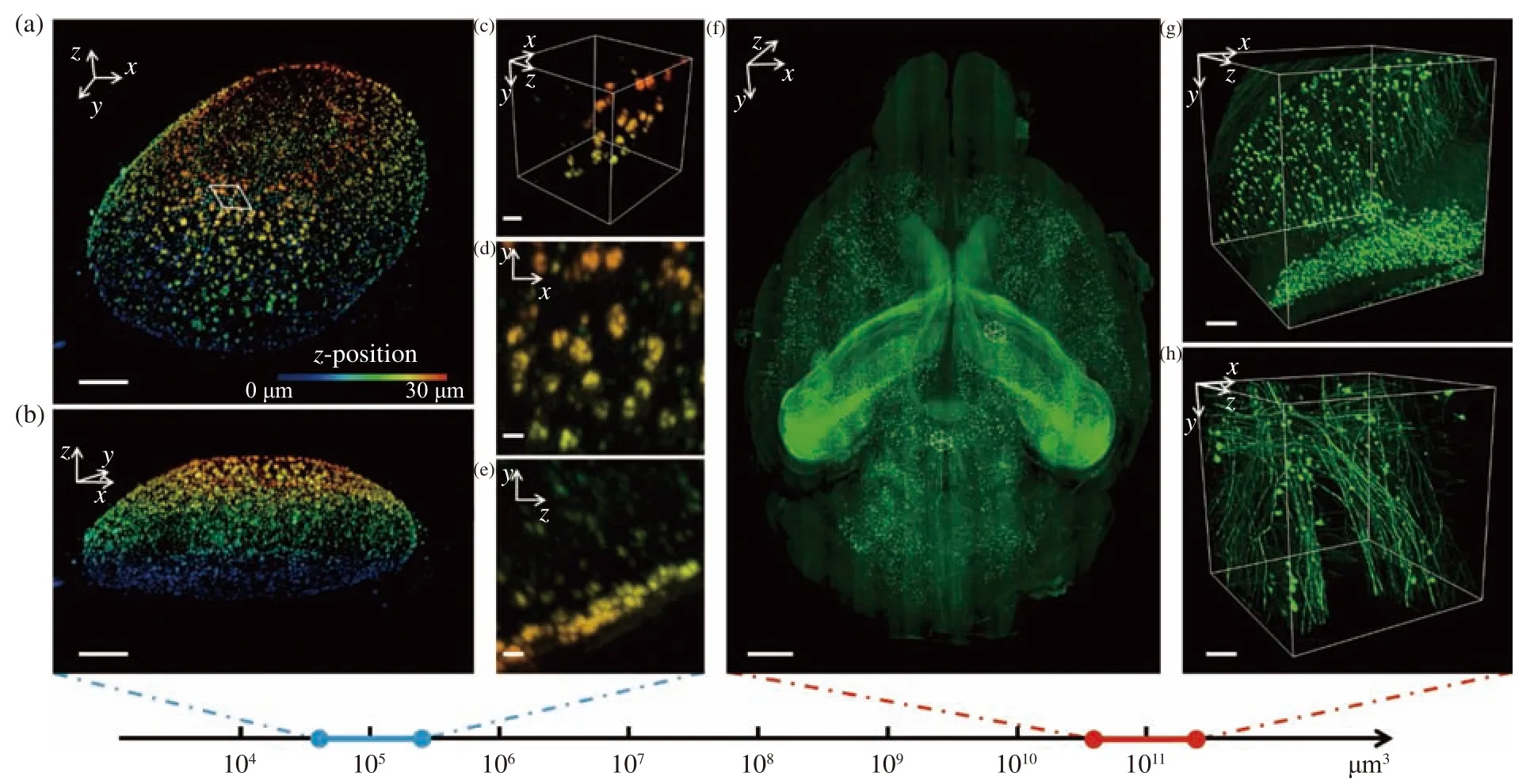
图6 多尺度成像应用可视化结果。4倍膨胀核孔(a)可视化结果及其(b)轴向视角,比例尺:10 μm;(c)区域三维可视化,比例尺:2 μm;(d)区域x-y面和(e)区域y-z面最大强度投影,比例尺:1 μm;(f)鼠脑全脑可视化结果,比例尺:1 mm;(g)位于皮层和(h)位于丘脑的感兴趣区域三维可视化结果,比例尺:100 μmFig. 6 3D visualization of multi-scale imaging results. (a) 3D visualization and (b) axial 3D view of an expanded nuclear hole(expansion factor: 4), scale bar: 10 μm; (c) 3D visualization of a selected small region, scale bar: 2 μm; max intensity projection of the (d) x-y plane and (e) y-z plane of the region, scale bar: 1 μm; (f) 3D visualization of a whole mouse brain, scale bar: 1 mm; 3D visualization of a region of interest in (g) cortex and (h) thalamus, scale bar: 100 μm
4.5 图像处理及多尺度成像实现方法
双环掩模产生的光片仍然存在一定的旁瓣,可以先对荧光微球进行三维成像获得该系统的点扩散函数;之后对图像进行反卷积操作来进一步消除旁瓣;接着,使用Fiji插件对三维图像进行颜色编码以展示其深度信息,最后导入商业Imaris软件中进行可视化。
DR-LSFM的系统架构可以兼容多种生物样本的成像应用,但为了满足不同应用场景中的成像需求需要在不同类型的掩模与物镜间切换,将不同应用所用的掩模参数与物镜型号整理如表1所示。

表1 不同应用场景下所用的掩模参数与物镜型号Tab. 1 Mask parameters and objectives in different application scenarios
5 结 论
本文基于双环调控产生低旁瓣静态贝塞尔光片的方法,通过对光片系统进行合理的光路设计与硬件选型,构建了一种能够兼容活细胞动态多色成像、膨胀细胞超分辨成像与全器官尺度样本高通量成像的多尺度光片荧光显微成像系统。利用该光片成像系统完成了对活细胞的高速、长时程动态双色成像,结合生物细胞膨胀方法获得了打破衍射极限的细胞器三维微细结构数据,完成了全器官尺度透明化样本三维图像数据的高通量采集。实验结果证明DR-LSFM可以实现不同分辨率需求的多尺度成像应用。