乙酸钴/NHPI复合催化剂的设计以及催化氧化乙苯制备苯乙酮的工艺条件研究
2023-01-07陈新华陈祥迎张忠洁
汪 清,范 磊,李 平,王 艳,陈新华,陈祥迎,张忠洁
(1.合肥工业大学化学与化工学院,安徽 合肥 230009;2.安徽佳先功能助剂股份有限公司,安徽 蚌埠 233316;3.安徽大学材料科学与工程学院,安徽 合肥 230601)
苯乙酮是一种重要的工业原料,应用广泛。由乙苯氧化制取苯乙酮,对石油化工下游产品的开发、精细化工的发展及饱和碳氢键选择氧化的理论研究都具有重要的意义[1]。目前,苯乙酮的制备主要有四种工艺:苯与乙酐酰化法、苯与乙酰氯反应法、苯甲酸法、乙苯多相氧化法[2],其中,乙苯氧化法制备苯乙酮具有重要意义[3]。催化剂在乙苯催化氧化制备苯乙酮中起到了关键的作用[4],因此,如何设计、合成高效催化剂是研究的重点。迄今为止,乙苯催化氧化制备苯乙酮常用的催化剂包括乙酸钴、硫酸锰、矾砷氧簇合物、乙酸酮等,其中,由于乙酸钴具有廉价易得、催化效率较好等优势,使得其在工业上得到了广泛的应用[5]。但是乙酸钴作为单一催化剂用于乙苯催化氧化制备苯乙酮存在缺点和不足,如二价钴会被氧化为三价钴,无法被还原,催化效率低[6]。严生虎等[7]研究了在微通道反应器内以乙酸钴为催化剂进行乙苯催化氧化反应连续合成苯乙酮的工艺过程,并且加入了比例为Br/Co=1.75的Br促进剂,但是其催化效率不高,转化率和选择性都很低。另一方面,NHPI对烃类有催化氧化能力[8-9],这为烃类的催化氧化提供了一条新的解决途径,但是NHPI需要跟过渡金属结合使用才能发挥出更高的催化作用,如钴、锰、铜、铁等[10]。NHPI由于其特殊的羟基、胺基基团,使之能够与乙酸钴中的钴离子进行有效配位,可以制备得到乙酸钴/NHPI复合催化剂,进而能够产生协同效应[11]。NHPI与钴结合使用可以改善二价钴易被氧化的问题,同时自身也能够起到催化氧化作用[12]。例如,以NHPI/Co(acac)n(n=2,3)为催化剂的环己烷氧化反应,已实现工业化生产[13]。这一催化体系的特点:以分子氧为氧化剂,NHPI/Co(acac)n(n=2,3)为催化剂,在均相体系及温和的反应条件下进行反应,催化效率高。
本实验采用四水乙酸钴和NHPI制备复合催化剂,并利用单因素、正交实验等手段探究其催化氧化乙苯制备苯乙酮的最佳工艺条件。用傅里叶红外光谱仪(FTIR)和高效气相色谱仪(GC)对催化剂和液相产品进行表征和分析。
1 实验部分
1.1 试剂与仪器
四水乙酸钴,分析纯,国药集团化学试剂有限公司;NHPI,98%,阿拉丁试剂(上海)有限公司;乙苯,分析纯,国药集团化学试剂有限公司。
KQ3202E型超声清洗器,昆山市超声仪器有限公司;AUY120型电子分析天平,日本岛津公司;HJ-6A型多联磁力加热搅拌器,郑州英峪领科仪器设备有限公司;GZX-9023型数显鼓风干燥箱,上海博讯实业有限公司;GC-9790 Plus型气相色谱仪,浙江福立分析仪器有限公司。
1.2 催化剂的制备
用电子分析天平称取5份四水乙酸钴,每份5 g,然后再称取5份不同量的NHPI(1 g,2 g,3 g,4 g,5 g),将1份四水乙酸钴与1份NHPI混合,然后研磨10 min,制得四水乙酸钴/NHPI复合催化剂。
1.3 催化剂的应用
将制备的复合催化剂加入到三口烧瓶中,量取100 mL乙苯加入其中,放入磁力搅拌子。将三口烧瓶放入多联磁力加热搅拌器,设置搅拌速度为250 r/min,根据单因素条件设置反应温度和反应时间。通入空气,气速为100 mL/min,反应开始同时进行冷凝回流直至反应结束,停止加热,静置冷却。将冷却后的反应液进行过滤,取2 mL滤液用气相色谱仪进行分析测试。将剩余的滤液进行碱洗,再进行精馏,得到苯乙酮。
1.4 实验流程
实验过程分为反应物的催化氧化、反应液的萃取、有机相的碱洗、有机相的精馏4个部分。首先设计乙酸钴/NHPI复合催化剂,将乙酸钴和NHPI进行复合;然后将复合反应生成的乙酸钴/NHPI复合催化剂应用于乙苯催化氧化制备苯乙酮;接着将反应液进行过滤和萃取,提取NHPI循环使用,再与乙酸钴/NHPI进行复合;将有机相进行碱洗,分离出苯甲酸;再将碱洗后的有机相进行精馏,精馏出的产品即为苯乙酮。具体流程如图1所示。
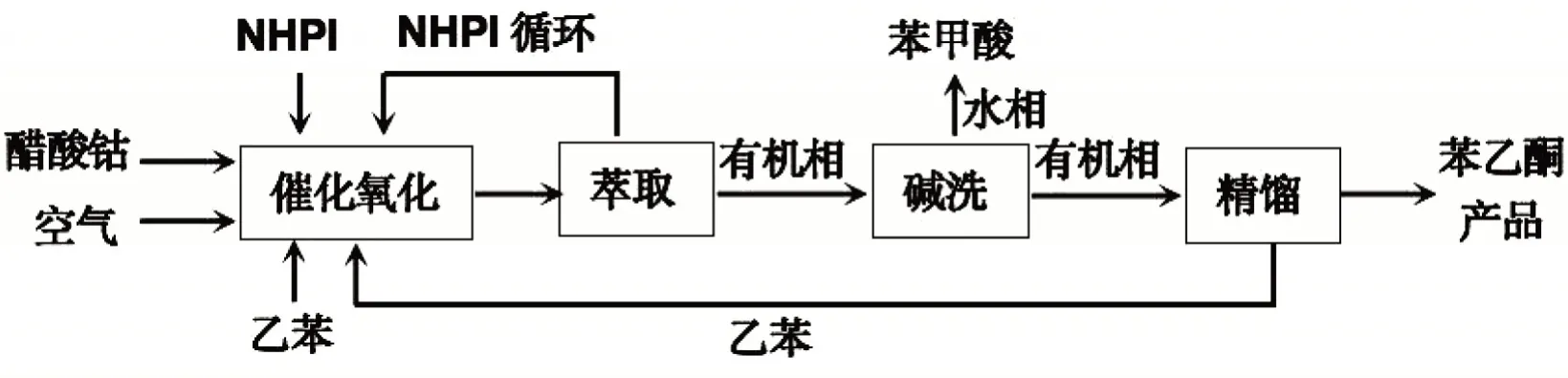
图1 实验工艺流程图
2 结果与讨论
2.1 反应时间的影响
探究乙苯转化率、苯乙酮选择性随时间变化的关系。加入5 g四水乙酸钴,2 g NHPI,反应温度为120℃,氧源为空气,进行实验。
如图2所示,乙苯转化率随时间变化逐渐增大,但苯乙酮选择性随反应时间的变化为先增大后减小,并且在36 h时达到最大值。从乙苯转化率随时间的变化关系分析可知,其原因是乙苯在受热条件下会转化成为乙苯自由基,在NHPI与PINO转化吸氢作用下也会促使乙苯转化成为乙苯自由基,进而不断进行反应,因此乙苯转化率随时间延长会不断增加。从苯乙酮选择性随时间的变化关系分析可知,当反应时间小于36 h时,一方面乙苯受热,和在NHPI的作用下脱氢不断转化成的乙苯自由基进行后续反应,另一方面乙苯过氧自由基会在NHPI作用下吸氢并分解为苯乙酮,所以苯乙酮的选择性随时间延长而增大;当反应时间超过36 h,虽然乙苯仍会不断转化,苯乙酮仍在生成,但是在受热和空气条件下,大量苯乙酮会被氧化为苯甲酸,苯乙酮的含量减少,苯甲酸的含量增加,从而使苯乙酮的选择性减小[14]。
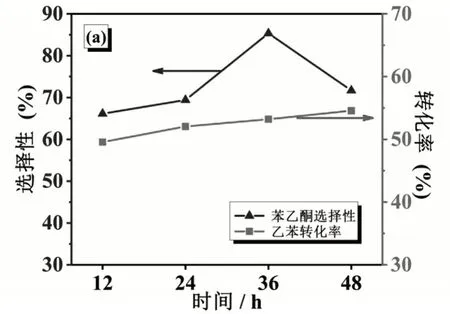
图2 乙苯转化率、苯乙酮选择性随时间的变化关系
2.2 反应温度的影响
探究乙苯转化率、苯乙酮选择性随温度的变化关系。加入5 g乙酸钴,2 g NHPI,反应时间为36 h,氧源为空气,进行实验。
如图3所示,乙苯转化率、苯乙酮选择性随反应温度的变化情况为先增加后减少,在110℃时达到最大值。从乙苯转化率随时间的变化关系分析可知,其原因在于反应温度低于110℃时,乙苯在受热条件下和PINO与NHPI转换的影响下不断转化为乙苯自由基,使得乙苯的转化率随温度的增加而增大;当反应温度高于110℃时,NHPI会因高温而部分分解,其对乙苯转化为乙苯自由基的促进作用大大减小,因此乙苯转化率会随温度升高而降低[15]。从苯乙酮选择性随时间的变化关系分析可知,在反应温度低于110℃时,乙苯自由基进一步被氧化为乙苯过氧自由基,其在NHPI作用下吸氢进而分解为苯乙酮,因此苯乙酮选择性随温度升高而增大;在反应温度高于110℃时,NHPI的作用因为高温而被抑制,从而分解出的苯乙酮含量减少,苯乙酮选择性减小。
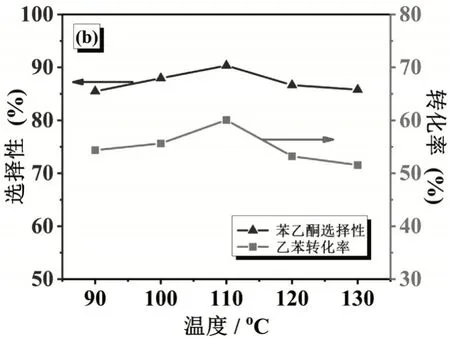
图3 乙苯转化率、苯乙酮选择性随温度的变化关系
2.3 NHPI加入量的影响
探究乙苯转化率、苯乙酮选择性随NHPI加入量因素的变化关系。加入5 g乙酸钴,反应时间为36 h,氧源为空气,反应温度110℃,进行实验。
如图4所示,乙苯转化率、苯乙酮选择性随NHPI加入量的增加为先增加后减少,其在加入量为2 g时均达到较大值。从乙苯转化率随加入量的变化关系分析可知,一方面过多的NHPI加入会形成团簇,降低催化剂乙酸钴与乙苯的接触面积;另一方面过多的NHPI会占据反应器更大空间,造成液面上方的空间减小,由于气压作用,冷凝的乙苯不能回流,造成NHPI加入量大于2 g时,乙苯转化率降低[16]。从苯乙酮选择性随NHPI加入量的变化关系分析可知,NHPI的过量加入一方面会使乙苯转化率降低,不能进行后续反应;另一方面过量的NHPI将更多的三价钴还原为二价钴,不利于乙苯过氧自由基吸氢分解为苯乙酮,因此苯乙酮的选择性会降低。
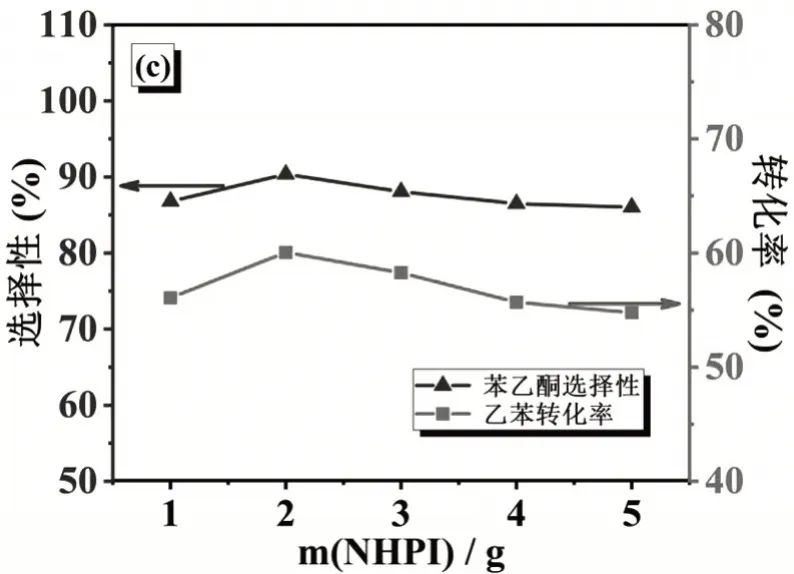
图4 乙苯转化率、苯乙酮选择性随NHPI加入量的变化关系
2.4 正交实验
2.4.1 正交实验因素水平表
为了进一步探究最佳的反应条件,在单因素条件实验的基础上,根据正交实验方法,选择三因素三水平在氧源为空气的条件下进行该反应工艺条件优化实验。三因素三水平正交实验表如表1所示。
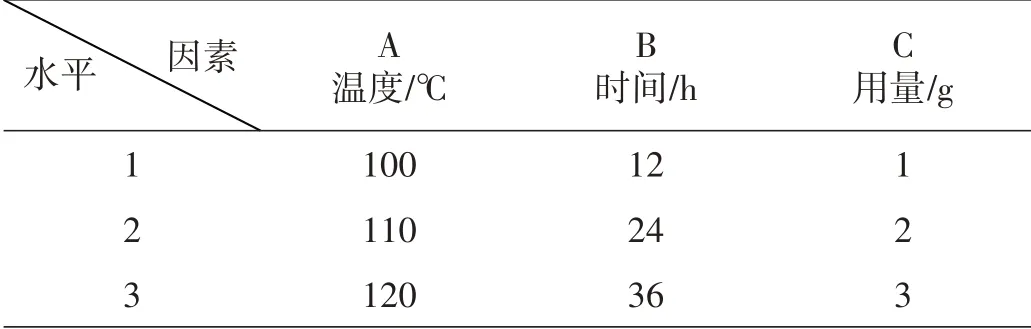
表1 三因素三水平正交实验
2.4.2 正交实验与极差分析结果
按照表1所设计三因素三水平正交实验,得到了表2的实验结果,极差R的大小代表了该因素变化对指标值的影响程度。
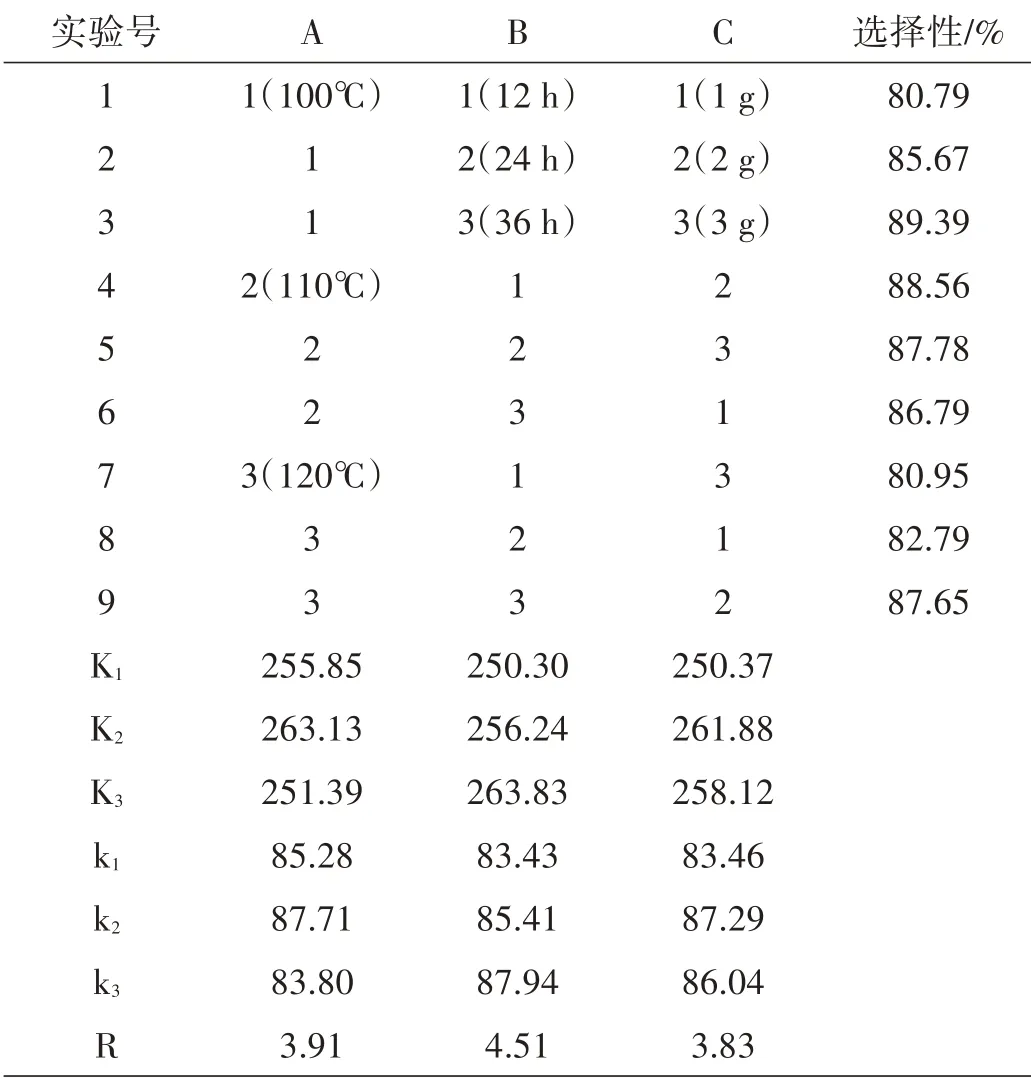
表2 三因素三水平正交实验结果
由表2中R项可知,极差的大小顺序依次为:反应时间(B)、反应温度(A)、用量(C)。因素A以A2(110℃)的平均选择性最高,为87.71%;因素B以B3(36 h)的平均选择性最高,为87.94%;因素C以C2(2 g)的平均选择性最高,为87.29%。由上述结果选择A2、B3、C2三个水平为最优化的水平,在该实验条件下得到苯乙酮的选择性为90.35%。因此最优化条件:反应时间为36 h,反应温度为110℃,NHPI用量为2 g。
2.5 气相色谱
采用高效气相色谱仪对产品进行分析测试,如图5所示,产物主要有未反应的乙苯、反应得到的苯乙酮和α-苯乙醇,保留时间在8.8 min左右时,苯乙酮峰面积最大,占80%左右;乙苯和α-苯乙醇峰面积小,含量较少。
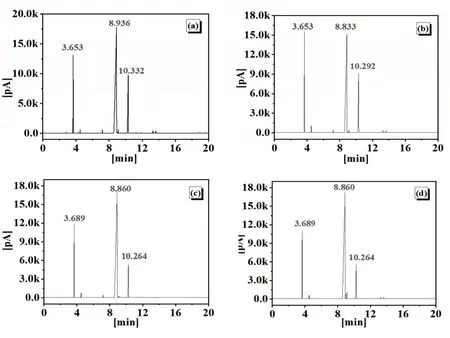
图5 产品的气相色谱图
2.6 反应前后NHPI的傅里叶红外光谱分析
为了探究反应前后NHPI变化情况,判断NHPI循环性能,进行了傅里叶红外光谱分析,结果如图6所示,(a)表示反应后NHPI的红外谱图,(b)表示反应前NHPI的红外谱图。

图6 反应前后的NHPI红外光谱
波数3 750~3 000 cm-1范围是N-H和O-H伸缩振动区域,根据NHPI的结构图,NHPI不存在N-H键,所以波数为3 122 cm-1和3 054 cm-1的两个峰表示O-H伸缩振动。波数1 900~1 630 cm-1区域是羰基伸缩振动区域,波数为1 701 cm-1和1 674 cm-1的两个峰表示为C=O伸缩振动,酰胺中C=O伸缩振动波数范围1 690~1 630 cm-1,酸中C=O伸缩振动波数范围为1 725~1 700 cm-1,所以1 674 cm-1(a)峰代表酰胺中C=O伸缩振动,波数为1 701 cm-1(b)的峰是未反应的NHPI测试出来的,所以其代表的也是酰胺中C=O伸缩振动。波数1 452 cm-1(b)可能是饱和C-H面内弯曲振动(1 475~1 300 cm-1),也可能是取代苯类C=C骨架振动(1 450±20 cm-1),波数1 397 cm-1(a)可能是饱和C-H面内弯曲振动区域,也可能是醇酚类O-H面内弯曲振动。波数1 167 cm-1(b)可能是取代苯类的C-H面内弯曲振动,也可能是烷烃类的C-C面内弯曲振动,波数1 266 cm-1(a)是醇酚类O-H面内弯曲振动。波数1 126 cm-1(b)和1 136 cm-1(a)可能是取代苯类C-H面内弯曲振动。波数1 072 cm-1(b)和1 063 cm-1(a)可能是胺的C-N伸缩振动(1 340~1 020 cm-1)。波数973 cm-1(b)和977 cm-1(a)可能是不饱和C-H面内弯曲振动。波数878 cm-1(b)和896 cm-1(a)可能是不饱和C-H面内弯曲振动,也可能是胺类N-H面外弯曲振动。波数778 cm-1(b)和791 cm-1(a)可能是不饱和C-H面内弯曲振动,也可能是胺类N-H面外弯曲振动。波数687 cm-1(b、C)可能是不饱和C-H面内弯曲振动,也可能是胺类N-H面外弯曲振动。通过对比,反应前后NHPI官能团基本不变,可以推断NHPI具有循环性能。
2.7 反应机理
乙苯液相氧化反应是自氧化的自由基反应,由于氧分子的解离能大于乙苯侧链碳氢键的解离能,则氧化过程首先是碳氢键均裂形成烷基自由基,其反应历程与一般的自由基反应相似,包括自由基反应的三个步骤:链引发、链增长、链终止[17]。四水乙酸钴/NHPI复合催化剂与乙苯反应的机理如图7所示。
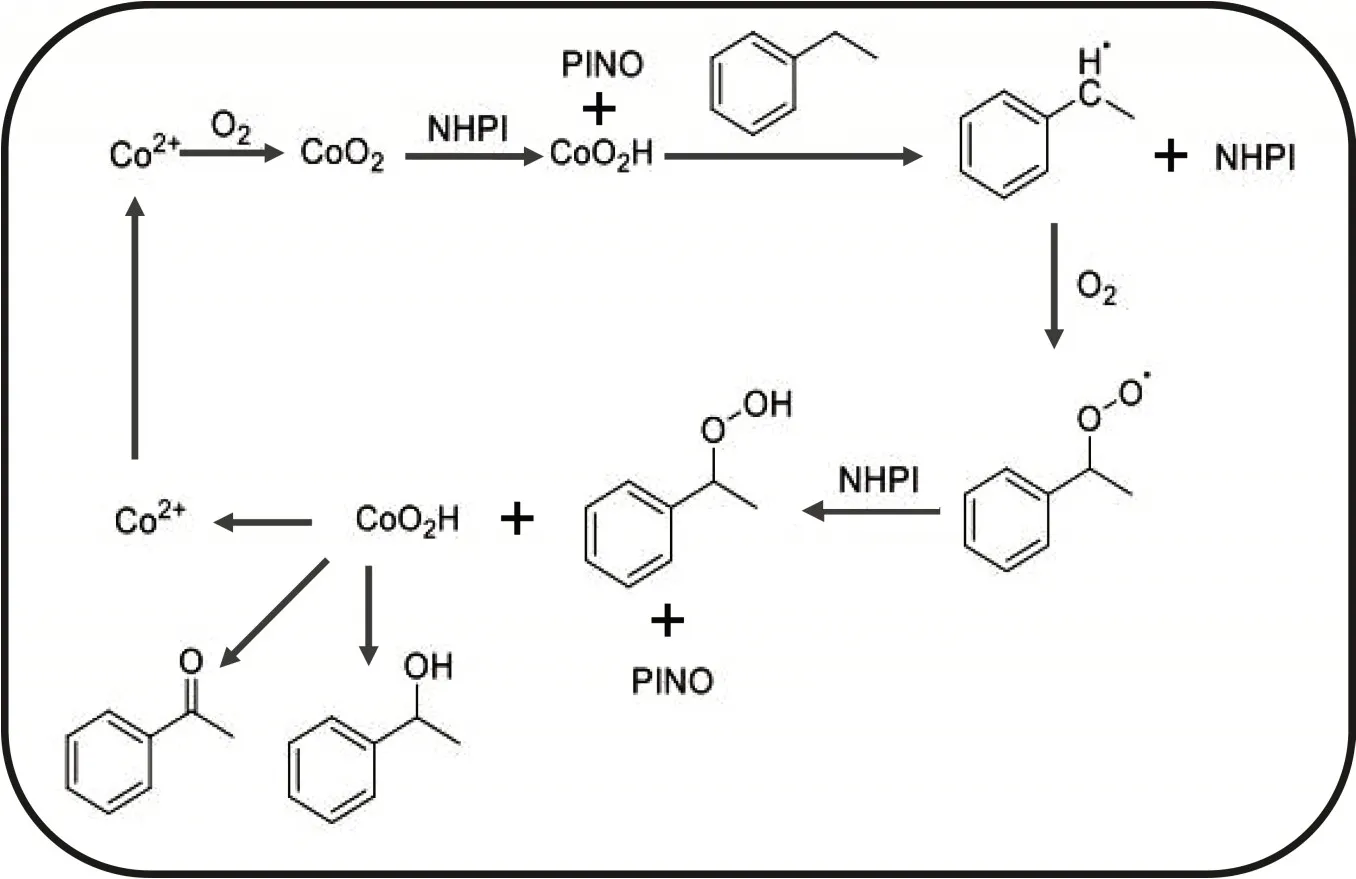
图7 乙酸钴/NHPI催化氧化的反应机理
链引发:链引发是生成自由基的过程,需要较大的活化能,才能使乙苯侧链碳氢键断裂。在热能或辐射能的作用下,乙苯均裂形成苯乙基自由基。在反应开始阶段,反应体系必须积累足够量的自由基,才能引发连锁反应。通常,在钴、锰等过渡金属离子存在的条件下,可以加速链引发,促进苯乙基自由基的生成和氢过氧化物的分解,同时催化剂得到还原[18]。引发剂钴离子与氧气形成钴氧络合物,同时钴被氧化为三价,该络合物的氧分子基团带有一个单电子,然后钴氧络合物摄取NHPI中N-OH的氢原子,生成PINO,钴氧络合物本身与被摄取的氢原子结合形成CoO2H[19]。
链增长:乙苯被PINO自由基摄取氢原子而激发,形成乙苯自由基,然后乙苯自由基被氧气氧化生成乙苯过氧自由基,然后再摄取NHPI的氢原子,形成过氧乙苯。过氧乙苯与CoO2H反应,分解生成苯乙酮等,同时三价钴被还原为二价钴。
链终止:链的终止是自由基销毁,可能在不同自由基之间发生反应。通过自由基的结合,在终止步骤中可能会生成副产物。
四水乙酸钴与NHPI协同作用来促使乙苯自由基的链反应,NHPI与PINO之间不断转化,三价钴与二价钴之间也是相互转化[20]。
3 结论
(1)经正交实验确定最佳反应条件:反应温度为110℃,反应时间为36 h,NHPI加入量为2 g,气源为空气,气速为100 mL/min;苯乙酮的选择性为90.35%,乙苯转化率为60.05%。
(2)乙酸钴/NHPI复合催化剂用于乙苯催化氧化制备苯乙酮,苯乙酮的选择性可达到90.35%,比用乙酸钴单一体系催化剂所得到的苯乙酮选择性69.26%要高,因此NHPI对于乙苯催化氧化制备苯乙酮有促进作用。NHPI由于其特殊的羟基、胺基基团,使之能够与乙酸钴中的钴离子进行有效配位,产生协同效应。
(3)通过对反应前后的NHPI红外图谱进行分析,可知NHPI反应前后官能团变化不大,从而推断其具有可循环性。
(4)NHPI一方面可以促进乙苯向乙苯自由基转化,另一方面可以促进乙苯过氧自由基吸氢,进而分解为苯乙酮,还可以将被氧化的三价钴还原为二价钴,提高乙酸钴的利用率。
该实验中的乙酸钴/NHPI复合催化剂具有催化效率高、可循环性、廉价易得、绿色环保等特点,因此其在乙苯催化氧化制备苯乙酮领域具有良好的工业化应用前景。
