巨噬细胞胞外诱捕网诱导成纤维样滑膜细胞活化作用在类风湿关节炎发病中的机制
2023-01-07黄赛赛卢先艳王世颖
黄赛赛, 赵 成, 梁 军, 卢先艳, 王世颖
(南京大学医学院附属鼓楼医院, 1. 风湿免疫科, 2. 妇产科, 江苏 南京, 210008)
类风湿关节炎(RA)是以慢性滑膜增生和进行性关节破坏为特征的全身性自身免疫病[1]。RA的发病机制尚未完全阐明,遗传易感因素和环境因素之间的相互作用是疾病发生所必需的。目前比较明确与RA发生相关的环境因素包括吸烟和感染[2], 但感染如何导致疾病发生的机制尚不清楚。研究[3]发现,胞外诱捕网(ETs)形成似乎也是RA的可能发病机制。
RA滑膜中存在多种慢性炎症细胞浸润,巨噬细胞和成纤维样滑膜细胞(FLSs)是RA滑膜中最丰富的细胞类型。活化的巨噬细胞通过与炎症微环境的相互作用,在炎症的发展中起重要作用。中性粒细胞胞外诱捕网(NETs)在病原微生物所致的感染性疾病和免疫性疾病中的作用机制逐渐被阐明[4]。研究[5]发现,巨噬细胞同样可形成巨噬细胞胞外诱捕网(METs), 由于RA滑膜中存在大量的巨噬细胞,而中性粒细胞较为少见,本研究推测METs形成及其与FLSs的相互作用在RA发病过程中可能发挥重要作用。本研究探讨巨噬细胞大量形成METs参与RA发病的机制,为进一步阐明RA发病机制提供理论依据。
1 材料和方法
1.1 主要试剂
THP-1细胞(武汉普诺赛, CL-0233)、人FLSs(ATCC细胞库)、佛波酯(Sigma, PMA 16561-29-8)、脂多糖(LPS, SIGMA)、干扰素γ(IFN-γ, Solarbio, P00028)、F4/80大鼠抗人(Abcam, ab16911)、MPO兔抗人(Proteintech, 22225-1-AP)、NE小鼠抗人(Abcam, ab254178)、AF488-驴抗大鼠(Abcam, ab102260)、AF594-山羊抗兔(Abcam, ab150080)、AF647-山羊抗小鼠(Abcam, ab150115)、AF488-山羊抗兔(Abcam, ab150077)、Ni-IDA-Beadose Resin Kit试剂盒(百奥莱博, Ni-IDA-Beadose Resin Kit, GS4622)、C29(MCE, HY-100461)、IAXO-102(MCE, HY-125171)、Cell Counting Kit-8(Dojindo)、细胞迁移和侵袭试剂盒(Millipore)、抗NE(Abcam, ab254178)、抗MPO(Proteintech, 22225-1-AP)、抗GAPDH(Abcam, ab9485)、IL-6(EK-Bioscience, EK-H10352)、MMP-1(MultiSciences, 70-EK1M01-96)、MMP-3(Sino Biological, SEK10467)、MMP-13(Sigma-Aldrich, RAB0364)。
1.2 THP-1细胞培养及诱导巨噬细胞
THP-1细胞培养于含有10%胎牛血清(FBS)+1%青霉素+1%链霉素的RPMI-1640培养基中,培养环境为37 ℃, 5%CO2, 每隔3~4 d进行传代。传代的THP-1单核细胞放入含有10% 热灭活胎牛血清和10 U/mL青霉素、10 μg/mL链霉素的RPMI1640培养液,在37 ℃、5%CO2培养箱中静置培养,维持细胞数1×108/培养瓶左右。将培养的THP-1细胞稀释成1×106/mL, 接种于35 mm培养皿中,于含100 ng/mL佛波酯、0.3% 牛血清白蛋白(BSA)的无血清RPMI 1640培养液中培养72 h诱导分化。通过光镜进行形态学观察,并采用荧光显微镜对诱导的细胞进行荧光鉴定。
1.3 巨噬细胞诱捕网的诱导及鉴定
采用5 μg/mL LPS和10 μmol/L IFN-γ分别处理巨噬细胞,在37 ℃、5% CO2培养箱中静置培养12 h时后,去除培养液,加入磷酸盐缓冲液(PBS)清洗3次,每次30 s, 然后每个孔加入Sytox(1∶10 000)进行染色,免疫荧光染色法检测METs的产生,并对其进行半定量分析。
1.4 免疫荧光
巨噬细胞进行爬片培养,采用5 μg/mL LPS和10 μmol/L IFN-γ分别处理巨噬细胞,在37 ℃、5% CO2培养箱中静置培养12 h, PBS清洗1次, 4%多聚甲醛固定, 0.25%Triton X-100透膜20 min, 3%牛血清白蛋白(BSA)清洗3次,每次10 min, 然后10%山羊血清封闭1 h, 加入一抗混合液, 4 ℃孵育过夜。3% BSA清洗3次,每次10 min, 滴加荧光二抗混合液,避光孵育2 h。DAPI染核10 min, 3%BSA清洗3次,每次10 min, 抗荧光猝灭剂封片,荧光显微镜观察并拍照。
1.5 METs蛋白组分纯化
采用5 μg/mL LPS处理巨噬细胞细胞,在37 ℃、5%CO2培养箱中静置培养12 h。12 h后,去除培养液,然后使用PBS清洗3次,每次1 min。按照Ni-IDA-Beadose Resin Kit试剂盒操作步骤来进行蛋白组分纯化,并用二喹啉甲酸(BCA)法检测蛋白浓度。
1.6 FLSs的培养及干预处理
将人FLSs接种至培养皿中, 37 ℃、5%CO2培养箱中培养。培养到细胞贴壁达到80%以上,用浓度为0.25%胰蛋白酶消化2 min, 消化过程每隔30 s吹打1次; 用含10% FBS的DMEM制备细胞悬液(1×106/mL), 加至培养板,每孔100 mL, 置37 ℃、5% CO2培养箱培养24 h。采用METs蛋白组分以及Toll样受体(TLR)抑制剂进行干预, METs蛋白组分的浓度为5 μg/mL: TLR2抑制剂C29的工作浓度为5 μmol/mL; TLR4抑制剂IAXO-102的工作浓度为10 μmol/mL; PBS作为空白对照。以上抑制剂单用或者联用对滑膜细胞进行干预处理12 h, 然后进行后续实验。
将人FLSs细胞系分为对照组、METs组、C29组、IAXO-102和C29+IAXO-102联合干预组,除对照组外,其余组均将纯化的METs蛋白组分加入FLSs培养液中, C29组同时加入TLR2抑制剂C29, IAXO-102组加入TLR4抑制剂IAXO-102, 联合干预组同时加入C29和IAXO-102。
1.7 细胞活力和迁移侵袭能力检测
取FLSs滑膜细胞悬液100 μL加入Transwell小室,进行培养, 12 h后加入不同的刺激物进行干预,继续再培养12 h。收集细胞,使用细胞计数试剂盒(CCK8)测定细胞活力; 细胞迁移和侵袭试剂盒检测细胞迁移和侵袭能力。
1.8 Western blot检测蛋白表达
制备细胞悬液,加入适量蛋白裂解液[RIPA 蛋白裂解液1 mL + 磷酸酶/蛋白酶抑制剂10 μL+苯甲磺酰氟(PMSF)10 μL], 置于冰上,于摇床上裂解30 min, 离心去蛋白上清,BCA法测蛋白浓度,加热使蛋白变性。向聚丙烯酸凝胶每孔中加入20~30 μg的蛋白样品,经过电泳、转膜等步骤将蛋白转至聚偏二氟乙烯(PVDF) 膜上,封闭洗涤后,加入一抗4 ℃孵育过夜,洗膜缓冲液(TBST)清洗3次,每次10 min, 然后室温下二抗孵育2 h, 最后TBST清洗3次,每次10 min。使用Syngene G: BOX 凝胶成像系统,曝光拍照。
1.9 酶联免疫吸附试验(ELISA)检测细胞因子
表达
分别收集对照组、METs组、C29组、IAXO-102和C29+IAXO-102联合干预组的培养液上清,根据制造商的说明,用ELISA试剂盒测量白细胞介素6(IL-6)、基质金属蛋白酶1(MMP-1)、基质金属蛋白酶3(MMP-3)和基质金属蛋白酶13(MMP-13)的水平。所有标准品和样品均使用酶标仪(SpectraMax M5, Molecular Devices)在 450/505 nm波长下进行测量。
1.10 统计学分析
运用SPSS 17.0统计分析软件对数据进行分析,所有数据以均数±标准差表示, 2组正态分布资料采用独立样本t检验,多组间采用单因素方差分析。P<0.05为差异具有统计学意义。
2 实验与结果
2.1 THP-1细胞系诱导成巨噬细胞
采用佛波酯诱导THP-1细胞成巨噬细胞,通过光镜进行形态学观察,并采用荧光显微镜对诱导的细胞进行荧光鉴定(图1), 蓝色的DAPI为细胞核,绿色的F4/80为巨噬细胞标记物。

A: THP-1单核细胞系被诱导成巨噬细胞的明场图像; B: THP-1单核细胞系被诱导成巨噬细胞的荧光鉴定,蓝色的DAPI为细胞核,绿色的F4/80为巨噬细胞标记物,标尺为100 μm。图1 THP-1细胞系诱导成巨噬细胞
2.2 LPS诱导巨噬细胞产生METs
分别使用LPS和IFN-γ诱导巨噬细胞产生METs, Sytox标记外泄的DNA水平,Western blot和免疫荧光法检测METs主要蛋白成分弹性蛋白酶(NE)和髓过氧化物酶(MPO), 结果提示LPS诱导METs能力显著强于IFN-γ(P<0.05), 外泄DNA采用绿色的Sytox标记,蓝色的DAPI为细胞核,绿色的为MPO, 红色为NE, 见图2。
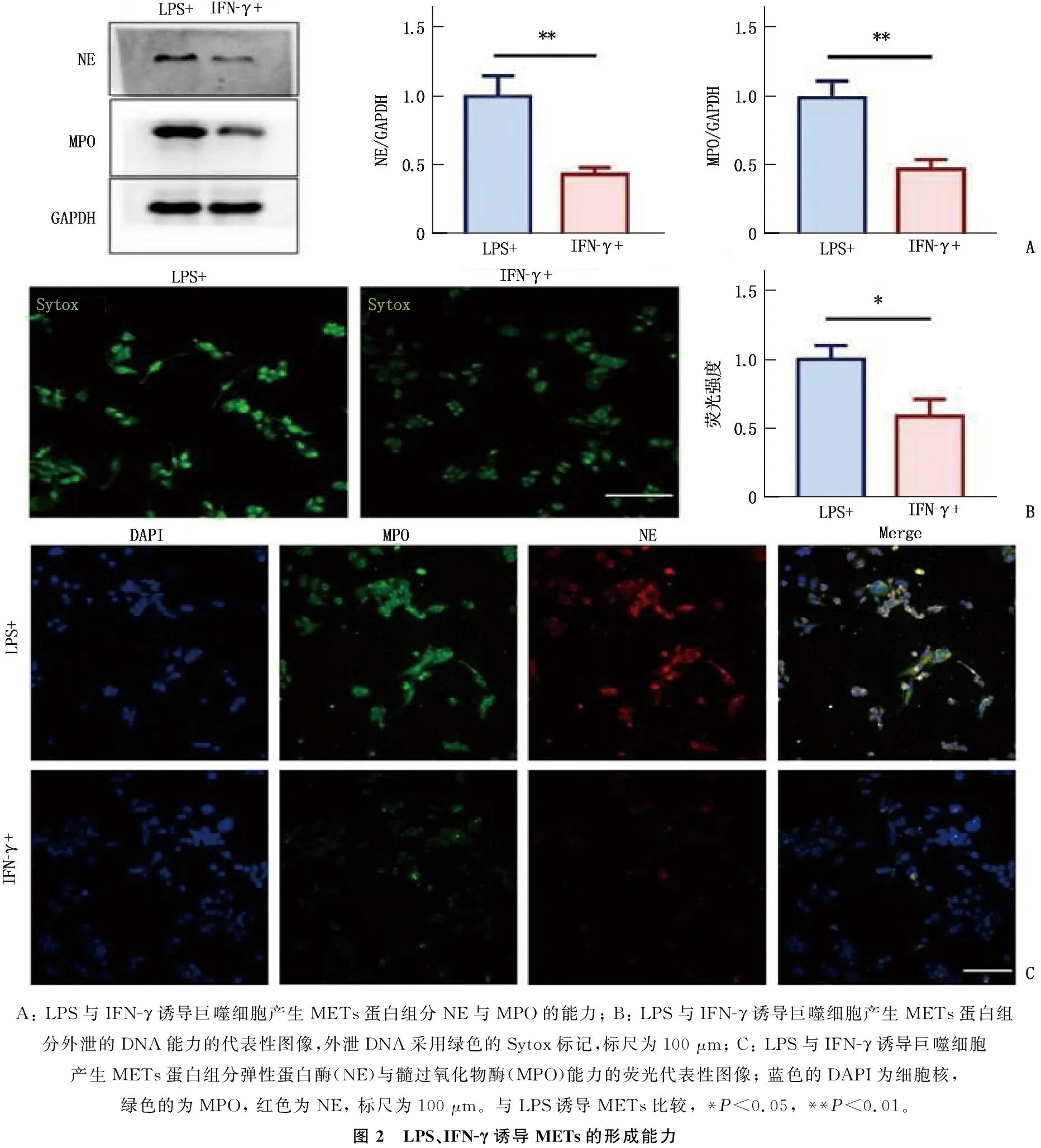
A: LPS与IFN-γ诱导巨噬细胞产生METs蛋白组分NE与MPO的能力; B: LPS与IFN-γ诱导巨噬细胞产生METs蛋白组分外泄的DNA能力的代表性图像,外泄DNA采用绿色的Sytox标记,标尺为100 μm; C: LPS与IFN-γ诱导巨噬细胞产生METs蛋白组分弹性蛋白酶(NE)与髓过氧化物酶(MPO)能力的荧光代表性图像; 蓝色的DAPI为细胞核,绿色的为MPO, 红色为NE, 标尺为100 μm。与LPS诱导METs比较, *P<0.05, **P<0.01。图2 LPS、IFN-γ诱导METs的形成能力
2.3 METs蛋白组分对FLSs活化的影响
用METs蛋白组分刺激FLSs 24 h, 检测FLSs细胞活力,结果显示与对照组相比, METs蛋白显著增强FLSs的活力、FLSs的迁移和侵袭能力(P<0.05); 同时上清中细胞因子IL-6、MMP-1、MMP-3和MMP-13水平显著升高(P<0.05)。与METs组相比,采用TLR2抑制剂(C29)和TLR4抑制剂(IAXO-102)单用或联用干预后FLSs的活力下降,细胞迁移和侵袭能力减弱(P<0.05), 联合干预组上清中IL-6[对照组: (26.03±4.99) pg/mL; METs组: (337.80±67.34) pg/mL; C29组: (183.80±11.73) pg/mL; IAXO-102组: (78.85±8.02) pg/mL; C29+IAXO-102联合干预组: (82.30±11.05) pg/mL]、MMP-1[对照组: (234.90±31.40) pg/mL; METs组: (3 404.00±678.70) pg/mL; C29组: (1 750.00±191.00) pg/mL; IAXO-102 组: (766.50±85.14) pg/mL; C29+IAXO-102联合干预组: (790.50±134.60) pg/mL)]、MMP-3[对照组: (18.44±4.88) pg/mL; METs组: (151.60±21.49) pg/mL; C29组: (115.80±9.76) pg/mL; IAXO-102组: (94.27±16.86) pg/mL; C29+IAXO-102 联合干预组: (97.04±11.50) pg/mL]和MMP-13[对照组: (118.40±20.87) pg/mL; METs组: (836.40±105.20) pg/mL; C29 组: (587.70±90.57) pg/mL; IAXO-102组: (396.20±80.91) pg/mL; C29+IAXO-102联合干预组: (327.20±60.74) pg/mL]水平下降(P<0.05), 且IAXO-102组抑制能力强于C29组,差异有统计学意义(P<0.05), 见图3。
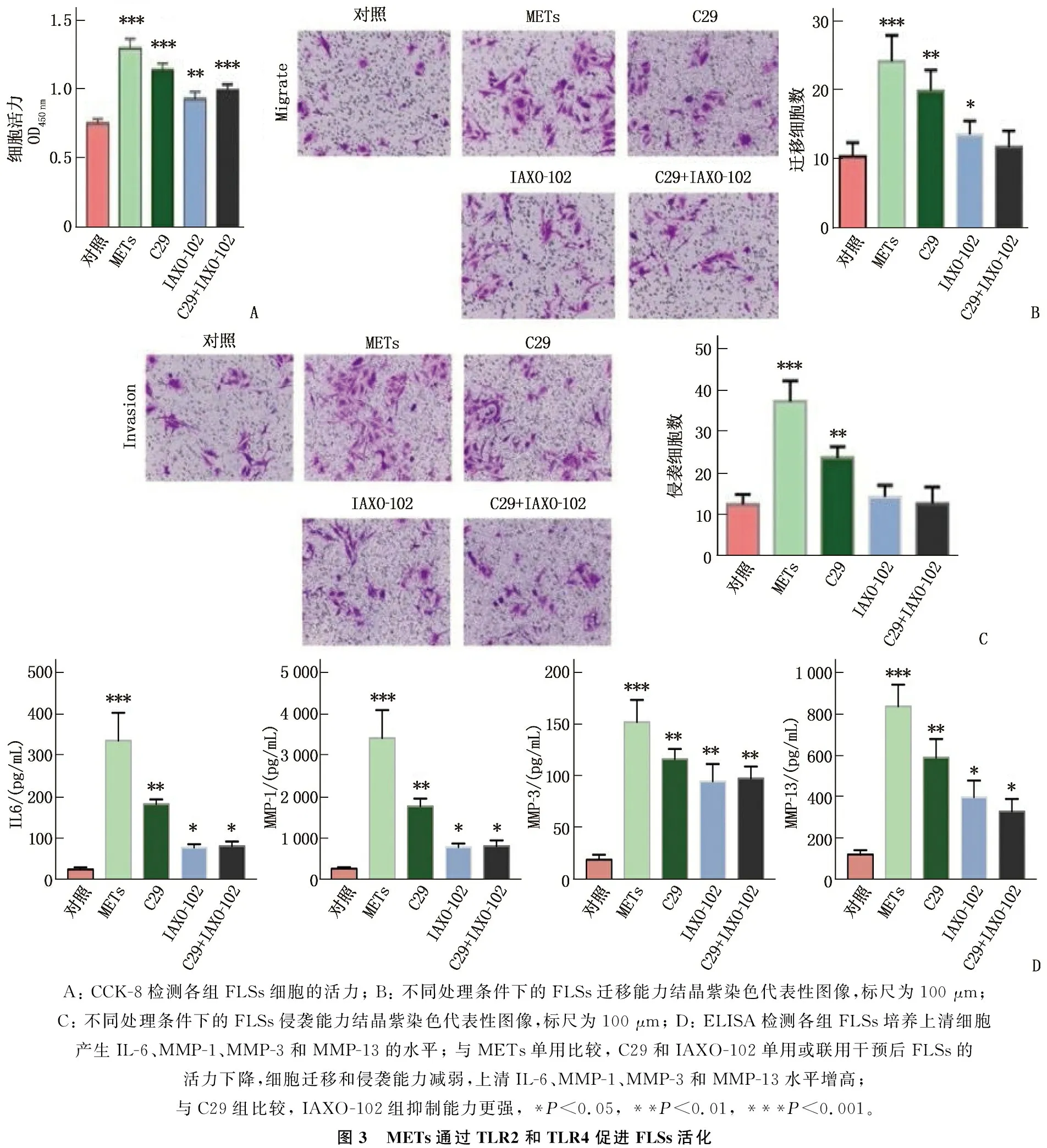
A: CCK-8检测各组FLSs细胞的活力; B: 不同处理条件下的FLSs迁移能力结晶紫染色代表性图像,标尺为100 μm; C: 不同处理条件下的FLSs侵袭能力结晶紫染色代表性图像,标尺为100 μm; D: ELISA检测各组FLSs培养上清细胞产生IL-6、MMP-1、MMP-3和MMP-13的水平; 与METs单用比较, C29和IAXO-102单用或联用干预后FLSs的活力下降,细胞迁移和侵袭能力减弱,上清IL-6、MMP-1、MMP-3和MMP-13水平增高; 与C29组比较, IAXO-102组抑制能力更强, *P<0.05, **P<0.01, ***P<0.001。 图3 METs通过TLR2和TLR4促进FLSs活化
3 讨 论
NETs 组成成分复杂,其网状结构中附着多种参与炎症反应的蛋白[6]。RA患者外周血和滑液中NETs的形成数量显著高于健康人群,且NETs数量与炎症指标如血沉、C反应蛋白以及RA标志性自身抗体抗瓜氨酸化蛋白抗体(ACPA)水平均存在显著正相关性。本实验室前期研究也证实由瓜氨酸化蛋白介导生成的NETs可以作用于滑膜FLSs, 促进FLSs分泌炎性细胞因子、趋化因子、黏附分子等,从而扩大RA的炎症反应。研究[7]发现,巨噬细胞同样可形成METs。METs与NETs具有相似的特征,由DNA纤维和组蛋白等细胞蛋白组成。目前研究[8]发现,细菌、病毒等病原微生物以及M1型巨噬细胞等均可导致METs形成增多。本实验室前期研究发现, RA滑膜巨噬细胞较正常人明显增多,增多的巨噬细胞产生大量METs,提示其可能参与RA发病,但具体机制尚不清楚。
滑膜是RA炎症发生的主要场所,高度活化的滑膜巨噬细胞能够通过与FLSs相互作用分泌介质,促进滑膜炎的持续和细胞外基质的破坏。滑膜巨噬细胞能产生致炎细胞因子[肿瘤坏死因子-α (TNF-α)、白细胞介素1(IL-1)、IL-6等][9]、趋化因子[趋化因子2(CCL-2)、趋化因子3(CCL-3)、趋化因子5(CCL-5)、趋化因子8(CXCL-8)和趋化因子1(CXCL-1)][10]和生长因子,而活化的FLSs是RA患者IL-6和基质金属蛋白酶(MMPs)的主要来源。本实验室前期研究发现, RA滑膜存在METs过度形成的现象。METs的成分较为复杂,主要由DNA组成的胞外纤维和蛋白组分构成。将纯化的METs蛋白组分加入FLSs培养液中,结果发现, METs中的蛋白组分可以增强FLSs的活力,促进FLSs分泌IL-6、MMP-1、MMP-3和MMP-13, 并增强FLSs的迁移和侵袭能力,提示METs蛋白参与FLSs的激活,但其具体机制尚未明确。
TLRs是一类重要的模式识别受体,可识别微生物感染的存在,激发机体免疫反应。同时, TLRs识别一些宿主衍生分子降解产物,即损伤相关模式分子(DAMPS), 主要包括细胞坏死后释放的细胞内分子和细胞外基质分子等[11]。TLR2和TLR4在类风湿关节炎患者成纤维细胞(FLSs)活化过程中发挥重要作用。细菌肽聚糖(PGs)通过TLR2促进FLSs中MMP-1、MMP-3、MMP-13、IL-6和IL-8的表达[12]。TLR4在氧化剂刺激下,诱导FLSs增殖,导致高迁移率蛋白酶1(HMGB1)和其他炎症因子释放[13]。此外, TLR2表达增加,可上调磷脂酶A2(PLA2)的磷酸化水平,促进花生四烯酸(AA)的释放、前列腺素E2(PGE2)的产生和FLSs中促炎因子的表达,参与RA炎症过程[14]。本实验室前期研究发现,纯化的METs蛋白可以激活FLSs, 在培养体系中单独或同时加入TLR2、TLR4抑制物, FLSs活化能力显著减弱,且TLR4抑制物(IAXO-102)作用显著强于TLR2抑制物(C29), 提示METs蛋白作为损伤相关模式分子活化TLR4, 活化的TLR4进一步激活FLSs, 进而参与RA发病。
本研究探讨了巨噬细胞除增殖、极化参与RA炎症外,还可通过形成METs激活FLSs, 进而参与RA发病。本研究以期为进一步阐明RA发病机制提供理论依据。
