术前血清MMP-9水平对HBV相关肝细胞癌患者肝切除术后生存的预测作用
2023-01-07高武林韦超郭晓烨
高武林,韦超,郭晓烨
(北京市房山区第一医院 普外科,北京 102400)
肝细胞癌(hepatocellular carcinoma,HCC)是世界上第六大常见恶性肿瘤,也是我国癌症相关死亡的第二大原因[1]。在我国,大约有1亿人是乙型肝炎病毒(hepatitis B virus,HBV)携带者,这与70%~90%的肝癌进展有关[2]。外科手术被认为是HCC最主要的治疗方案。但即使是根治性切除,术后仍有较多患者复发或转移,其远期生存预后仍不理想[3]。因此,迫切需要寻找评估HBV-HCC治疗反应和预后的可靠预测因子。基质金属蛋白酶(matrix metalloproteinases,MMPs)是一个结构上相关但遗传学不同的含锌酶家族,参与调节癌细胞生长、分化、凋亡和免疫监控[4]。MMP-9作为一种分泌蛋白酶,可通过促进新血管形成和淋巴管生成加速肿瘤转移,在癌细胞侵袭、肿瘤转移和肿瘤血管生成中起重要作用[5]。先前已在不同的恶性肿瘤组织中观察到MMP-9的过度表达,其过表达通常与不良预后有关[6-7]。但是国内临床学者对于MMP-9在HBV-HCC患者预后中的作用关注度有限。因此,本研究通过分析术前血清MMP-9与HBV-HCC患者临床特征的关系,旨在探讨术前血清MMP-9对HBV-HCC患者肝切除术后生存的预测作用,为寻找可靠的生物标志物和改进临床治疗策略提供依据。
1 资料与方法
1.1 一般资料
收集2012年1月至2016年11月在我院普外科行根治性肝切除术的868例HBV-HCC患者(HBV-HCC组)的临床资料,其中男727例,女141例,年龄12~82岁,中位年龄50.0岁。所有患者术前均接受常规评估,包括完整的血液学和血清生化检查、计算机断层扫描(CT)和磁共振成像(MRI)扫描。纳入标准:HCC的诊断是基于特异性影像学表现,α-甲胎蛋白(alpha-fetoprotein,AFP)升高≥400 ng·ml-1持续1个月或AFP≥200 ng·ml-1持续2个月,或组织学确认[8];无肝外转移证据;HBV表面抗原(HBV surface antigen,HBsAg)检测阳性;术后经病理检查无残余肿瘤及切缘阴性(R0)。排除标准:除乙型肝炎以外的其他传染病,如丙型肝炎病毒、丁型肝炎病毒或艾滋病毒的单一或共同感染;自身免疫性肝炎、药物性肝炎、酒精性肝病、脂肪性肝炎、肝移植史;入院前3个月消化道出血和(或)输血;心肺肾等严重功能障碍或其他慢性消耗性疾病;心血管疾病、经颈静脉肝内门体分流或门静脉血栓形成。另外纳入250例慢性乙型肝炎(CHB)患者作为CHB组。CHB被定义为在登记前至少6个月内HBsAg呈阳性,且没有肝硬化或肝癌的证据。根据病史、体检结果、生化、超声检查结果诊断为CHB。选择277例肾功能和肝功能正常,无任何肝病史、饮酒史、心血管疾病或血液疾病史,排除其他急慢性疾病的健康志愿者纳入健康对照组。CHB组、健康对照组人群年龄、性别构成与HBV-HCC患者相匹配。该研究得到了本院伦理委员会的批准,并获得了书面知情同意书。本研究对患者的后续管理没有影响。
1.2 资料收集
收集所有研究对象的人口统计学和临床资料,采用日立7600-20全自动生化分析仪测定总胆红素(total bilirubin,TBIL)、丙氨酸氨基转移酶(alanine aminotranseferase,ALT)、天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)、白蛋白(albumin,ALB)水平。上述指标的分界值均是根据检验科提供的正常参考范围而设定。术前1周内收集所有血液指标,根据病理报告记录肿瘤最大直径、病灶数量、肿瘤Ishak纤维化分期和癌旁组织Ishak炎症评分,以及肝包膜浸润情况、分化程度、微血管浸润和微卫星不稳定情况。
1.3 血清MMP-9检测
分别在术前及术后随访各时间点采集所有受试者清晨空腹静脉血5 ml于抗凝管中,置于4 ℃环境下,4 000 r·min-1离心15 min,分离血清,-80 ℃冰箱保存待测。采用酶联免疫吸附试验(ELISA)测定血清MMP-9和AFP水平,试剂盒均购自武汉菲恩生物科技有限公司。所有检测均由对研究终点不知情的技术人员进行。
1.4 随访
最后一次跟进时间是2021年12月31日,或者患者死亡时。术后第1年,每3个月随访1次,随后每3~6个月随访1次。每次随访由专业医生独立进行血液学检测和肝脏超声检查。每6个月进行1次腹部CT扫描。如果怀疑复发,立即进行CT或MRI检查以确认诊断。确诊复发的患者接受进一步治疗。如果复发的肿瘤是局限性的,建议进行二次肝切除、射频消融或经皮乙醇注射。如果复发的肿瘤是多发性或弥漫性的,则进行经导管动脉化疗栓塞。治疗决定基于复发模式和肝功能储备。无病生存期(disease-free survival,DFS)定义为手术日期至复发、任何原因死亡或已知患者无病的最后日期之间的时间。总生存期(overall survival,OS)定义为手术日期至随访截止时间或死亡时间。
1.5 统计学处理
所有统计数据均使用SPSS 26.0软件输入和分析。用中位值(IQR)描述连续变量,3组间比较采用K-W检验,两两比较采用Mann-Whitney检验;二分类变量以率(%)表示,并进行卡方检验。绘制受试者工作特征(receiver operating characteristic,ROC)曲线以确定血清MMP-9的诊断价值。建立Kaplan-Meier生存曲线,并采用COX回归比例风险模型分析影响HBV-HCC患者术后生存预后的危险因素。统计学显著性假设为α=0.05。
2 结 果
2.1 3组受试者血清MMP-9水平比较
与健康对照组[27.82(9.45,41.50)ng·ml-1]比较,CHB组[37.46(13.51,91.24)ng·ml-1]和HBV-HCC组[74.60(46.70,122.08)ng·ml-1]患者血清MMP-9水平均有所升高(H=11.274,P<0.05),且HBV-HCC组患者基线血清MMP-9水平显著高于CHB组(Z=-6.081,P<0.05)。经ROC曲线分析,血清MMP-9水平用于区分CHB和HBV-HCC的曲线下面积(AUC)为0.726(95%CI:0.693~0.760),用于诊断HBV-HCC的AUC为0.773(95%CI:0.742~0.804),见图1。
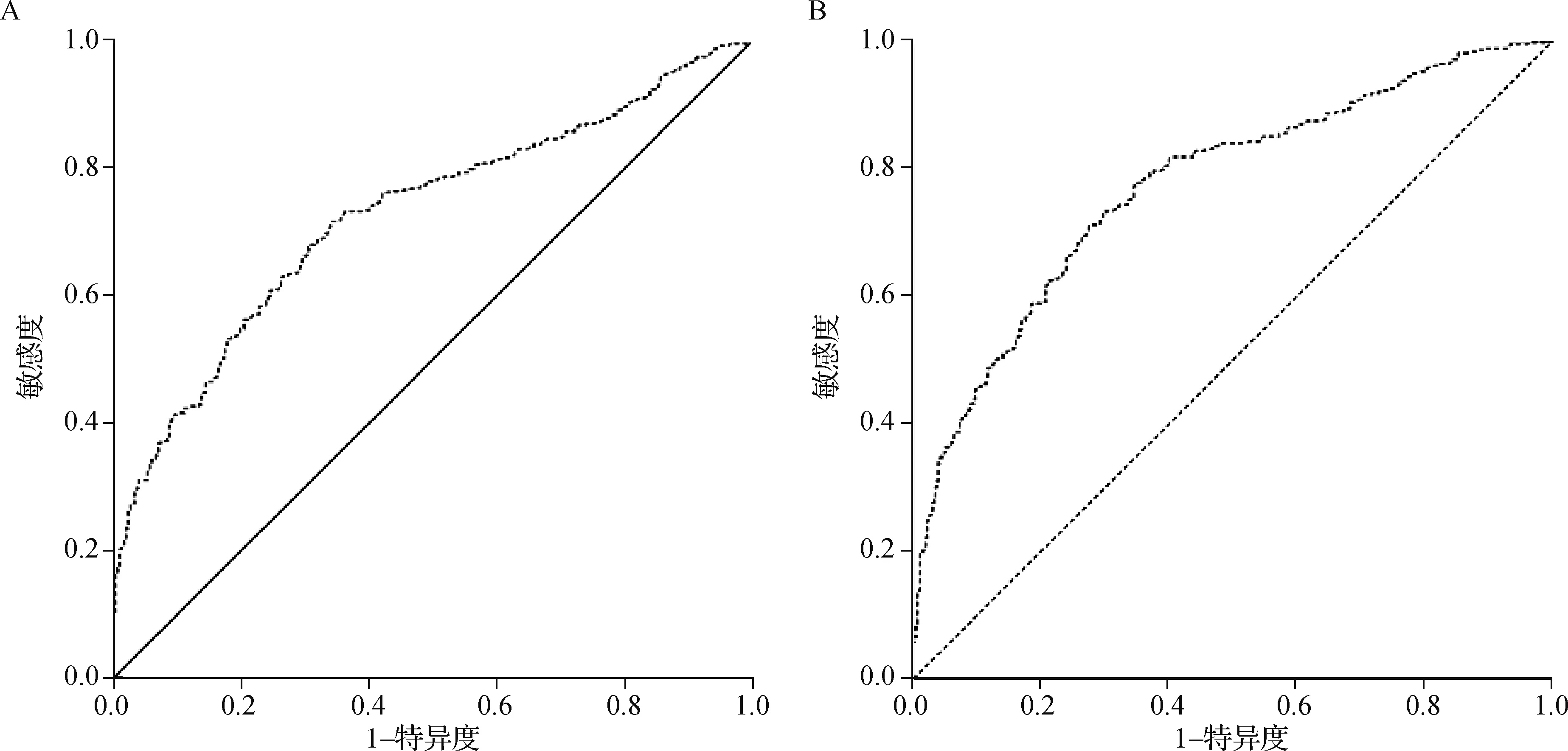
图1 基线血清MMP-9水平用于区分HBV-HCC和CHB(A)、HBV-HCC和CHB+健康对照(B)的ROC曲线Fig 1 ROC curve of baseline serum MMP-9 level used to distinguish HBV-HCC vs. CHB (A) or HBV-HCC vs. CHB+healthy control (B)
2.2 MMP-9水平与HCC患者不同临床特征的关系
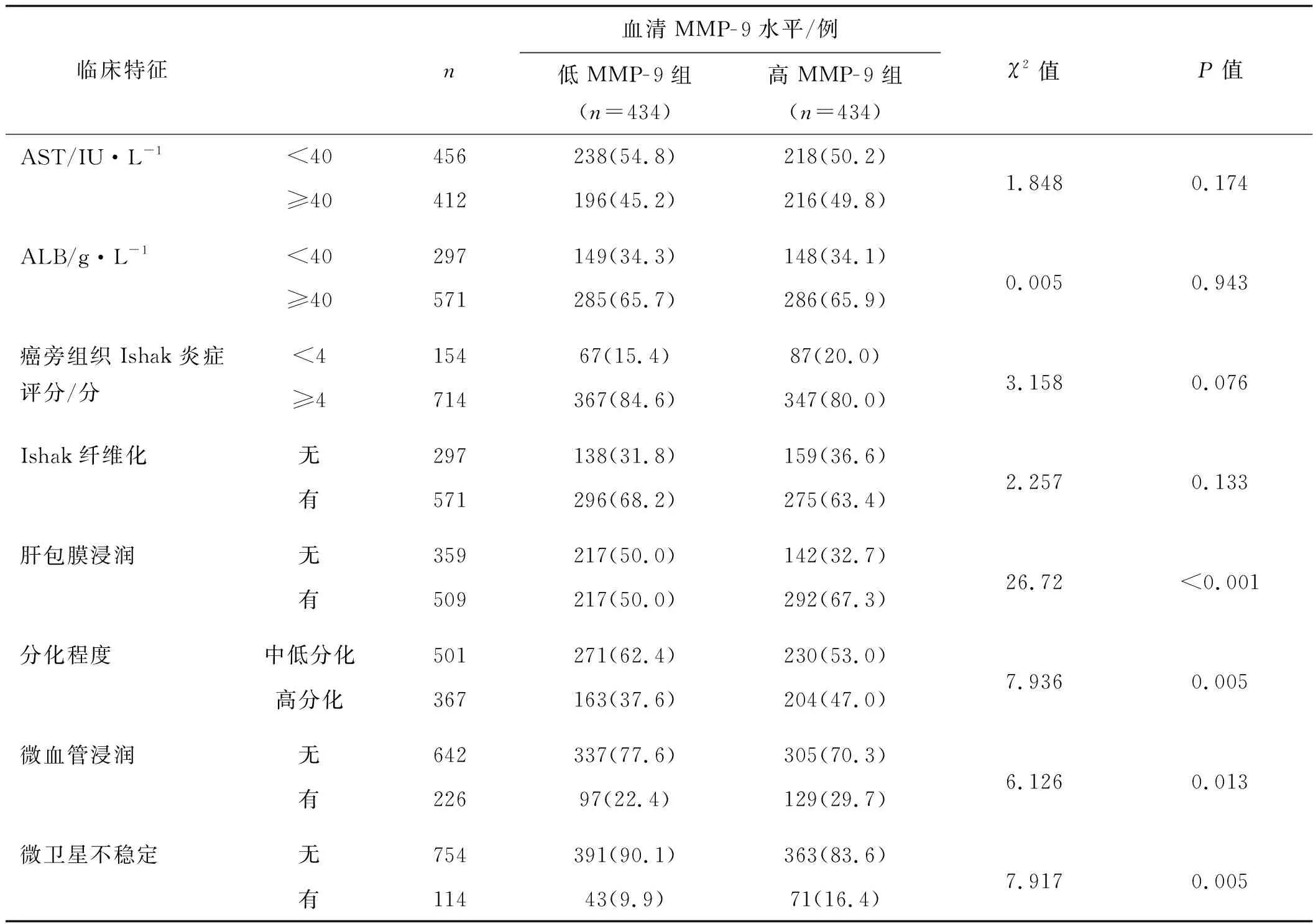
根据MMP-9水平中位值将患者分为低MMP-9组(<74.60 ng·ml-1)和高MMP-9组(≥74.60 ng·ml-1)。血清MMP-9的表达与患者肿瘤直径、病灶数量、BCLC分期、HBV-DNA、肝包膜浸润、分化程度、微血管浸润、微卫星不稳定有关(P<0.05),而与患者年龄、性别、AFP、白蛋白-胆红素(ALBI)评分、白细胞(WBC)、淋巴细胞计数(TLC)、血小板(PLT)、TBIL、ALT、AST、ALB、癌旁组织Ishak炎症评分、Ishak纤维化均无关(P>0.05),见表1。

表1 MMP-9水平与HBV-HCC患者不同临床特征的关系Tab 1 Relationship between MMP-9 level and different clinical features of patients with HBV-HCC
(续表)
2.3 MMP-9水平与HCC患者肝切除术后生存的关系
随访期间,高MMP-9组和低MMP-9组术后中位生存时间分别为29、49个月,高MMP-9组1、3、5年OS分别为73.9%(321/434)、44.0%(191/434)、32.9%(143/434),低MMP-9组1、3、5年OS分别为99.3%(431/434)、85.0%(369/434)、74.9%(325/434),两组比较差异有统计学意义(Log Rankχ2=202.610,P<0.001);高MMP-9组1、3、5年DFS分别为52.7%(229/434)、24.6%(107/434)、8.7%(38/434),低MMP-9组1、3、5年DFS分别为85.2%(370/434)、58.0%(252/434)、24.6%(107/434),两组比较差异有统计学意义(Log Rankχ2=149.134,P<0.001)。见图2。

图2 随访5年期间Kaplan-Meier曲线Fig 2 Kaplan-Meier curve during 5-year follow-up
2.4 Cox回归分析
经单因素和多因素Cox回归比例风险模型分析,术前血清MMP-9、ALBI、AFP、PLT、肿瘤直径、分化程度、有无微血管浸润和微卫星不稳定是影响患者OS的独立危险因素(P<0.05),术前血清MMP-9水平、肿瘤直径、病灶数量、HBVDNA、AST、有无微血管浸润和微卫星不稳定是影响患者DFS的独立危险因素(P<0.05),见表2。

表2 单因素和多因素Cox回归分析影响术后生存预后的危险因素Tab 2 Risk factors influencing postoperative survival prognosis by univariate and multivariate Cox regression analysis
3 讨 论
HCC是最常见的恶性肿瘤之一,肝切除术后生存预后较差[1]。HBV感染可促进术后复发,引起过度炎症,损害残余肝功能,加重肝切除术后残肝纤维化,降低HBV-HCC患者肝切除术后的生存率[9]。因此,寻找一些可以预测术后生存预后的潜在标志物将有助于更有针对性的预防治疗。本研究结果显示,HBV感染患者血清MMP-9水平较健康对照人群普遍升高,且HBV-HCC患者较CHB患者升高更明显,高MMP-9水平是HBV-HCC预后的独立危险因素,并与疾病进展、HBV DNA拷贝数有关,进一步经ROC曲线证实,血清MMP-9水平可在慢性HBV感染中高度区分HCC和非HCC疾病。此外,血清MMP-9水平升高也与HBV-HCCMMPs主要作为无活性的前蛋白分泌并在被其他细胞外蛋白酶切割后激活,在血管生成、细胞迁移以及一些病理进展(包括癌细胞侵袭和转移)中发挥作用[4]。MMP-9是Ⅳ型胶原酶,对基底膜具有很高的活性,可降解细胞外基质[10]。研究证实,包含整合的HBV基因组的Hep3B细胞能够持续分泌HBsAg,并表达HBV基因组RNA,从而促进MMP-9前体分子(proMMP-9)分泌[11]。通过酶谱分析,在Hep3B细胞中可检测到少量活性MMP-9,而感染HBV的Hep3B细胞中MMP-9表达迅速上调。活性MMP-9表达上调会进一步促进纤溶酶的侵袭潜力[12],这也部分解释了HBV感染者血清MMP-9水平升高的原因。此外,从分子机制分析,MMP-9被认为是肿瘤生长和转移的关键调控因子,肿瘤细胞中MMP-9的过表达会增强基底膜的降解,促进附近血管的侵袭,然后向远处组织外溢形成新的转移位点[13]。MMP-9是属于锌金属蛋白酶家族的经典酶,参与细胞外基质的降解;而肿瘤的恶性进展通常伴随细胞外基质的降解[14],因此HBV-HCC患者血清MMP-9水平较CHB组患者会进一步升高。
患者预后不良相关。这些结果均支持MMP-9参与HBV-HCC的发生和进展,表明血清MMP-9水平的测定不仅对HBV-HCC具有诊断价值,还具有良好的预后预测价值。
目前MMP-9已被证明在人肝癌细胞和各种其他类型的癌症中分泌,包括肺癌、结肠癌、胃癌和乳腺癌,并与胃癌和胰腺癌患者的不良预后相关[6-7]。在微环境方面,各种基质细胞被迫招募并定位于恶性肿瘤,增强了原发癌的侵袭性,促进了远处转移,进而导致患者治疗失败或预后不良[15-16]。肿瘤相关巨噬细胞(tumor associated macrophages,TAMs)与骨髓来源的抑制细胞相关,是促进肿瘤进展的炎症的关键原型组成部分。实体肿瘤通常被巨噬细胞浸润。有研究[17]认为MMP-9主要是由TAMs分泌,通过MMP-9/PI3K/AKT/Snail依赖途径诱导肿瘤上皮向间充质转化过程,这可能是导致术后肿瘤复发的重要机制之一,而阻断MMP-9信号的转导有望成为抑制胃癌术后复发的潜在策略之一。同样地,Wu等[14]也证实MMP-9的表达主要是由锚定在多形核中性粒细胞表面的CD11b/CD18整合素诱导的,CD11b/CD18则来源于HCC基质M2外显子。因此即使手术切除肿瘤组织,残余的TAMs仍可促进MMP-9释放,MMP-9可以减弱血管和淋巴管的基底膜,使癌细胞直接浸润到血管系统,参与肿瘤的转移和侵袭[18]。在之前的对HCC患者研究[19-21]显示,MMP-9表达已被证明是侵袭性、转移和预后不良的标志物。这些基础研究数据均明确证实MMP-9促癌因子的活性,这也从分子机制方面解释了本研究结果,即术前血清MMP-9水平升高预示着HBV-HCC患者预后不良。另外还需说明的一点,本研究中血清MMP-9水平与AFP无关,且MMP-9对预后的影响也是独立于AFP的表达,提示血清MMP-9水平有可能作为HBV-HCC(包括AFP阴性HCC)的预后生物标志物。
综上,本研究表明血清MMP-9水平升高与HBV-HCC的不良预后相关,这点支持了MMP-9参与疾病进展以及血清MMP-9作为HBV-HCC预后生物标志物的可能性。为了证实这些结果,还需要对与各种病因相关的大样本HCC患者进行研究。
