lnc-POTEG-4调控miR-498/AR表达抑制食管鳞状细胞癌铁死亡的发生
2023-01-07米彩锋赵武斌李亚利余儒桓杨洋
米彩锋,赵武斌,李亚利,余儒桓,杨洋
(1.平顶山学院第一附属医院 消化内科,河南 平顶山 467000; 2.平顶山学院第一附属医院 医教部,河南 平顶山 467000; 3.郑州大学第一附属医院 胸外科,河南 郑州 450052)
食管癌是一种常见的消化道肿瘤,其主要病理类型有食管腺癌(adenocarcinoma of esophagus,EAC)和食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)[1]。EAC在西方国家很常见,而ESCC是包括中国在内的亚洲地区的主要病理类型[2]。研究ESCC的分子机制对治疗和预后具有重要意义。
最近的研究表明,在某些癌细胞中存在一种铁依赖性的细胞死亡形式,称为铁死亡[3]。与细胞坏死和凋亡不同,铁死亡的过程以脂质过氧化产物和铁代谢产生的致命活性氧(ROS)的积累为特征[4]。值得注意的是,铁死亡在调节多种肿瘤的进展中起着重要作用[5]。一些学者假设铁死亡可能是恶性肿瘤的一种治疗方法,而这种方法的有效程度有待进一步探究。
长非编码RNA(lncRNAs)已受到研究者的广泛关注,根据定义,lncRNAs由200个核苷酸组成,不具有功能性蛋白质编码能力[6]。越来越多的证据证实,LncRNA靶向下游microRNA(miRNA)和基因诱导癌细胞铁死亡[7]。如LINC00336在肺癌中表达上调,并作为癌基因抑制肺癌细胞铁死亡[8]。本研究借助GEO芯片表达数据发现lnc-POTEG-4在ESCC中呈显著高表达,而lnc-POTEG-4在ESCC中的功能并未有相关报道。因此,有必要对lnc-POTEG-4在ESCC中的作用及其机制进行探讨。miR-498作为lnc-POTEG-4的靶点,已被证实在ESCC组织和细胞中表达下调,能够抑制ESCC细胞增殖、凋亡和迁移[9]。进一步找到miR-498的下游靶基因雄激素受体(AR),根据以往研究,AR的高表达与ESCC患者总体生存率较低相关,沉默AR能够抑制肿瘤生长[10]。
本研究旨在通过介导铁死亡,来确定lnc-POTEG-4在ESCC进展中的作用及其潜在的促肿瘤机制。
1 材料和方法
1.1 仪器和试剂
人食管上皮细胞系Het-1a和ESCC细胞系Eca9706、Eca109、KYSE150、KYSE450来自中国科学院细胞库,Opti-MEM培养基脂质体3000和TRIzol试剂来自美国Invitgen公司,miR-498模拟物/抑制剂、pcDNA-AR和对照载体购自上海吐露港生物科技有限公司,Opti-MEM培养基(31985070)和QIAGEN质粒提取试剂盒(12943)购自上海凌仪生物科技有限公司,ROS检测试剂盒-DCFHDA和丙二醛(MDA)检测试剂盒(GL2090)来自北京百奥莱博科技有限公司,铁比色分析试剂盒来自深圳市锦贤科技有限公司,KAPATMSYBR®快速定量PCR试剂盒购自北京普凯瑞生物科技有限公司,Erastin、NRF2抑制剂、GPNA和化合物968均来自MCE公司,双荧光素酶基因检测试剂盒(D0010)和CCK-8检测试剂盒(CA1210)来自北京索莱宝科技有限公司,荧光原位杂交试剂盒为上海歌凡生物科技有限公司产品。
1.2 方法
1.2.1 组织采集 对平顶山学院第一附属医院2018年9月至2020年12月间接受ESCC切除术但未进行术前放化疗的62例患者的ESCC组织和邻近正常组织进行采集。在分析之前,所有样品都储存在-80 ℃ 下。所有参与研究的患者都签署了知情同意书,研究符合《世界医学协会赫尔辛基宣言》。
1.2.2 细胞培养 Het-1a和Eca9706、Eca109、KYSE150、KYSE450在RPMI 1640培养基中培养,加入10%胎牛血清(FBS)、1%青霉素/链霉素和1% L-谷氨酰胺,细胞在37 ℃、含5%CO2的培养箱中培养。
1.2.3 细胞转染 将Eca109细胞接种于6孔培养板中培养过夜。将lnc-POTEG-4亚克隆到pEGFP-N1载体中,将lnc-POTEG-4 ShRNA序列连接到pGPU6/GFP/Neo载体中,构建si-lnc-POTEG-4质粒,用QIAGEN质粒提取试剂盒提取过表达质粒和干扰质粒,将miR-498模拟物/抑制剂、pcDNA-AR、si-lnc-POTEG-4和对照载体分别用脂质体3000试剂和Opti-MEM培养基转染Eca109细胞。
1.2.4 CCK-8试验 CCK-8试剂盒用于检测Eca109细胞的活力。细胞以每孔1×104个细胞的密度接种在96孔板中,并在37 ℃、含5%CO2培养箱中培养2 h以使细胞黏附。向每个孔中添加10 μl CCK-8溶液并混合,然后再培养细胞2 h。使用双波长微孔板读取器在450 nm处测量OD值。
1.2.5 ROS和MDA生成测定 使用ROS检测试剂盒-DCFHDA检测细胞内ROS,用荧光显微镜监测DCF荧光以确定ROS水平。采用MDA检测试剂盒(TBA微板法)检测细胞内脂质过氧化反应。
1.2.6 Fe2+水平的测定 将细胞以1×105个细胞·孔-1的密度在6孔板中培养24 h后用Erastin或NRF2抑制剂处理,根据用户使用说明书使用铁比色分析试剂盒评估细胞内Fe2+水平。
1.2.7 qRT-PCR 使用TRIzol试剂从组织(ESCC及其对照)和细胞(Eca109)中纯化和提取总RNA,以总RNA作为模板合成互补DNA(cDNA)。使用KAPATMSYBR®快速定量PCR试剂盒按照制造商的使用说明混合反应溶液,甘油醛-3-磷酸脱氢酶(GAPDH)(对于lnc-POTEG-4和AR)或U6(对于miR-498)作为内参,lnc-POTEG-4、miR-498和AR的水平通过2-ΔΔCT方法进行标准化。引物序列见表1。

表1 qRT-PCR序列Tab 1 qRT-PCR sequences
1.2.8 荧光原位杂交 细胞盖玻片用4%多聚甲醛固定20 min然后将盖玻片置于PBS(pH 7.4)中在脱色摇床上洗涤3次,每次5 min。用免疫组化笔画圈,根据不同组织的特点,蛋白酶K(20 μg·ml-1)处理1~5 min,盖玻片用PBS洗涤3次,每次5 min。添加预混合溶液,并在37 ℃培养箱中培养1 h后倒出。添加杂交溶液,使载玻片在4 ℃下杂交过夜。将盖玻片在SSC(2×)中洗涤1次10 min,在SSC(1×)中洗涤两次各5 min,并在SSC(0.5×)中洗涤1次10 min。加入DAPI染料溶液,将盖玻片在黑暗中培养8 min,用PBS洗涤并用抗荧光猝灭剂密封。在荧光显微镜下观察lnc-POTEG-4的细胞定位。lnc-POTEG-4的荧光探针序列为:CTGATATCAAGACGGGAATAATCATAGATGGC。
1.2.9 双荧光素酶报告实验 含miR-498互补序列的lnc-POTEG-4/AR片段插入荧光素酶的基本载体psiCHECK-2,命名为WT-lnc-POTEG-4/WT-AR。同时构建在miR-498结合位点含有突变lnc-POTEG-4/AR的载体,命名为MUT-lnc-POTEG-4/MUT-AR。接下来在miR-498模拟物或其对照物存在下,将上述野生型或突变型报告质粒转染到细胞中。按照用户使用说明书,使用双荧光素酶报告分析系统检查荧光素酶活性。
1.2.10 生物信息学分析 从NCBI数据库(http:∥ncbi.nlm.nih.gov)获取GEO芯片表达数据GSE120356,构建全基因组范围内的LncRNAs表达谱;差异筛选条件为adj.P.Value<0.05和|Log2FC|>1;在LncBook(http:∥bigd.big.ac.cn/lncbook/index)和LncRNASNP数据库(http:∥bioinfo.life.hust.edu.cn/lncRNASNP#!/)获取lnc-POTEG-4的靶miRNAs;TargetSan(http:∥targetscan.org/vert_72/)和miRDB(http:∥mirdb.org)用于获取miR-498的下游靶基因;韦恩图通过Venn(http:∥bioinformatics.psb.ugent.be/webtools/Venn/)绘制;DAVID在线数据库(http:∥david.ncifcrf.gov)对目标基因进行KEGG功能富集分析;DisGeNET数据库(http:∥disgenet.org/search)用于获取ESCC的疾病风险基因;STRING(https:∥string-db.org/)用于预测基因间的相互作用关系。
1.3 统计学处理
实验数据采用SPSS 20.0统计软件进行分析。采用t检验分析两组间的差异,并用单因素方差分析比较多组间的差异。P<0.05为差异具有统计学意义。
2 结 果
2.1 生物信息学工具预测ESCC中可能的分子机制
获取ESCC的GEO芯片表达数据GSE120356,构建全基因组范围内的LncRNAs表达谱。我们发现在配对的5例ESCC组织和癌旁正常组织中,共有2 366个lncRNA差异表达,其中1 032个显著上调,1 334个显著下调。我们在异常高表达的LncRNAs中选取P值校正后(adj.P.Val)显著差异表达的10个LncRNAs绘制热图,其中发现lnc-POTEG-4在ESCC中显著高表达,且在LncRNASNP数据库预测得到lnc-POTEG-4在ESCC中的高表达。但lnc-POTEG-4在ESCC中的功能性研究尚未有相关报道,因此有必要对lnc-POTEG-4在ESCC中的作用及机制进行探讨。
分别在LncBook和LncRNASNP数据库获取lnc-POTEG-4的下游靶miRNAs并取交集,交集结果为hsa-miR-498、hsa-miR-335-3p、hsa-miR-452-3p、hsa-miR-380-3p和hsa-miR-411-3p。仅hsa-miR-498在ESCC中有较为明确的研究依据,因此选择miR-498进行后续分析。在TargetScan和miRDB获取miR-498的下游靶基因并取交集,共有289个交集靶基因,将这289个靶基因进行KEGG功能富集分析,共有7个输出结果,将其绘制为气泡图,其中癌症通路的term较为显著富集(Fold Enrichment=2.252 966 518 025 84;P=0.011 197),将其作为候选基因选取范围。该term中有13个基因(RB1、TCF7L2、RALA、PTCH1、PTGER3、GNAI3、CBL、GNA13、AR、CDK6、EP300、ITGA6、SKP2),与ESCC(CUI:C1142025)的疾病风险基因(ADRA1D、LTA、BRCA1和BRAF)在STRING在线预测网站预测二者间的蛋白相互作用关系,其中AR与其他基因间的紧密连接作用最强,并根据以往研究选用AR进行后续研究。见图1。

A.GSE120356芯片中的差异表达miRNAs;B.LncRNAs差异表达的热图;C.LncRNASNP数据库预测结果;D.lnc-POTEG-4在LncBook和LncRNASNP数据库的交集靶miRNAs;E.lnc-POTEG-4和miR-498的相互作用结合位点;F.miR-498在TargetScan和miRDB中的交集靶基因;G.KEGG分析结果气泡图;H.蛋白相互作用关系图;I.miR-498和AR的特异性结合位点图1 生物信息学工具预测ESCC中可能的分子机制Fig 1 Bioinformatics tools predict possible molecular mechanisms in ESCC
2.2 在ESCC中lnc-POTEG-4和AR表达升高,miR-498表达降低
为了探讨lnc-POTEG-4在ESCC中的生物学功能,我们采用qRT-PCR方法检测lnc-POTEG-4在ESCC组织和细胞系中的相对表达。结果显示,与邻近正常组织和Het-1a相比,ESCC组织和细胞中的lnc-POTEG-4和AR明显上调,而miR-498在ESCC组织和细胞中显著下调(图2)。这些数据表明,lnc-POTEG-4、miR-498和AR的异常表达可能参与了ESCC的进展。
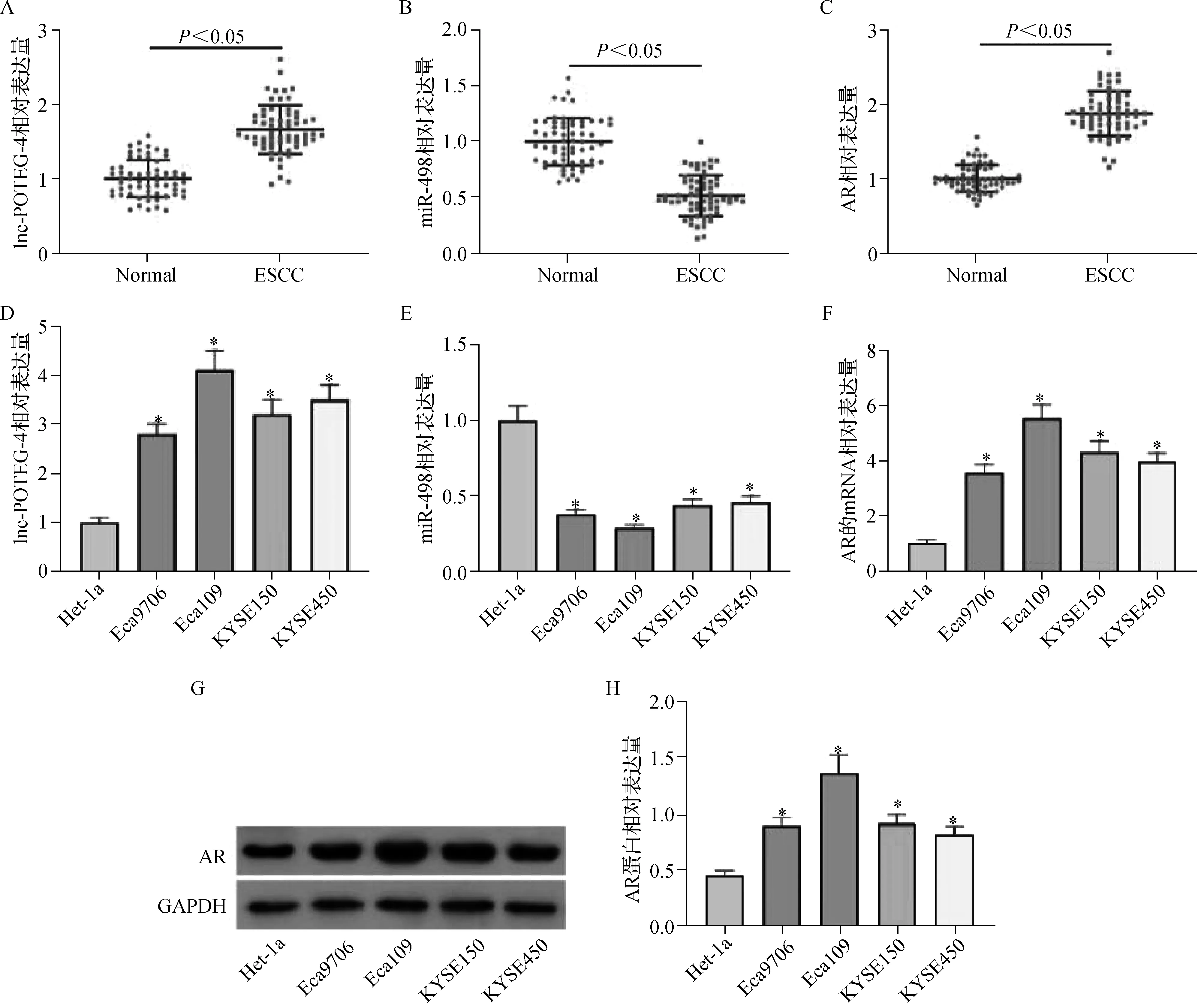
A-C.lnc-POTEG-4、miR-498和AR在ESCC组织及邻近正常组织中的表达;D-H.lnc-POTEG-4、miR-498和AR在Het-1a和Eca9706、Eca109、KYSE150、KYSE450中的mRNA和蛋白表达。* 与Het-1a相比,P<0.05图2 lnc-POTEG-4和AR在ESCC中表达上调,miR-498表达下调Fig 2 Inc-POTEG-4 and AR were up-regulated in ESCC, and miR-498 was down-regulated
2.3 沉默lnc-POTEG-4诱导Eca109细胞铁死亡
本研究考虑到lnc-POTEG-4在ESCC中高表达,我们将si-lnc-POTEG-4转染Eca109细胞,转染后检测到lnc-POTEG-4的表达显著降低(图3A)。使用CCK-8法评估下调lnc-POTEG-4后Eca109细胞的增殖活力,结果表明si-lnc-POTEG-4较si-NC组显著抑制细胞的活力(图3B)。此外,为了进一步证明铁死亡是否引起Eca109细胞的这种结果,我们用几种细胞死亡抑制剂处理Eca109细胞。如图3C所示,与对照组相比,沉默lnc-POTEG-4或铁死亡诱导剂Erastin处理显著降低Eca109细胞的活力。此外,用铁死亡抑制剂Ferrostatin-1(Fer-1)预处理细胞可消除沉默lnc-POTEG-4诱导的铁死亡,但凋亡抑制剂ZVAD-FMK和坏死抑制剂Necro-sulfonamide(Nec)不起作用。此外,我们评估了铁死亡过程中的两个主要过程,包括脂质过氧化和铁积累,发现沉默lnc-POTEG-4或Erastin处理显著提高了Eca109细胞的MDA和ROS生成水平(图3D、E),并提高了细胞内Fe2+水平(图3F)。综上所述,沉默lnc-POTEG-4对Eca109细胞具有抗增殖作用。
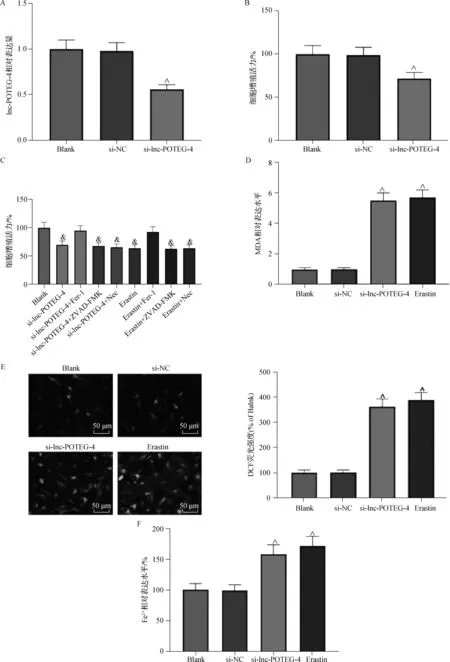
A.qRT-PCR检测lnc-POTEG-4的表达;B、C.CCK-8检测细胞活力;D.MDA水平测定;E.ROS水平测定;F.Fe2+含量测定。 与si-NC细胞相比,P<0.05;& 与Blank组相比,P<0.05图3 沉默lnc-POTEG-4诱导Eca109细胞铁死亡Fig 3 Silencing lnc-POTEG-4 induces ferroptosisin Eca109 cells
2.4 si-lnc-POTEG-4诱导的Eca109细胞铁死亡需要谷氨酰胺代谢的促进
图4A显示了谷氨酰胺代谢在癌细胞脂质过氧化诱导的铁死亡中的调节过程,用谷氨酰胺代谢关键调控基因抑制剂(GPNA和化合物968)处理Eca109细胞,用CCK-8法测定其活力。如图4B所示,si-lnc-POTEG-4显著抑制Eca109细胞的活力,而GPNA或968预处理显著减弱si-lnc-POTEG-4诱导的细胞死亡。为了进一步验证这一假设我们进行了研究,结果表明GPNA和968通过降低细胞内Fe2+水平、MDA生成和ROS水平来减轻si-lnc-POTEG-4诱导的铁死亡(图4C~E)。总之,沉默lnc-POTEG-4通过调节谷氨酰胺代谢诱导Eca109细胞铁死亡。

A.谷氨酰胺代谢在铁死亡中的示意图;B.CCK-8检测细胞活力;C.MDA水平测定;D.ROS水平测定;E.Fe2+含量测定。& 与Blank组相比,P<0.05图4 si-lnc-POTEG-4诱导的Eca109细胞铁死亡需要促进谷氨酰胺的代谢Fig 4 si-lnc-POTEG-4-induced ferroptosis in Eca109 cells requires promotion of glutamine metabolism
2.5 lnc-POTEG-4是miR-498的海绵
lnc-POTEG-4主要存在于细胞质中,表明它能够与miRNA相互作用(图5A)。为了验证lnc-POTEG-4是否能与miR-498结合,进行了双荧光素酶报告实验。我们构建了WT-lnc-POTEG-4和MUT-lnc-POTEG-4,分别与miR-498模拟物和miR-NC共转染Eca109细胞,结果显示,WT-lnc-POTEG-4和miR-498模拟物共转染细胞的荧光素酶活性显著降低(图5B)。qRT-PCR检测转染si-lnc-POTEG-4后细胞miR-498的相对表达量,结果显示,转染si-lnc-POTEG-4的Eca109细胞miR-498的表达明显高于si-NC转染的细胞(图5C)。此外,我们进一步分析得到lnc-POTEG-4和miR-498在ESCC中的表达呈显著负相关(图5D)。这些结果表明lnc-POTEG-4能够充当miR-498的海绵。

A.荧光原位杂交实验结果(×200);B.双荧光素酶报告实验结果;C.qRT-PCR检测miR-498的表达;D.相关性分析结果。 与si-NC组相比,P<0.05图5 lnc-POTEG-4是miR-498的海绵Fig 5 lnc-POTEG-4 is a sponge of miR-498
2.6 抑制miR-498可部分抑制沉默lnc-POTEG-4促进的铁死亡
我们进一步评估lnc-POTEG-4通过调节miR-498在ESCC细胞铁死亡中的作用。用miR-498 inhibitor和si-lnc-POTEG-4共转染细胞,并通过qRT-PCR检测其转染效率(图6A)。miR-498的下调显著抑制si-lnc-POTEG-4对细胞活力的抑制作用(图6B)。此外,miR-498 inhibitor显著降低si-lnc-POTEG-4诱导的ROS水平、MDA产生和细胞内Fe2+水平(图6C-E)。抑制miR-498可部分逆转沉默lnc-POTEG-4诱导的ESCC细胞铁死亡。

A.qRT-PCR检测miR-498的表达;B.CCK-8检测细胞活力;C.MDA水平测定;D.ROS水平测定;E.Fe2+含量测定。与si-NC细胞相比,P<0.05;#与si-lnc-POTEG-4+miR-NC组相比,P<0.05图6 抑制miR-498可部分抑制沉默lnc-POTEG-4促进的ESCC细胞铁死亡Fig 6 Inhibition of miR-498 partially inhibits ferroptosis in ESCC cells promoted by silencing lnc-POTEG-4
2.7 AR作为miR-498的靶点被si-lnc-POTEG-4抑制
为了验证miR-498是否以AR为靶点,我们采用了双荧光素酶报告分析法。结果表明,WT-AR和miR-498模拟物共转染的细胞的荧光素酶活性显著降低(图7A)。用qRT-PCR检测转染si-lnc-POTEG-4和miR-498 inhibitor的细胞中AR的相对表达,结果显示,Eca109细胞中转染si-lnc-POTEG-4细胞的AR表达显著降低,而miR-inhibitor的转染上调了AR的mRNA和蛋白表达水平(图7B~D)。相关性分析表明,AR的表达水平与ESCC组织中的miR-498呈负相关,与lnc-POTEG-4表达呈正相关(图7E、F)。总之,这些结果表明lnc-POTEG-4通过miR-498靶向AR。

A.双荧光素酶报告实验结果;B~D.qRT-PCR和蛋白质印迹法检测AR的mRNA和蛋白表达;E、F.相关性分析结果。 与si-NC组相比,P<0.05;# 与si-lnc-POTEG-4+miR-NC组相比,P<0.05图7 AR作为miR-498的靶点被si-lnc-POTEG-4抑制Fig 7 AR as a target of miR-498 and inhibited by si-lnc-POTEG-4
2.8 过表达AR可部分抑制沉默lnc-POTEG-4促进的铁死亡
我们进一步探讨AR在沉默lnc-POTEG-4诱导的铁死亡中的作用,初步将pcDNA-AR转染Eca109细胞,qRT-PCR检测其转染效率(图8A)。此外,在Eca109细胞中,过表达AR显著抑制了下调lnc-POTEG-4对细胞活力的抑制作用(图8B)。过表达AR可显著降低si-lnc-POTEG-4诱导的ROS水平、MDA产生和细胞内Fe2+水平(图8C-E)。总体而言,沉默lnc-POTEG-4通过抑制Eca109细胞中的AR诱导铁死亡。

A.qRT-PCR检测AR的表达;B.CCK-8检测细胞活力;C.MDA水平测定;D.ROS水平测定;E.Fe2+含量测定。 与si-NC细胞相比,P<0.05;$ 与si-lnc-POTEG-4+pcDNA-NC组相比,P<0.05图8 过表达AR可部分抑制沉默lnc-POTEG-4促进的铁死亡Fig 8 Overexpression of AR partially inhibits ferroptosis promoted by silencing lnc-POTEG-4
3 讨 论
ESCC是常见的胃肠道恶性肿瘤[11]。本研究探讨了lnc-POTEG-4通过调节铁死亡促进ESCC细胞恶性生物学行为的分子机制。lnc-POTEG-4在ESCC组织和细胞中均异常高表达,沉默lnc-POTEG-4可明显诱导Eca109细胞铁死亡,抑制细胞增殖活力。从机制上看,lnc-POTEG-4海绵miR-498上调AR的表达,以抑制ESCC细胞铁死亡,发挥促肿瘤作用。
近年来,越来越多的证据表明,铁死亡在放疗、化疗以及多发性恶性肿瘤的发生发展中起着重要的调节作用,如阿帕替尼通过靶向ELOVL6/ACSL4信号通路促进大肠癌细胞铁死亡[12]。此外,谷氨酰胺分解途径是细胞生长、凋亡、铁死亡、自噬的关键调节因子,抑制谷氨酸代谢能够有效阻断细胞铁死亡进程[13]。
本研究借助GEO数据库并采用limma包进行差异性分析,得到lnc-POTEG-4在ESCC中显著高表达,且在LncRNASNP数据库预测到同样的趋势。有报道[14]发现lnc-POTEG-4在ESCC中异常高表达,但对于其在ESCC中发挥的功能尚未有相关探索。本研究证实了lnc-POTEG-4在ESCC组织和细胞中的表达均显著高于癌旁正常组织和Het-1a细胞,沉默lnc-POTEG-4显著降低Eca109细胞的增殖活力,并能够提高ROS、MDA和细胞内Fe2+水平,以及阻断谷氨酰胺的摄取进而促进脂质过氧化诱导的细胞铁死亡。
越来越多的证据证实,miRNA作为一种新型的调控因子,在包括ESCC在内的多种恶性肿瘤的发生发展中起着重要的作用,同时也证实了癌基因或抑癌基因的作用[15]。此外,一些研究已经探索了miRNA在癌症中的治疗靶点,miRNAs引起的铁死亡已经得到证实,如肿瘤相关成纤维细胞(CAF)通过分泌miR-522靶向ALOX15并阻断ROS积聚来抑制胃癌细胞的铁死亡[16]。以往的研究[17-18]表明,miR-498在ESCC中显著低表达,并对ESCC细胞增殖、克隆和侵袭具有抑制作用。本研究首先验证了miR-498在ESCC中显著低表达,并采用双荧光素酶报告实验验证了miR-498和lnc-POTEG-4的相互作用关系,lnc-POTEG-4能够显著抑制miR-498的表达。敲减miR-498能够部分逆转沉默lnc-POTEG-4降低的Eca109细胞活力,降低ROS、MDA和Fe2+水平,抑制细胞铁死亡。
我们进一步利用TargetScan和miRDB靶向关系与网站筛选得到miR-498的下游靶基因AR。AR在ESCC中的作用已得到初步证实,AR的高表达与ESCC患者总体存活率较低相关,沉默AR能够抑制肿瘤生长[19],AR拮抗剂能够有效诱导前列腺癌细胞铁死亡[20]。姜黄素类似物能够抑制谷胱甘肽过氧化物酶(GPX4)进而诱导胶质母细胞瘤细胞铁死亡,而在GPX4存在的情况下,过表达AR能够防止铁死亡[21]。本研究首先采用双荧光素酶报告实验验证了AR和miR-498的靶向结合关系,其次qRT-PCR法验证了AR在ESCC中为显著高表达,与lnc-POTEG-4在ESCC中的表达呈正相关,与miR-498呈负相关。lnc-POTEG-4可海绵miR-498上调AR的表达。功能性实验结果显示,沉默lnc-POTEG-4能够诱导Eca109细胞铁死亡的发生,而过表达AR能够对这一结果部分逆转。这表明lnc-POTEG-4可能通过上调AR抑制ROS、MDA和Fe2+水平,并阻断谷氨酰胺的代谢来抑制ESCC细胞铁死亡的发生。
综上所述,我们的研究结果证实了lnc-POTEG-4在ESCC的发生发展中起着至关重要的作用。此外,lnc-POTEG-4还通过海绵miR-498上调AR的表达,显著地抑制铁死亡,促进肿瘤进展。这些发现为ESCC的治疗提供了新的靶点。
