系统性红斑狼疮患者血清Th1/Th2 细胞因子及补体C3、C4 的变化
2023-01-07吴伯艳陈建安何永明东莞东华医院广东东莞523110
吴伯艳,陈建安,何永明(东莞东华医院,广东东莞 523110)
系统性红斑狼疮(SLE)是一种常见的慢性系统性自身免疫疾病,以产生多种自身抗体、补体激活和免疫复合物沉积为特征,可引发多个组织和器官损伤[1]。我国SLE 发病率为(30.13~70.41)/10 万,多见于女性,尤其是20~40 岁的育龄期女性[2]。目前SLE 的病因和致病机制仍未完全明确。Th 细胞分为Th1 细胞与Th2 细胞,Th1/Th2 平衡是维持正常免疫功能的重要基础[3]。研究显示,Th1/Th2 细胞因子失衡与SLE 的发生、发展密切相关,以细胞因子为靶点对系统性红斑狼疮进行治疗的方法逐步取得进展,细胞因子在SLE 发病机制及临床中的研究仍是当前热点[4]。亦有研究表明,补体C3、C4 参与SLE 的发生和疾病进展,并在诊断SLE 方面具有一定价值[5]。本研究旨在探讨SLE 患者血清Th1/Th2 细胞因子及补体C3、C4 的变化及意义,以期为SLE 的临床治疗提供依据。
1 资料和方法
1.1 一般资料
选取2019 年12月-2021 年12 月我院门诊或住院的129 例SLE 患者进行研究。所有患者诊断均符合中华医学会风湿病学分会制定的《2020 中国系统性红斑狼疮诊疗指南》[6]中的相关诊断标准,同时排除其他自身免疫性疾病、血液系统疾病及肿瘤相关疾病等,且近期无感染性疾病,未使用糖皮质激素及免疫抑制剂药物等。根据加拿大Toronto 大学制定的SLE 疾病活动度指数(SLEDAI)进行评分,分为活动组(SLEDAI≥10 分)和稳定组(SLEDAI<10 分)。其中稳定组61 例,男6 例,女55 例,年龄14~68 岁,平均(35.2±9.8)岁;活动组68 例,男8 例,女60 例,年龄14~69 岁,平均(36.3±11.4)岁。同时选取本院同期健康体检者70 例为对照组,男7 例,女63 例,年龄22~59 岁,平均(34.1±6.9)岁。各组患者的年龄和性别差异无统计学意义(P>0.05)。
1.2 方法
1.2.1 仪器与试剂 采用美国贝克曼库尔特公司的FC500 MCL 五色流式细胞分析仪检测Th1/Th2 细胞因子的水平。人Th1/Th2 细胞因子检测试剂盒购于杭州赛基生物科技有限公司。补体C3、C4 采用美国贝克曼库尔特IMMAGE800 特定蛋白分析仪及配套试剂进行检测。
1.2.2 方法 所有SLE 患者和对照组均清晨空腹抽取静脉血2 mL,置于红色促凝管中,静置30 min 后,3 500 r/min,离心5 min,分离上层血清,用于Th1/Th2 细胞因子检测及补体C3、C4 检测。采用流式细胞分析仪检测SLE 患者与对照组Th1/Th2 细胞因子(IL-2、IL-4、IL-6、IL-10、TNF-α、IFN-γ)的表达水平;采用速率散射免疫比浊法测定补体C3、C4 水平。上述所有操作步骤均严格按照仪器及试剂盒说明书执行。
1.3 统计学处理
2 结果
2.1 SLE 活动组、稳定组与对照组Th1/Th2 细胞因子及补体C3、C4 水平的比较
SLE 活动组IL-2、IL-4、IL-6、IL-10、TNF-α、IFN-γ 水平明显高于对照组,补体C3、C4 水平低于对照组(P<0.01);SLE 活动组IL-6、IL-10、IFN-γ 水平明显高于SLE 稳定组,补体C3、C4 水平低于SLE 稳定组(P<0.01),IL-2、IL-4、TNF-α 水平与SLE 稳定组比较差异无统计学意义(P>0.05);SLE 稳定组的C3、C4水平明显低于对照组(P<0.01),IL-2、IL-4、IL-6、IL-10、TNF-α、IFN-γ 水平与对照组比较差异无统计学意义(P>0.05)。见表1。
表1 SLE 活动组、稳定组与对照组Th1/Th2 细胞因子及补体C3、C4 水平比较 ()

表1 SLE 活动组、稳定组与对照组Th1/Th2 细胞因子及补体C3、C4 水平比较 ()
与对照组比较:aP<0.01;与SLE 稳定组比较:bP<0.01
2.2 SLE 患者补体C3、C4 水平与Th1/Th2 细胞因子相关性分析
SLE 患者补体C3、C4 水平与IFN-γ 水平以及C4水平与IL-2 水平均呈负相关,差异均有统计学意义(P<0.05 或0.01);补体C3、C4 水平与IL-4、IL-6、IL-10、TNF-α 水平,以及C3 水平与IL-2 水平无相关性(P>0.05)。见表2。
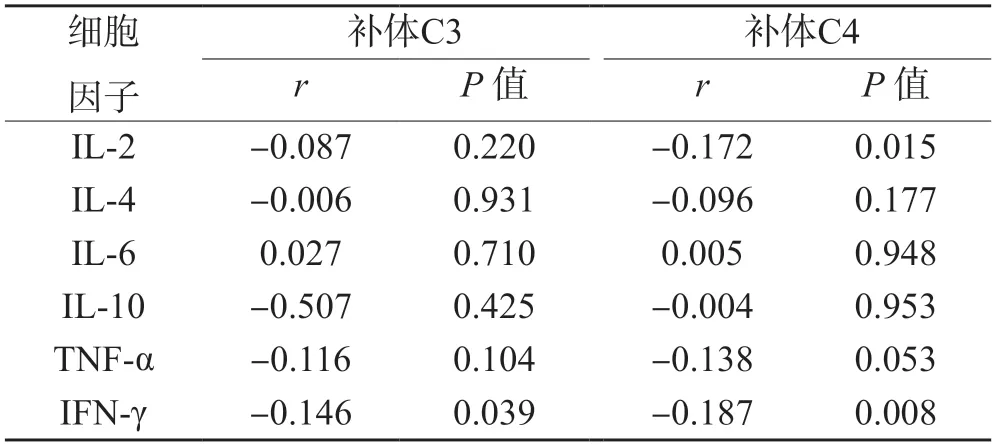
表2 SLE 患者补体C3、C4 水平与Th1/Th2 细胞因子相关性分析 (n=129)
3 讨论
系统性红斑狼疮患者通过产生大量的自身抗体,导致循环免疫复合物形成,激活补体系统,造成多个器官组织损害,严重危害患者的生命健康[7]。目前SLE 的致病机制尚未完全明确,相关研究表明,Th1/Th2 细胞因子失衡及补体C3、C4 水平的异常均参与SLE 的发病机制。
Th1 细胞主要分泌IL-2、TNF-α、IFN-γ 等细胞因子,其关键性转录因子为T-bet,可引发细胞免疫;Th2细胞主要分泌IL-4、IL-6、IL-10 等细胞因子,关键转录因子为STAT6 及GATA,其作用细胞主要为B 细胞,可激活B 细胞及生成抗体,引发体液免疫[8]。正常时Th1/Th2 处于动态平衡,而在SLE 的发生、发展中,Th1/Th2 失衡起到了重要作用,不同时期,Th1、Th2 优势各不相同[9]。
在Th1 型细胞因子中,IL-2 是淋巴细胞生长分化过程中的重要调节因子,可以诱导TNF-α、IFN-γ 等细胞因子的产生。TNF-α 和IFN-γ 是促炎细胞因子,在机体发生感染时,其水平明显升高,诱导急性全身炎症反应,从而引起机体各组织器官损伤。在Th2 型细胞因子中,IL-4 和IL-10 是抗炎细胞因子,可通过抑制TNF-α等促炎细胞因子的分泌,发挥其抗炎作用。IL-6 是由单核细胞产生的促炎细胞因子,通过激活B 细胞,诱导自身抗体产生,从而参与机体免疫反应[10-12]。本研究发现,SLE 活动组IL-2、IL-4、IL-6、IL-10、TNF-α、IFN-γ 水平明显高于对照组;活动组IL-6、IL-10、IFN-γ 水平明显高于稳定组,差异有统计学意义(P<0.01)。Th1/Th2 细胞因子均高水平表达,提示SLE 患者促炎反应和抗炎反应同时存在,并相互促进。Th1/Th2 细胞因子紊乱在SLE 疾病的发生、发展中起着重要作用。SLE 活动期IL-6、IL-10、IFN-γ 水平明显增高,有望成为SLE 病情活动度的监测指标。
补体是机体参与免疫反应的重要环节。张舒等[13]研究发现SLE 患者体内存在补体C3、C4 水平的下降,并且下降的程度与疾病病情活动程度相关。本研究发现,SLE 患者补体C3、C4 水平明显低于健康者,补体C3、C4与IFN-γ 水平以及C4 与IL-2 水平呈负相关(P<0.05 或0.01),补体C3、C4 水平在SLE 患者疾病活动期明显降低,提示SLE 患者体内存在补体成分消耗现象,这与梁鑫等[14-15]的研究结果一致。其相关机制可能是:SLE 疾病进程中产生大量免疫复合物沉积到组织器官中,通过激活补体介导的经典和旁路途径清除免疫复合物,进而消耗大量的补体C3 和C4,导致其水平降低[16-17]。
综上所述,Th1/Th2 细胞因子紊乱及补体C3、C4水平的异常与SLE 的发生、发展密切相关;IL-6、IL-10、IFN-γ 及补体C3、C4 水平,还与SLE 活动度有关,可作为判断SLE 病情活动度指标。
