血浆(1,3)-β-D葡聚糖水平对艾滋病患者合并肺孢子菌肺炎诊断及预后的临床价值
2023-01-06兰慧慧陈涛蒋忠胜李敏基覃锦玉莫胜林蒙达礼唐贵
兰慧慧 陈涛 蒋忠胜 李敏基 覃锦玉 莫胜林 蒙达礼 唐贵
(1.广西壮族自治区胸科医院呼吸内科,柳州 545005;2.广西柳州市人民医院感染病科,柳州 545004)
肺孢子菌肺炎(Pneumocystispneumonia,PCP)是艾滋病(acquired immune deficiency syndrome,AIDS)患者晚期常见的指征性疾病之一,其病情进展快,死亡率高达20%~40%,其中一部分患者死亡是由于未得到及时诊断而治疗所致[1-2]。临床上诊断PCP的主要方法包括有病原学检测、分子学诊断和免疫学诊断[3]。其中,病原学检测常是通过支气管镜行肺泡灌洗或肺活检找病原体,但常因患者的耐受性差及检测方法的创伤性所限制而导致诊断不及时。免疫学诊断具有简单、易行、快速、无创伤性等优点,常应用于临床[4]。PCP病原体为耶氏肺孢子菌(Pneumocystisjiroveci,PJ),其细胞壁上富含(1,3)-β-D葡聚糖,当PJ侵入人体肺部组织后,经吞噬细胞吞噬处理后,(1,3)-β-D葡聚糖可从胞壁中释放出来,在血液中含量增高。有报道表明,血浆(1,3)-β-D 葡聚糖水平测定(G试验)对PCP的诊断及预测预后有一定的意义[5-7]。故本文旨在探讨血浆(1,3)-β-D葡聚糖水平在AIDS合并PCP患者中的诊断及预测预后中的价值。
1 对象与方法
1.1 对象
采用回顾性研究方法,选取广西柳州市人民医院2012年1月—2021年1月收治的有(1,3)-β-D葡聚糖结果同时符合以下条件的AIDS合并PCP患者作为观察组。该组患者入选条件:AIDS诊断符合《中国艾滋病诊疗指南(2018版)》标准[8]。PCP诊断标准[8]为:①起病隐匿或亚急性,干咳,气短和活动后加重,可有发热、发绀,严重者发生呼吸窘迫。②肺部阳性体征少,或可闻及少量散在的干湿啰音。体征与疾病症状的严重程度往往不成比例。③胸部X线或CT检查可见双肺从肺门开始的弥漫性网状结节样间质浸润,有时呈磨玻璃状阴影。④血气分析示低氧血症。⑤ 血乳酸脱氢酶常升高。⑥确诊依靠病原学检查,如痰液或支气管肺泡灌洗/肺组织活检等,发现肺孢子菌的包囊或滋养体。排除条件:①合并肿瘤性疾病;②合并严重心、肝、肾、脑、肺部疾患;③哺乳或者妊娠期妇女;④合并马尔尼菲篮状菌感染、隐球菌感染、曲霉感染、念珠菌感染等机会性感染;⑤资料不全者。
观察组患者根据临床预后情况,进一步分为好转组与死亡组。临床预后判断标准:①好转:临床症状及生化指标改善,肺CT病灶较前吸收好转;②死亡:临床症状及生化指标加重,肺CT病灶较前进展;经治疗无效临床死亡。
根据观察组与对照组人数配比1∶1原则,选取同期有 (1,3)-β-D葡聚糖结果的无机会性感染的HIV感染者作为对照组。该组患者入选条件:参照《中国艾滋病诊疗指南(2018版)》诊断标准[8],所有病例均确诊为 HIV 感染。排除条件:①合并肿瘤性疾病;②合并严重心、肝、肾、脑、肺部疾患;③哺乳或者妊娠期妇女;④合并各种机会性感染;⑤资料不全者。
本研究由柳州市人民医院伦理委员会批准(伦理批号:KY-E-22-01)。
1.2 方法
收集观察组及对照组患者治疗基线时(入组但未开始治疗时)的 (1,3)-β-D葡聚糖结果。另收集好转组患者治疗后第4周及死亡组患者死亡时的(1,3)-β-D葡聚糖结果。 (1,3)-β-D葡聚糖检测:采集患者静脉血液4 mL, 3 000 r/min离心10~15 min,取上清0.1 mL,加入0.9 mL的样品处理液中,混匀后70℃孵育10 min,取出后立刻放入冷却槽中冷却5 min,即为待测血浆样品。待测血浆样品0.2 mL直接加入酶反应主剂中,溶解后移液至标准无热原平底试管中,插入MB-80微生物快速动态检测系统中进行反应,反应结束后检测系统自动计算待测血浆中(1,3)-β-D葡聚糖含量。根据北京金山川科技发展有限公司提供的(1,3)-β-D葡聚糖试剂说明书,(1,3)-β-D葡聚糖浓度>60 pg/mL时,判定为阳性。
1.3 统计学分析
应用SPSS 19.0软件进行统计学分析。各组(1,3)-β-D葡聚糖水平均为非正态分布计量资料,以[M(P25,P75)]表示,观察组与对照组、好转组(基线)与死亡组(基线)、好转组(基线)与治疗后(4周)、及死亡组(基线)与治疗后(死亡时)间(1,3)-β-D葡聚糖水平的比较,采用Mann-Whitney U检验,(1,3)-β-D葡聚糖阳性率的比较,采用χ2检验。应用ROC曲线下面积(AUC)评估(1,3)-β-D葡聚糖水平对PCP的诊断及预后的价值,以P<0.05为差异有统计学意义。
2 结 果
2.1 一般情况
广西柳州市人民医院2012年1月—2021年1月共收治了55例符合入选条件及排除条件标准的AIDS合并PCP患者作为观察组,其中男34例,女21例,年龄1~83岁,平均年龄(57.09±18.05)岁。55例对照组患者,男42例,女13例,年龄31~79岁,平均年龄(57.29±13.32)岁;两组性别及年龄比较,差异无统计学意义(t=0.066,χ2=2.086,P>0.05)。观察组患者根据临床预后情况分为好转组和死亡组。好转组31例,其中男22例,女9例,年龄25~83岁,平均年龄(59.10±15.61)岁;死亡组24例,其中男12例,女12例,年龄1~75岁,平均年龄(54.50±20.86)岁;两组性别及年龄比较,差异无统计学意义(t=0.935,χ2=2.520,P>0.05)。
2.2 (1,3)-β-D葡聚糖关于PCP诊断及预后方面的分析
观察组(1,3)-β-D葡聚糖水平及阳性率高于对照组,差异均有统计学意义(P<0.05)。死亡组(基线)与好转组(基线)比较:死亡组(1,3)-β-D葡聚糖水平高于好转组,差异有统计学意义(P<0.05),(1,3)-β-D葡聚糖阳性率两组差异无统计学意义(P>0.05),见表1。好转组治疗后4周(1,3)-β-D葡聚糖水平及阳性率低于基线时,差异均有统计学意义(P<0.05);死亡组死亡时(1,3)-β-D葡聚糖水平高于基线时,(1,3)-β-D葡聚糖阳性率差异无统计学意义(P<0.05),见表2。
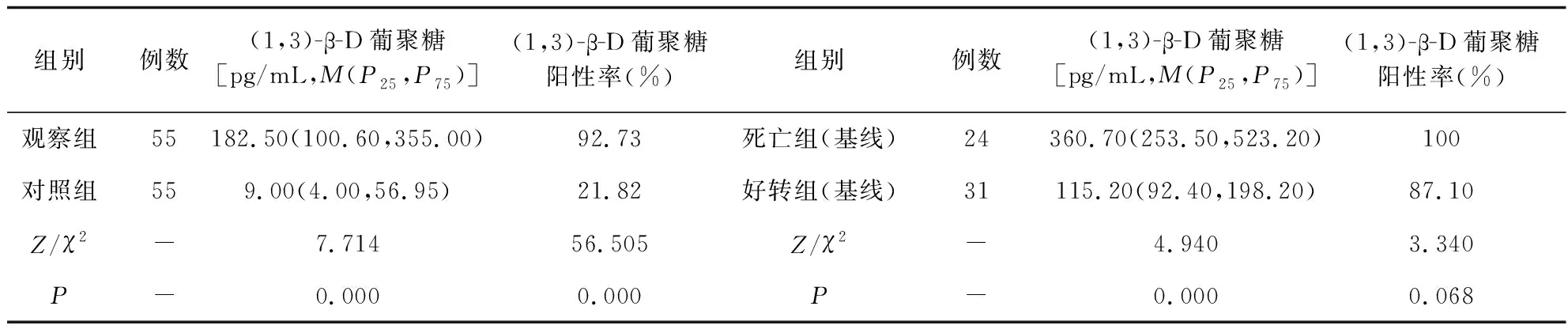
表1 (1,3)-β-D葡聚糖关于PCP诊断及预后方面的分析Tab.1 Analysis of (1,3) -β-D-glucan in the diagnosis and prognosis of PCP
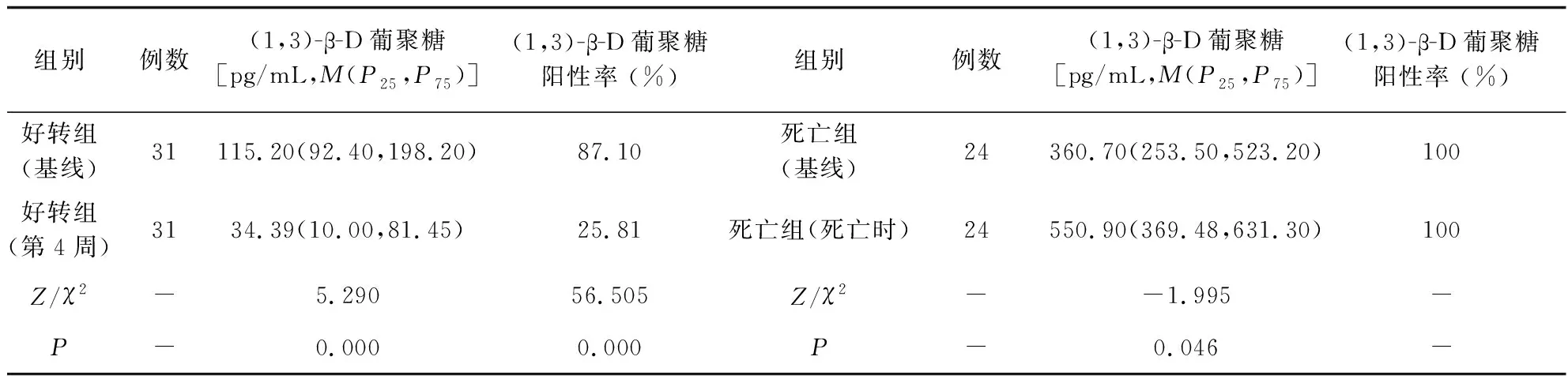
表2 (1,3)-β-D葡聚糖关于PCP病情变化方面的分析Tab.2 Analysis of (1,3)-β -D glucan on disease outcomes of PCP
2.3 (1,3)-β-D葡聚糖诊断PCP及预测预后的ROC曲线
ROC曲线分析结果显示:血浆(1,3)-β-D葡聚糖诊断PCP的ROC曲线下面积(AUC)为 0.926(P=0.000),95%CI0.877~0.975,最佳诊断阈值为77.65 pg/mL,其敏感度、特异性及Youden指数分别为89.1%、87.3%和0.764,见图1。血浆(1,3)-β-D葡聚糖预测PCP预后的ROC曲线下面积(AUC)为 0.891(P=0.000),95%CI0.796~0.987,最佳诊断值为247.95 pg/mL,其敏感度、特异性及Youden指数分别为 79.2%、93.5%和0.727,见图2。
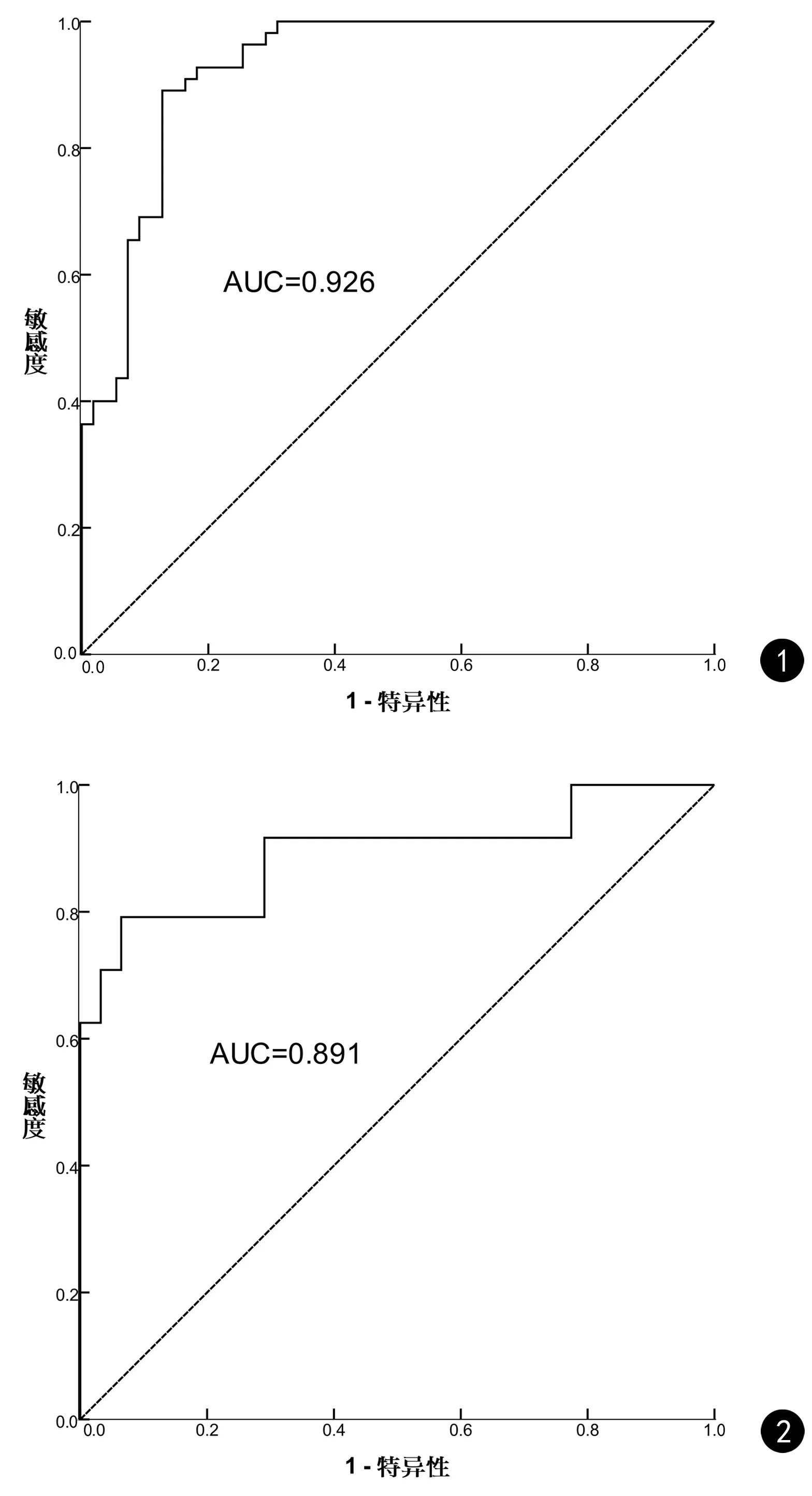
图1 (1,3)-β-D葡聚糖诊断PCP的ROC曲线 图2 (1,3)-β-D葡聚糖预测PCP预后的ROC曲线Fig.1 ROC curves of (1,3)-β-D-glucan in diagnosis of PCP Fig.2 ROC curves of (1,3) -β-D-glucan for predicting the prognosis of PCP
2.4 (1,3)-β-D葡聚糖与PCP诊断及预后的评价
诊断的评价:当(1,3)-β-D葡聚糖≥77.65 pg/mL时诊断为PCP,将根据最佳诊断条件所评判的结果与患者实际诊断情况进行比较,其诊断PCP的敏感度为89.09%,特异度为87.27%,阳性预测值(PPV)= 87.50%,阴性预测值(NPV)=88.89%,见表3。预后的评价:当(1,3)-β-D葡聚糖≥247.95 pg/mL时预测为死亡,(1,3)-β-D葡聚糖<247.95 pg/mL时预测为好转,将根据最佳预测条件所评判的结果与患者实际预后情况进行比较,其预测PCP预后的敏感度为79.17%,特异度为93.55%,PPV= 90.48%,NPV=85.29%,见表3。

表3 (1,3)-β-D葡聚糖判断PCP诊断及预后的评判结果与实际情况Tab.3 (1,3)-β-D-glucan to evaluate the results and actual situation about the diagnosis and prognosis of PCP
3 讨 论
PJ为条件致病菌,其在正常人呼吸道中多以定植形式存在。因AIDS患者存在不同程度免疫功能缺陷,PJ可通过菌体表面糖蛋白黏附于宿主细胞并逃避免疫清除,进而引起宿主炎症反应及肺部感染的发生[9],与此同时,菌体细胞壁主要成分之一的(1,3)-β-D葡聚糖释放入血[7,10]。
Desmet等[11]通过分析28例PCP患者和28例对照组者的G试验结果发现:当G试验≥100 pg/mL时,诊断PCP的敏感性和特异性分别为100%和96.4%。Salerno等[12]通过回顾性队列研究发现当G试验截断值为300 pg/mL时,诊断PCP的敏感性、特异性、PPV和NPV分别为91%、92%、89%和93%。Sax等[13]通过对173例PCP患者和79例对照者分析发现:以G试验≥80 pg/mL的结果对诊断PCP的敏感性、特异性、PPV和NPV分别为92%、65%、85%和80%。另有若干研究表明,不同水平的血浆(1,3)-β-D葡聚糖截断值用于诊断PCP的特异度波动于83%~100%,敏感度波动于70%~100%[5,14-15]。本文结果表明,当G试验截断值为77.65 pg/mL时,诊断PCP的敏感度、特异度、PPV及NPV分别为89.09%、87.27%、87.50%和88.89%,与上述有关文献报道类似;且本文ROC曲线下面积为0.926,提示在AIDS患者中,(1,3)-β-D葡聚糖水平在诊断PCP方面具有较好的应用价值。需注意的是,G试验存在一定假阴性及假阳性情况[13],使用血清白蛋白、磺胺类药物、标本污染等因素可导致G试验假阳性[16],本文对照组G试验假阳性率21.82%,考虑原因为部分患者因CD4细胞计数低下住院期间预防性使用磺胺类药物及因营养不良使用血清白蛋白所致。本文观察组G试验假阴性率7.27%,考虑可能原因可能为此部分患者感染程度轻,导致(1,3)-β-D葡聚糖释放入血少以及检验标本未及时送检所致[17]。以上分析可以看出G试验在诊断PCP方面具有较好的临床价值,但因假阴性等因素的存在,故建议多次测量以及综合患者影像学等临床资料,以便能更加准确诊断PCP。
在 G 试验对 PCP 诊断的研究基础上,学者们亦进一步探索了其对 PCP 患者临床预后的判断价值。研究表明,PCP 患者 G 试验水平与肺泡灌洗PJ菌体载量呈正相关[18],并且与血清中PJ DNA浓度呈正相关,与 PCR CT值呈负相关[19],提示血液中(1,3)-β-D葡聚糖水平在一定程度可以反映患者的感染及病情严重程度。一项回顾性研究发现,存活患者血浆(1,3)-β-D葡聚糖水平较死亡患者低[20]。Matsumura等[21]研究表明G试验水平与PCP患者30 d死亡率有着密切关系。并且在治疗过程中,G试验水平的下降,往往预示着良好的临床预后[7,21-22]。本研究结果表明,当G试验截断值为247.95 pg/mL时,其预测PCP预后的敏感度、特异度、PPV及NPV分别为79.17%、93.55%、90.48%和85.29%,且ROC曲线下面积为0.891;此外观察到,随着好转组患者病情的好转及死亡组患者病情的恶化,(1,3)-β-D葡聚糖水平分别呈现下降及升高的表现,提示(1,3)-β-D葡聚糖水平及变化情况在预测PCP临床预后及评估病情变化方面具有较好的价值,与上述有关文献报道类似。
综上分析,血浆(1,3)-β-D葡聚糖水平检测作为一种非创伤性检验方法,可在早期有效地辅助诊断PCP,并且其在预测患者预后及评估病情变化方面具有较好的临床价值。但在临床应用当中,需注意排除假阴性及假阳性等因素干扰,结合患者的相关临床资料进行综合判断。
