病原真菌real-time PCR检测对非中性粒细胞缺乏的老年患者肺部真菌病的诊断价值
2023-01-06蒙星烨刘晓万喆陈伟阙呈立林连君余进宋营改李若瑜
蒙星烨 刘晓 万喆 陈伟 阙呈立 林连君 余进 宋营改 李若瑜
(1.北京大学第一医院皮肤性病科,北京大学真菌和真菌病研究中心,国家皮肤与免疫疾病临床医学研究中心,皮肤病分子诊断北京市重点实验室,北京 100034;2.北京大学第一医院呼吸内科,北京 100034;3.北京大学第一医院老年病内科,北京 100034)
近年来,肺部真菌病的发病率逐渐增加[1-3]。高龄是真菌感染明确的高危因素[4-5],老年患者肺部真菌感染已成为重大的卫生健康问题。研究发现侵袭性真菌病越来越多地影响到非中性粒细胞缺乏人群,包括慢性阻塞性肺疾病[6]、重症流感[7]、控制不佳的糖尿病[8]和自身免疫性疾病患者[9]。肺部真菌病的早期诊断,尤其是准确识别致病真菌,对于早期治疗和改善预后至关重要[10]。然而,在非中性粒细胞缺乏患者中,肺部真菌病的临床表现与其他感染性肺炎相似,影像学表现往往不具有特异性[11],血清半乳甘露聚糖(galactomannan, GM)试验灵敏度低[4,12],传统方法难以精准快速诊断。既往研究表明,分子生物学方法在侵袭性真菌病中具有较好应用前景[13],多项研究证实了聚合酶链反应(polymerase chain reaction, PCR)在免疫功能抑制人群中对曲霉、毛霉和肺孢子菌感染具有良好的诊断性能[14],并且支气管肺泡灌洗液(bronchoalveolar lavage fluid, BALF)标本检测的灵敏度高于血液[15-16]。目前在BALF中研究的PCR方法通常仅聚焦于一种致病真菌。随着合并多种真菌感染日益增多,目前仍缺乏灵敏、快速鉴定真菌种类、更加全面的肺部真菌疾病的诊断系统。
本研究团队前期设计了病原真菌real-time PCR检测系统,针对肺部常见真菌病原体[1],包括曲霉、毛霉、隐球菌和耶氏肺孢子菌。前期已在菌株水平上对相应方法进行验证,结果显示灵敏度高,菌种间无交叉反应,但尚未在怀疑肺部感染患者的BALF标本中进行验证。本研究目的是在非中性粒细胞缺乏老年人群BALF标本中评估病原真菌real-time PCR方法对肺部真菌疾病的诊断价值。
1 材料和方法
1.1 研究对象
本研究回顾性地收集北京大学第一医院2021年5月至2022年5月之间怀疑肺部感染的老年患者的BALF标本,对送检真菌学检查(GM试验、真菌镜检和培养)的剩余标本进行病原真菌real-time PCR检测。纳入标准:①年龄≥60岁的住院患者;②外周血中性粒细胞计数>0.5×109/L;③根据临床表现和影像学表现怀疑肺部感染。排除标准:既往诊断肺部真菌病。收集患者的基础疾病、危险因素、临床症状、影像学和病原学检查结果,用于诊断的分类,以上结果从常规临床实践中获得。本研究经过北京大学第一医院伦理委员会批准(2021研010)。
1.2 诊断标准
对于侵袭性真菌病,根据欧洲癌症研究和治疗组织和真菌病研究组(EORTC/MSG)及其重症监护室研究组的定义[11,17]对肺部侵袭性真菌疾病进行分类。确诊及临床诊断的病例作为肺部侵袭性真菌病阳性组,排除侵袭性真菌病的患者作为阴性组,疑诊病例不纳入诊断的评估。因为本研究涉及BALF标本PCR和GM试验诊断性能的评估,为了避免加和偏倚,排除BALF标本曲霉和肺孢子菌PCR、GM试验阳性作为诊断的证据。对慢性肺曲霉病,结合临床症状、影像学表现和曲霉抗体进行诊断[18]。
1.3 BALF标本DNA提取
取BALF标本1.5 mL离心后提取DNA,血性BALF采用QIAamp UCP病原体纯化mini试剂盒(QIAGEN GmbH,德国),洗脱缓冲液的体积为80 μL;非血性BALF采用真菌DNA核酸提取试剂盒IN-5-002(国为利君生物科技,北京)提取,最终得到80~100 μL标本DNA。
1.4 病原真菌real-time PCR
本研究采用前期设计的病原真菌real-time PCR检测体系,包括针对曲霉属及5种常见的曲霉物种(烟曲霉、黄曲霉、土曲霉、黑曲霉、构巢曲霉)、毛霉目、隐球菌属和耶氏肺孢子菌的引物和探针。目前已获得专利授权(ZL202110452771.4)。引物探针由北京天一辉远生物科技有限公司合成。采用ABI Vii7 real time PCR仪(ABI,美国),反应体系:上游引物(10 μmol/L)0.4 μL,下游引物(10 μmol/L)0.4 μL,探针(10 μmol/L)0.4 μL,2×PerfectStart II Probe SuperMix 10 μL,Passive Reference Dye II 0.4 μL,模板DNA 2 μL,去离子水6.4 μL。反应程序:50℃ 2 min;95℃ 10 min;95℃ 15 s,60℃ 1 min×40个循环[19]。每次反应设置阳性对照(曲霉菌株DNA)和空白对照(去离子水)。结果读取循环阈值(cycle threshold, Ct值)。
1.5 统计
连续变量采用Mann-Whitney U检验,分类变量采用χ2检验进行显著性检验。通过受试者工作特征(receiver operating characteristic, ROC)曲线分析评价试验的诊断价值。计算灵敏度、特异度、阳性预测值和阴性预测值。P<0.05有统计学意义。采用SPSS 26.0软件进行数据处理。采用GraphPad Prism 7软件进行绘图。
2 结 果
2.1 入选患者及标本
在研究期间收集了来自296名非中性粒细胞缺乏老年患者的345份支气管肺泡灌洗液。排除既往诊断肺部真菌疾病2名患者。8名患者在研究期间诊断肺部真菌疾病,排除在诊断后多次送检的18份BALF(见图1)。共纳入来自294名患者的325份BALF。13名患者曾进行2~3次支气管镜检查,17名患者在同一次支气管镜检查中送检2份来自不同部位的BALF 标本。

图1 患者及BALF标本筛选分类流程图Fig.1 Flow chart of the inclusion and classification of patients and bronchoalveolar lavage fluids
2.2 人口学特征
患者年龄分布在60~91岁,中位年龄69岁,183名(61.8%)男性,重症监护室住院患者共71名(24.3%),11.5%患者接受预防性抗真菌治疗(见表1)。
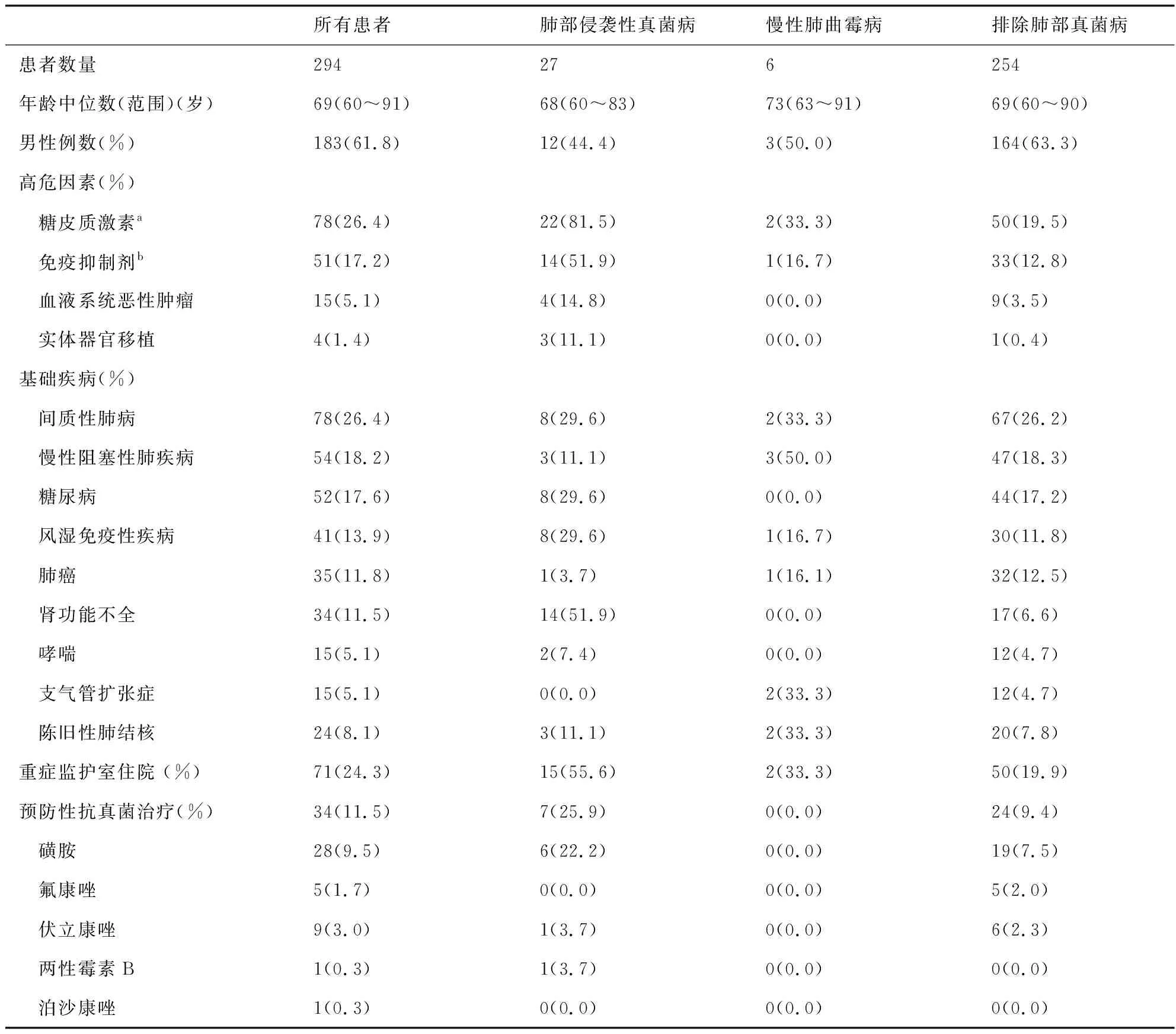
表1 患者临床特点Tab.1 The clinical characteristics of patients
2.3 肺部真菌疾病分布
共27名(9.2%)患者符合确诊或临床诊断的肺部侵袭性真菌病(BALFn=31),诊断分类见图2,其中7名(25.9%)患者多种真菌合并感染。另外,6名(2.0%)患者符合慢性肺曲霉病(chronic pulmonary aspergillosis, CPA)诊断(BALFn=6),4例肺曲霉球和2例慢性空洞性肺曲霉病。
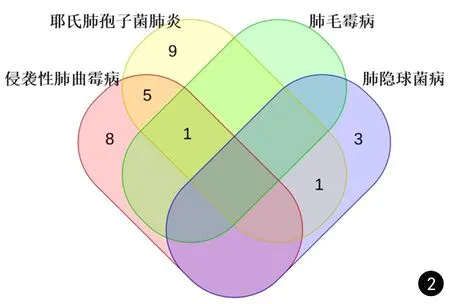
图2 肺部侵袭性真菌病的诊断分类及患者数量,重叠部分代表多种真菌合并感染Fig.2 The classification of pulmonary invasive fungal diseases and the number of patients, the overlap represents multiple fungal infections
2.4 BALF真菌学检查结果
在侵袭性肺曲霉病(invasive pulmonary aspergillosis, IPA)、CPA和排除肺曲霉病三组患者中(BALFn=17/6/292),分别有17、6和254份BALF标本进行真菌镜检和培养,所有标本进行了GM试验和病原真菌real-time PCR检测;在三组BALF中,真菌镜检观察到菌丝分别占29.4%、33.3%和0.0%,真菌培养得到曲霉分别占90.9%、50.0%和2.0%。IPA患者BALF标本GM 光密度指数(optical density index, ODI)显著高于排除肺曲霉病患者(中位数分别为1.4vs.0.2,P<0.0001)。
2.5 曲霉PCR和GM试验的诊断价值
曲霉PCR在肺曲霉病(IPA和CPA)患者的23份BALF标本中均有扩增曲线,在排除肺曲霉病组292份BALF标本中,250份(85.6%)有扩增曲线。IPA患者BALF的曲霉PCR Ct值显著低于排除肺曲霉病患者(中位数分别为31.9vs.37.6,P<0.001)。对于肺曲霉病,曲霉PCR Ct值和GM试验 ODI的ROC曲线下面积分别为0.936和0.850,无显著性差异(95%置信区间分别为0.865~1.000和0.763~0.936,P=0.144,见图3);两者最佳cut-off值分别为34.8和0.6,对于肺曲霉病诊断的灵敏度、特异度分别为95.7%/92.1%和82.6%/80.8%(见表2);GM试验和曲霉PCR同时阳性时,特异度(97.9%)和阳性预测值(75.0%)最高,GM试验和曲霉PCR其中之一阳性时,灵敏度(100%)和阴性预测值(100%)最高(见表2)。
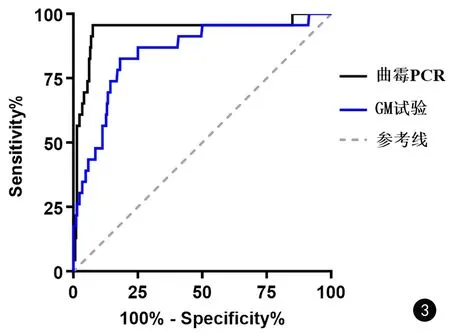
图3 BALF曲霉PCR Ct值和GM试验ODI对肺曲霉病的诊断的受试者工作特征曲线,以(40-Ct值)绘制,对于曲霉PCR阴性的患者,将其Ct值设置为40Fig.3 The ROC curve of Aspergillus PCR cycle threshold and GM ODI in bronchoalveolar lavage fluid for the diagnosis of aspergillosis, which was drawn with (40-cycle threshold). For the patients with negative Aspergillus PCR, set the cycle threshold as 40

表2 曲霉PCR和GM试验对肺曲霉病的诊断价值Tab.2 The diagnostic value of Aspergillus PCR and GM test for aspergillosis
曲霉种水平PCR检出最多的是烟曲霉,在IPA、CPA及排除肺曲霉病组中,分别有9例(53.0%)、4例(66.7%)、13例(4.4%)为阳性。在17例烟曲霉培养阳性的BALF中,12例烟曲霉PCR阳性。在3例黄曲霉培养阳性的BALF中,1例黄曲霉PCR阳性。在2例黑曲霉培养阳性的标本中,1例黑曲霉PCR阳性。在曲霉培养阳性的标本中,曲霉种水平PCR与培养结果的一致率为63.6%(14/22)。在曲霉培养阴性的BALF中,91.8%(213/232)曲霉种水平PCR阴性。
2.6 耶氏肺孢子菌、隐球菌和毛霉PCR
耶氏肺孢子菌PCR在耶氏肺孢子菌肺炎(Pneumocystisjiroveciipneumonia, PJP)患者的19份 BALF标本中,18份阳性(Ct值中位数33.9,26.5~37.1),在排除PJP组的296份BALF标本中,4份阳性(Ct值中位数37.9,36.9~39.0)。耶氏肺孢子菌PCR Ct值≤37.1作为阳性阈值,对于PJP的灵敏度、特异度、阳性预测值和阴性预测值分别为94.7%、99.7%、94.7%和100%。隐球菌PCR在肺隐球菌病组的4例BALF中2例阳性(Ct值为29.1和33.8)。毛霉PCR在1例肺毛霉病患者的BALF中为阳性(Ct值30.1)。考虑到肺隐球菌病和肺毛霉病的患者数量少,无法评估最佳的cut-off值,隐球菌和毛霉PCR取Ct值≤35.0作为阳性,在肺隐球菌病和肺毛霉病中阳性率分别为50%(2/4)和100%(1/1),在排除两者的BALF标本中阴性率为100%(311/311)和98.7%(310/314)。
2.7 病原真菌real-time PCR的诊断价值
曲霉属/毛霉/隐球菌/耶氏肺孢子菌PCR Ct值分别以34.8/35.0/35.0/37.1作为cut-off值,在不同诊断的患者中病原真菌real-time PCR检测结果见表3。以PCR检出的病原真菌与肺部真菌病的致病真菌一致作为阳性,病原真菌real-time PCR对肺部真菌病诊断的灵敏度、特异度、阳性预测值和阴性预测值分别为86.5%(32/37)、91.0%(253/278)、56.1%(32/57)和98.1%(253/258),总体符合率为90.5%(285/315)(见表2)。排除3例抗真菌药物预防性治疗的肺真菌病患者(1例IPA患者接受过伏立康唑和两性霉素B治疗,2例PJP患者接受过磺胺治疗),灵敏度为91.2%(31/34)。

表3 以患者诊断分类的病原真菌real-time PCR检测结果,阳性阈值:曲霉Ct值≤34.8,毛霉Ct值≤35.0,隐球菌Ct值≤35.0,肺孢子菌Ct值≤37.1Tab.3 The results of the real-time PCR of fungal pathogens in different classifications of patients. Positive threshold (cycle threshold of PCR): Aspergillus≤34.8, Mucorales≤35.0, Cryptococcus≤35.0 and Pneumocystis jirovecii≤37.1
3 讨 论
本研究探索了自行设计的病原真菌real-time PCR在非中性粒细胞缺乏老年患者中的诊断价值,证实此方法覆盖了常见的肺部致病真菌,为肺部真菌病提供了一种相对灵敏、快速、全面的病原真菌诊断方法,尤其在多种真菌合并感染中灵敏度达到100%(9/9),具有独特的优势。近年来,随着分子生物学的广泛研究和PCR检测方法标准化,已将血液和BALF标本的曲霉PCR以及呼吸道标本耶氏肺孢子菌PCR检测阳性结果纳入最新的侵袭真菌病的定义中[11],尽管没有推荐的诊断阈值,此外,目前缺乏在非重度免疫抑制或非中性粒细胞缺乏患者中的研究[17]。本研究初步探索了怀疑肺部感染的“非粒缺”老年患者BALF标本中曲霉和耶氏肺孢子菌PCR的cut-off值,对肺曲霉病和PJP诊断的灵敏度和特异度均超过90%,与以往在免疫功能低下的患者中的研究结果相似[14]。但是本研究中曲霉PCR的特异度(92.1%)低于部分已有的报道[20],后者为免疫功能低下患者的研究,特异度通常达到95%以上。可能的原因是本研究纳入了一部分非严重免疫功能抑制的患者,呼吸道一过性的存在非致病性曲霉。对于非免疫抑制的人群BALF中真菌菌群的研究显示,尽管曲霉并非呼吸道定植的核心菌落,仍在一部分BALF中培养分离得到[21]。因此在曲霉PCR出现阳性结果时,应该结合患者的免疫状态、影像学和其他真菌学检查综合判断,本研究结果显示曲霉PCR结合GM试验≥0.6,其特异度(97.9%)和阳性预测值(75.0%)提高。GM试验和PCR联合诊断具有更好的表现,与以往研究一致[15-16],可能是由于两者分别检测曲霉的细胞壁成分和曲霉DNA,因此有相互补充的可能。本研究中抗真菌治疗有降低PCR检测灵敏度的趋势,在3例既往接受过抗真菌治疗的肺部真菌病患者中2例PCR检测为假阴性,未来仍需扩大标本量进一步验证。但也有报道称,BALF标本曲霉PCR检测在经过和未经过抗真菌治疗的患者中灵敏度无统计学差异[16,22]。本研究中隐球菌PCR的阳性率较低(50%,2/4),可能是由于DNA提取失败所致,因此对怀疑隐球菌感染的患者,应该延长破壁的时间,提高DNA产量。
本研究的诊断参考标准是EORTC/MSG的确诊和临床诊断标准[11,17],以及慢性肺曲霉病诊疗指南[18],依据临床信息,对每个患者单独进行诊断分类。根据临床实践常规进行病原学送检,并非所有患者进行了全面的真菌学检查,因此侵袭性和非侵袭的肺真菌病可能被低估。而且,为了评估BALF GM试验,排除此方法作为真菌学证据,可能导致真菌镜检和培养灵敏度的高估。未来需要开展前瞻性的研究进一步证实培养和非培养真菌学检查的诊断价值,尤其在非中性粒细胞缺乏患者中。
本研究存在一些局限性,首先是利用临床传统真菌学检查的剩余标本而不是单独保存的标本,可能存在污染。此外,本研究中隐球菌病和毛霉病例较少,对毛霉和隐球菌PCR的cut-off值无法进行准确评估。综上所述,本研究团队开发的病原真菌real-time PCR检测覆盖了常见的肺部致病真菌,与诊断的符合率达到90%,在多种真菌合并感染的快速诊断方面具有优势。在曲霉、毛霉和耶氏肺孢子菌的感染方面,灵敏度和特异度均较高,具有区分致病和非致病真菌(污染、定植等)的潜力,值得在临床上进一步应用推广。
