改性TiO2光催化剂的制备及其光催化性能研究
2023-01-06王香婷王思哲曹宝月
王香婷,王思哲,曹宝月,胡 奋
(商洛学院 化学工程与现代材料学院 陕西省尾矿资源综合利用重点实验室,陕西 商洛 726000)
自从1972年Fujishima A和Honda K[1]发现TiO2具有光催化降解水的能力以来,TiO2成为近几十年来备受关注的光催化剂,成本低、无毒无害、化学性质稳定等优点,使其成为环境污染治理领域中应用最广的催化剂之一[2]。但TiO2的禁带宽度较大(3.0~3.2)eV,光生电子和空穴易复合,量子效率差,需要在紫外光照射下才能发生光催化反应等缺点限制了其在太阳光催化领域的发展。为了解决这一问题,学者们通过光沉积、掺入共催化剂、掺杂和构建异质结等对TiO2进行改性[3-6],从而使其在可见光范围内具有较高的光催化活性。涂盛辉等[7]采用化学还原法,选商用的P25制备了双金属纳米Ag/Cu@P25复合催化剂。研究表明,该催化剂相比单金属负载和纯P25光催化剂的催化产氢活性有了明显提高,催化剂经多次重复使用实验后,仍具有光催化性能。张一兵等[8]用水热法制备了TiO2粉末催化剂,并对其进行表征,掺杂一定量的铁使TiO2吸收波长发生了红移,扩大了对光的吸收范围。黄瑞宇等[9]采用溶胶-凝胶法制备了Ag掺杂TiO2的光催化剂,并对其进行表征,结果表明,Ag掺杂的TiO2提高了其在紫外可见光下的光催化活性,并且对甲基橙有较好的降解作用,一定程度上提高了TiO2光催化剂的催化活性。Yamashita H等[10]研究了TiO2分别掺杂不同金属离子V、Mn、Fe对可见光的响应状况,并发现这三种金属离子都能使TiO2的吸收光发生红移,使吸收光范围扩大。关于Ag掺杂对TiO2光催化性能的影响的研究较多[11-13],但多为研究其在光催化降解、光电器件等方面的应用,而将其应用于光催化C—C偶联反应的研究鲜有报道。本文以TiO2为光催化剂,以Cu、Ag掺杂对其进行改性,探讨改性后的TiO2对甲酸产氢异丙醇偶联生成四甲基乙二醇反应的光催化活性。
1 实验部分
1.1 实验试剂与仪器
钛酸四丁酯,天津科密欧化学试剂有限公司;异丙醇,成都金山化学试剂有限公司;氢氧化钠,天津津东天正精细化学试剂;无水乙醇,天津富宇精细化工有限公司;冰醋酸,天津盛通泰化工有限公司;丙酮,西陇化工股份有限公司;甲酸88%,太仓泸试试剂有限公司,以上试剂均为分析纯。
利用美国赛默飞有限公司Nicolet380型傅里叶变换红外光谱仪(FT-IR)分析鉴定催化剂的分子结构及其不同的官能团,利用荷兰帕纳科公司X’Pert Powder X型射线衍射仪进行物相结构分析;利用上海材料与制造大型仪器中心LEO-438VP型扫描电子显微镜(SEM)观察催化剂形貌;利用上海仪电分析仪器有限公司722G型紫外可见漫反射光谱仪(UV-vis)观察催化剂光吸收性能。
1.2 催化剂制备
将P25在马弗炉中600 ℃下焙烧20 h,自然冷却至室温。取0.4 g烧制好的P25,加入200 mL蒸馏水超声30 min,再加入0.8 mL、0.05 mol·L-1的Cu(NO3)2溶液和0.8 mL、0.05 mol·L-1的AgNO3溶液,超声并搅拌1 h,再加入0.4 mL、0.1 mol·L-1的NaBH4溶液并搅拌1 h,抽滤后将得到的样品放入真空干燥箱中,在50 ℃下干燥6 h,制得催化剂标记为Ag-Cu-P25。同样方法下不添加Cu(NO3)2制得Ag-P25,不添加AgNO3制得Cu-P25。
以钛酸四丁酯为原料,采用水热合成法制备TiO2。水热法制备的TiO2用同样的方法制得Ag-Cu-TiO2。
1.3 光催化性能测试
以400 W汞灯作为光源,在常温、常压条件下,以甲酸和异丙醇作为反应底物在50 mL石英试管中进行光催化反应,将0.08 g的催化剂,甲酸溶液0.63 mL、异丙醇溶液1.256 mL(物质的量比为1∶1)、蒸馏水共50 mL,加入石英试管中,反应8 h。反应产物经离心后,用GC-MS对液相产物进行分析,确定产物组成,初步分析催化剂对该反应的光催化活性,探讨反应机理。
2 结果与讨论
2.1 IR分析
图1为不同掺杂量的Cu-P25催化剂(a),P25和TiO2(水热法)(b),P25和Cu、Ag共掺杂以及单掺杂(c)的红外光谱图。从图1可以看出,在3 500 cm-1处的峰是催化剂表面吸附水的O-H键弯曲振动峰,在1 650 cm-1处的峰为催化剂表面吸附水中羟基的伸缩振动峰,在(400~800) cm-1为锐钛矿相TiO2中的Ti-O-Ti键的伸缩振动峰,说明掺杂金属后的TiO2本身并没有发生明显变化。Cu、Ag共掺杂以及单掺杂的红外光谱图与TiO2的红外光谱图基本相同,说明经Ag、Cu的共同负载后没有产生其他的键,并且以单金属的形式负载在TiO2表面上。
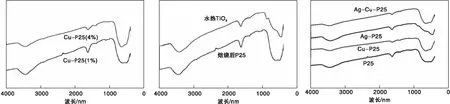
图1 金属双掺杂、单掺杂以及纯TiO2光催化剂的IR光谱图Figure 1 IR spectra of double metal doped,single metal doped and pure TiO2 photocatalys
2.2 SEM
图2为TiO2、Cu-Ag-P25、Cu-P25和Ag-P25光催化剂的SEM照片。从图2可以看到,TiO2呈颗粒状,平均直径约30 nm,形貌清楚,尺寸均匀、结构完整性较好,粒径相对较小。掺杂金属后的样品中未发现金属Cu、Ag的负载,可能的原因是掺杂的Cu、Ag颗粒的粒径很小,并且分散在TiO2表面上,分散程度高,无法观察出Cu、Ag是否掺入其中。

图2 金属双掺杂、单掺杂以及纯TiO2光催化剂的SEM照片Figure 2 SEM images of double metal doped,single metal doped and pure TiO2 photocatalys
2.3 XRD
图3为水热法制备的TiO2和商用P25及金属掺杂后的催化剂样品XRD图。
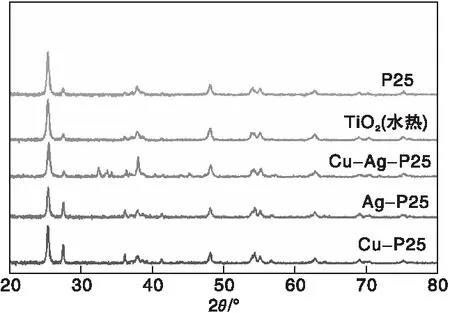
图3 金属双掺杂、单掺杂以及纯TiO2光催化剂的XRD图Figure 3 XRD patterns of double metal doped,single metal doped and pure TiO2 photocatalys
从图3可以看出,商用P25在25.3°、37.8°、48.0°、53.8°、55.0°、68.8°和70.4°处的衍射峰可归属于锐钛矿相中的(101)、(004)、(200)、(105)、(211)、(116)和(220)晶面的衍射峰;在27.4°、36.0°、41.2°、56.6°和64.0°处的衍射峰分别对应金红石矿相中的(110)、(101)、(111)、(220)和(310)晶面的衍射峰。
经金属Cu、Ag负载后,P25的晶相并未改变,Cu-P25在42.5°和51.4°处的衍射峰与铜的立方结构的(111)和(200)晶面复合,可认为金属铜已掺入其中[14]。Ag-P25在37.9°、43.4°、63.9°和77.8°分别对应于银的(111)、(200)、(220)和(311)晶面,可认为金属银已掺入其中[15]。同理,分析Cu-Ag-P25谱图,可以看出Cu和Ag都已掺入其中。
2.4 UV-Vis DRS
图4为不同掺杂量的Cu- P25催化剂(a),P25和TiO2(水热法)(b),P25和Cu、Ag共掺杂以及单掺杂(c)的紫外漫反射图。从图4可以看出,在紫外光区(200~400) nm之间,每种催化剂都有较强的吸收,表明制得的催化剂都有较好的紫外吸收特性。从图4(a)可以看出,掺杂量为4%的Cu-P25比掺杂量1%的Cu-P25最大吸收峰发生了红移;从图4(b)可以看出,焙烧后的P25比水热法制备TiO2的吸收性能好;从图4(c)可以看出,Cu、Ag掺杂的复合催化剂比纯P25的紫外最大吸收峰有明显的红移,在可见光区有很好的吸收性。
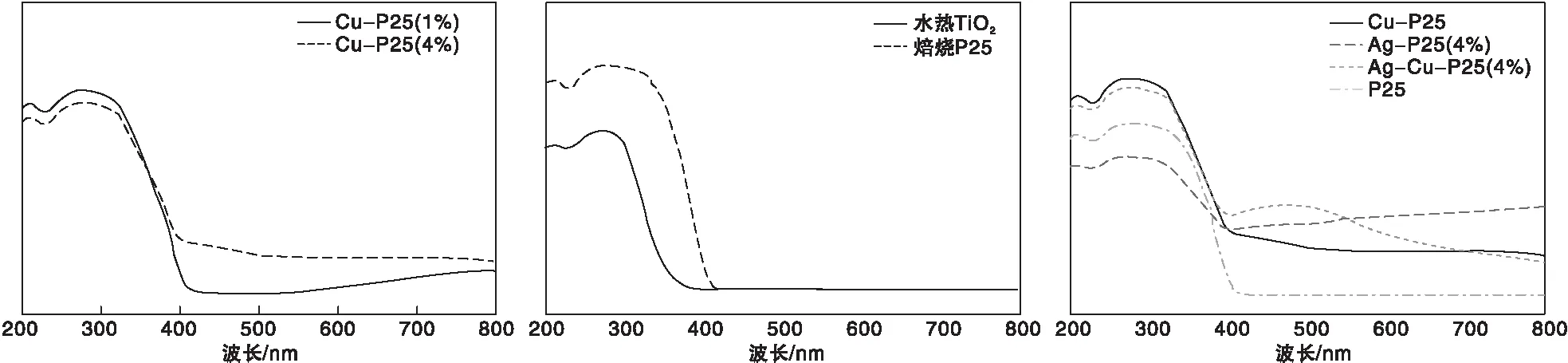
图4 金属双掺杂、单掺杂以及纯TiO2光催化剂的紫外可见漫反射图Figure 4 UV-Vis DRS spectra of double metal doped,single metal doped and pure TiO2 photocatalys
2.5 光催化活性
光催化反应完成后,对液相产物进行GC-MS分析。图5为产品气相色谱图。
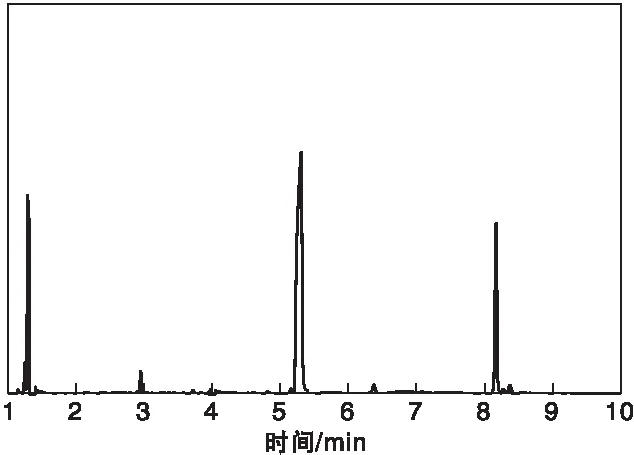
图5 产品气相色谱图Figure 5 Gas chromatogram of product
结合质谱分析结果对液相产物进行定性分析,光催化产物为四甲基乙二醇和2,5-己二酮,保留时间处于5.46 min时对应的峰为四甲基乙二醇,处于8.17 min时对应的峰为2,5-己二酮。推测生成四甲基乙二醇具体反应历程如下:
如上述反应历程,TiO2在光照条件下产生氧化性的空穴,产生具有还原性的电子。光催化剂空穴和甲酸反应产生H+和COOH后,进一步使COOH脱下H+生成CO2。异丙醇和H+作用生成2-羟基异丙基自由基和CH3COCH2,2-羟基异丙基自由基在光照条件下反应生成目标产物四甲基乙二醇。另一反应产物2,5-己二酮则是由中间生成的CH3COCH2·形成。
3 结 论
通过微波辅助法掺杂一定比例的Cu、Ag制备金属掺杂TiO2,通过多种测试方法对制备的催化材料结构和性能进行分析。以甲酸和异丙醇作为反应底物对制备的光催化材料的光催化性能进行评价。结果表明,Cu、Ag掺杂的TiO2比纯TiO2具有更好的光催化性能,光催化甲酸异丙醇体系生成主要产物为四甲基乙二醇和2,5-己二酮。若该研究的Cu、Ag等来自于废弃尾矿,则为TiO2改性提供了一种新的思路,在光催化有机合成环境治理中有巨大的应用潜力。
