基于网络药理学探讨姜黄素抗人喉癌细胞的分子机制及其实验研究
2023-01-06姜雪莲卫旭东马斌娟张静月
姜雪莲,卫旭东,,3,马斌娟,张静月
(1.兰州大学第一临床医学院,甘肃 兰州 730000; 2.甘肃省人民医院 耳鼻咽喉头颈外科,甘肃 兰州 730000; 3.甘肃中医药大学第一临床医学院,甘肃 兰州 730000)
喉癌是呼吸道最常见的肿瘤之一[1],其中喉癌的治疗包括手术治疗及放化疗[2-4],近年来植物药物由于其天然、疗效确切、且富含维生素及矿物质的优势,可有效防止致癌物的形成和阻滞癌细胞的增长,目前在喉癌治疗中备受关注[5-6]。
姜黄素已在多种癌症中证实具有抗肿瘤作用[7],但其在喉癌中发挥作用的机制尚不明确,为了进一步探讨姜黄素在喉癌中的作用,本研究采用网络药理方法,对化学成分-疾病靶点进行筛选,并设计分子实验进一步明确姜黄素抗喉癌的分子机制及观察姜黄素对化疗药多柔比星的化疗增效作用。
1 材料与方法
1.1 数据库与软件
SwissTargetPrediction数据库;STRING数据库;RCSB PDB数据库;OMIM 数据库; DAVID数据库; GeneCards HUMAN GENE DATABASE数据库;PharmMapper数据库;RCSB PDB数据库;ZNIC数据库;Cytoscape 3.8.0软件;OriginPro 2021软件;iGEMDOCK 2.1软件; FunRich 3.1.3软件;AutoDock软件;PyMOL软件。
1.2 姜黄素靶标蛋白筛选
通过Swiss Target Prediction与PharmMapper数据库对姜黄素进行药物靶点筛选, 除种属选择“人源”,其他参数选择默认设置,筛选得到蛋白名称、Uniprot ID等信息。
1.3 喉癌靶点筛选
以“Laryngeal carcinoma”为关键词筛选出GeneCards、OMIM数据库中的喉癌靶点。其中GeneCards数据库筛选出Relevance score≥15靶点作为喉癌的关键靶点,检索上述数据库,去重后获得喉癌基因靶点。
1.4 姜黄素与喉癌交集靶点的基因本体(gene ontology,GO)和京都基因与基因组百科全书(kyoto encyclopedia of genes and genomes,KEGG)分析
交集靶点的GO分析以及KEGG通路富集分析是基于DAVID数据库进行,得到的结果包括GO生物学过程、细胞组成 、分子功能 及相关KEGG通路,并使用易汉博生物信息在线信息作图网站对结果进行可视化分析。
1.5 关键靶点筛选
STRING网站结合Cytoscape软件通过degree值筛选关键靶点,STRING在线网站中选择“Multiple proteins”为输入方式,输入喉癌共有靶点,种属选择“人源”,其他参数选择默认设置。点击“Exports”选项,下载 TSV 格式的文件保存,TSV文件进一步导入 Cytoscape 软件,选择CytoHubba 模块,根据 degree值的大小输出前3个靶点作为关键靶点。
1.6 分子对接验证分析
基于RCSB PDB数据库中通过设置人源、分辨率≤2.5、pH值、有无配体等条件对蛋白分子结构进行筛选,基于ZNIC数据库查找姜黄素分子结构,基于AutoDock软件进行姜黄素与靶标蛋白的分子对接,可视化分析使用PyMOL软件进行。
1.7 材料来源
人喉癌细胞株Hep-2(齐氏生物科技);胎牛血清(ExCell);姜黄素(Macklin);RPMI1640培养基(Hyclone);磷酸化信号转导及转录因子3(phosphorylation signal transduction and transcription factor 3,P-STAT3)兔抗人单克隆抗体(Immunoway);GAPDH(Genetex)、羊抗兔二抗(武汉塞维尔生物科技有限公司)。
1.8 细胞培养
将人喉癌细胞Hep-2细胞培养于含有10%胎牛血清的RPMI1640完全培养基中,于37 ℃、5%CO2饱和湿度培养箱培养,细胞生长至80%的密度时进行传代。
1.9 细胞划痕实验观察姜黄素对喉癌细胞迁移能力的影响
将培养的Hep-2细胞接种于6孔板上,设置对照组、姜黄素浓度分别为(5、10、20 μmol/L)组,每孔2 mL,每组设置3个复孔,待细胞融合至90%左右,用200 μL枪头轻轻划痕后置于培养箱培养24 h。24 h后显微镜下观察并记录各组Hep-2细胞迁移情况,使用Image J软件进一步处理,并计算划痕愈合率。愈合率=(0 h划痕距离-24 h划痕距离)/0 h划痕距离×100%。
1.10 细胞计数试剂盒(cell counting kit-8,CCK-8)法检测姜黄素对细胞增殖能力的影响
在96孔板中每孔种入10 000个细胞,加入不同浓度姜黄素(0、5、10、20 μmol/L)培养,每个药物浓度设3个复孔。药物作用12、24、48 h后,加入10 μCCK-8,37 ℃孵育2 h测吸光度。
1.11 CCK-8法检测姜黄素对多柔比星的化疗增效作用
采用CCK-8法检测姜黄素对多柔比星的化疗增效作用,在96孔板中每孔种入10 000个细胞,用多柔比星(5 μmol/L)及多柔比星(5 μmol/L)与姜黄素(2.5、5 μmol/L)联合用药培养,每个药物浓度设3个复孔,作用12、24、48 h后,加入10 μCCK-8,37 ℃孵育2 h测吸光度。
1.12 Western blot检测姜黄素对细胞相关蛋白表达水平的影响
细胞生长至80%密度时,采用不同浓度姜黄素培养细胞24 h后使用放射免疫沉淀试验(radio-immunoprecipitation assay,RIPA)裂解液提取细胞蛋白,通过聚丙烯酰胺凝胶电泳分离样品,使用湿转法进行转膜,转膜后的膜用兔抗人P-STAT3于4 ℃孵育过夜后洗涤,加用二抗(羊抗鼠,1∶500稀释)室温孵育1h后,送至暗室中加入增强型化学发光试剂(enhanced chemiluminescence,ECL)试剂,并用ImageQuant 350电泳凝胶成像分体系统中曝光拍照,借助Image J软件对图像进行分析。
1.13 统计学分析

2 结果
2.1 靶点筛选
得到喉癌靶点 Genecards (1982)、OMIM(194)筛选Genecards数据库中相关度score>15的基因(196),删除重复靶点后最终得到靶点370个。通过 SwissTarget Prediction及PharmMapper数据库筛选出姜黄素化学成分靶点100个(图 1), 采用 FunRich 取交集筛选出12个共有靶点。姜黄素-喉癌共有靶点见表1。

图1 疾病靶点-化学成分 注:A(疾病靶点); B(化学成分靶点)。

表1 姜黄素-喉癌共有靶点
2.2 GO富集分析
通过DAVID软件对获得的12个姜黄素-喉癌共同靶点进行富集分析,姜黄素治疗喉癌的交集靶点主要参与的分子功能主要富集于蛋白磷酸酶结合、一氧化二氮合成酶调节器活性、相同的蛋白质结合、跨膜受体蛋白酪氨酸激酶活性酶结合、蛋白激酶活性、金属内肽酶活性、蛋白酪氨酸激酶活性、锌离子结合、受体信号蛋白酪氨酸激酶活性等;主要参与的生物过程包括对一氧化氮生物合成过程的正向调节、对RNA聚合酶II启动子的转录进行正向调节、细胞增殖、对蛋白质磷酸化的正向调节、对血管收缩的正向调节、细胞对表皮生长因子刺激的反应、EGFR2信号传导途径、胚胎植入、信号转导、对平滑肌细胞增殖的正向调节;参与的细胞组成为细胞核、浆膜、蛋白质细胞外基质、细胞质、细胞外区域、受体复合体。结果用易汉博生物信息在线信息作图网站对结果进行可视化分析见图2。
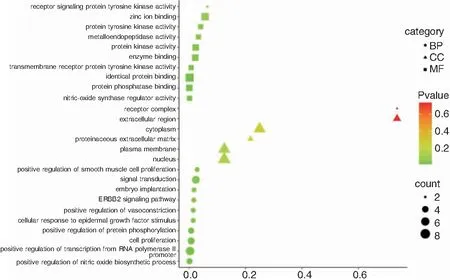
图2 姜黄素潜在靶点治疗喉癌的气泡图 注:X 轴代表富集因子,Y 轴代表名称,气泡面积大小代表目标基因集中属于这个分支的基因数量,气泡颜色代表富集显著性,即P值的大小。
2.3 KEGG通路富集分析
基于DAVID数据库对姜黄素-喉癌交集靶点进行KEGG富集分析,根据每条通路上靶点数量对通路使用易汉博生物信息在线信息作图网站进行可视化展示,涉及的主要与癌症相关的信号通路包括癌症中的蛋白多糖通路、肿瘤坏死因子(tumor necrosis factor,TNF)信号传导通路、癌症中的通路、缺氧诱导因子-1(hypoxia inducible factor-1,HIF-1)信号传导通路、Jak-STAT信号传导通路、癌症中的碳代谢通路、血管内皮生长因子信号传导途径见图3。
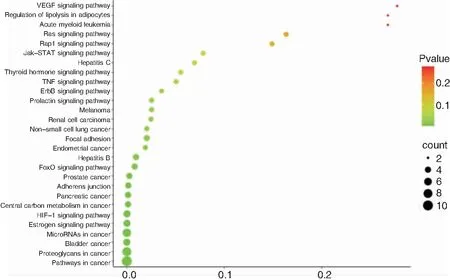
图3 姜黄素对喉癌作用靶点的 KEGG 分析关系网络 注:X 轴代表富集因子,即P值的大小,Y 轴代表通路名称,气泡颜色代表富集显著性,气泡面积大小代表目标基因集中属于这个分支的基因数量。
2.4 关键靶点分析
STRING网站结合Cytoscape软件通过degree值筛选关键靶点,选择degree大于3的为关键靶点,EGFR、 STAT3和 EP300为关键靶点。见图4。
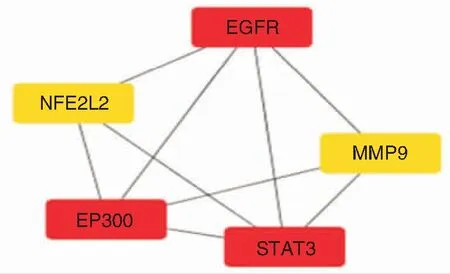
图4 关键靶点筛选
2.5 AutoDock分子对接结果
鉴于KEGG通路富集分析存在Jak-STAT通路,且Jak-STAT通路富集显著性高于血管内皮生长因子信号传导通路,故筛选出蛋白质数据库(protein data bank, PDB)ID为6QHD作为P-STAT3蛋白的分子结构,用AutoDock软件对P-STAT3与姜黄素进行分子对接分析以进一步研究,结果显示姜黄素与P-STAT3结合能最大为-4.98 kcal/mol,结合能越低,分子结构越稳定,且P-STAT3与姜黄素结合位点靠近中心部位,结合位置较稳固,并使用PyMOL软件对结合能最大处的结合位点结果进行可视化展示,见图5、表2。

图5 P-STAT3 与葫芦素E分子对接结果 注:P-STAT3(磷酸化信号转导及转录因子)。

表2 P-STAT3与姜黄素各结合位点结合能
2.6 细胞划痕实验观察姜黄素对喉癌细胞迁移能力的影响
实验中用不同浓度的姜黄素与喉癌细胞共培养,24 h观察愈合面积,与对照组比较各实验组可显著抑制喉癌细胞的迁移能力。见图6。

图6 姜黄素对喉癌细胞迁移能力的影响 注:*P<0.05;J5、J10、J20(姜黄素浓度分别为为5、10、20 μmol/L); control(姜黄素浓度为0 μmol/L)。下同。
2.7 CCK-8法检测姜黄素对细胞增殖能力的影响
CCK-8法结果表明,相较姜黄素浓度为0 μmol/L其余各实验组可抑制喉癌细胞的体外增殖活性。见图7。

图7 姜黄素(J)对喉癌细胞增殖能力的影响 注:*P<0.05。
2.8 CCK-8法检测姜黄素对多柔比星的化疗增效作用
多柔比星加不同浓度的姜黄素处理细胞后,采用CCK-8法检测多柔比星(5 μmol/L)及多柔比星(5 μmol/L)加姜黄素(2.5、5 μmol/L)对喉癌细胞的增殖抑制作用。结果表明,联合使用多柔比星与姜黄素与单独使用多柔比星抑制喉癌细胞的增殖能力的作用更强。见图8。

图8 CCK-8法检测不同时间点姜黄素对多柔比星的化疗增效作用 注:D/J=5/2.5为多柔比星5 μmol/L与姜黄素2.5 μmol/L共同作用于喉癌细胞;D/J=5/5为多柔比星5 μmol/L与姜黄素5 μmol/L共同作用于喉癌细胞;control为单独使用多柔比星作用于喉癌细胞;单独使用多柔比星及多柔比星与不同浓度姜黄素联合使用抑制喉癌细胞增殖能力比较,*P<0.05。
2.9 Western blot检测姜黄素对细胞相关蛋白表达水平的影响
Western blot结果表明,随着姜黄素浓度的提高可不同程度的抑制喉癌细胞P-STAT3蛋白的表达,见图9。
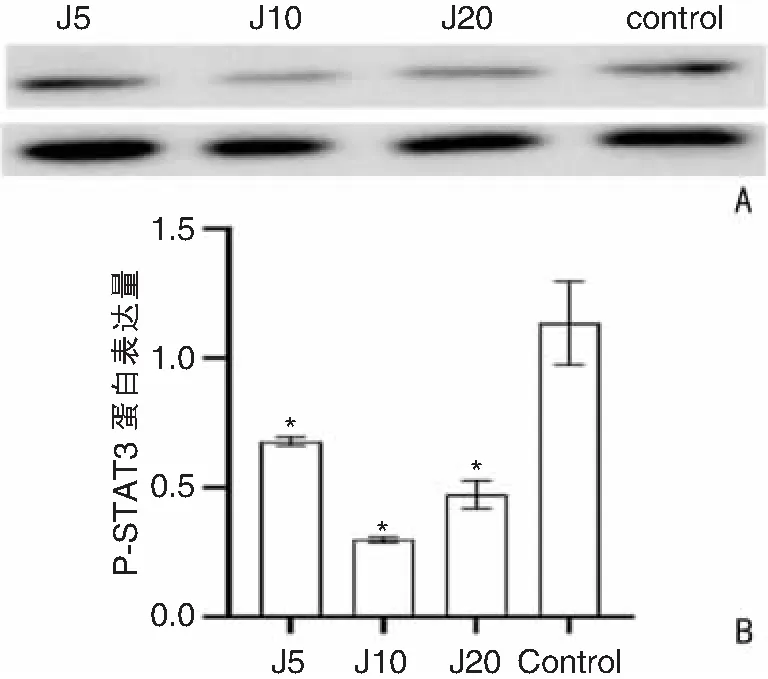
图9 Western blot检测不同浓度姜黄素对细胞相关蛋白表达水平的影响 A:不同浓度下姜黄素(J)降低P-STAT3蛋白的表达;B:各实验组与对照组比较,*P<0.05
3 讨论
随着生物信息学飞速的发展,用于查询单味药/复方药中有效成分以及预测药物与疾病作用靶标的生物数据库也应运而生,基于网络药理学可预测药物、疾病的作用靶标,解析药物作用机制[8-12]。姜黄素是从姜黄的根茎中分离而来发挥药理作用的主要活性成分,姜黄辛、苦、温,归脾、肝经,有破血行气、通经止痛的功效[8],姜黄素作为一种提取而来的酚类化合物,可通过调节许多细胞信号传导途径来有效调节肿瘤细胞生长,并可提高化学治疗剂和辐射对癌症的治疗作用,并可与FDA批准的癌症治疗的大多数靶标相互作用[13-14],同时姜黄素对化疗药物具有增敏作用[11],目前已有相关文献关于姜黄素作用于喉癌细胞相关机制的报道[9,15],姜黄素通过上调miR-15a,抑制细胞增殖,并可加速喉癌细胞的凋亡[16]。但本研究通过网络药理学成功预测出姜黄素可能通过调节EGFR、STAT3、EP300蛋白的表达发挥对喉癌细胞的抗肿瘤作用,在后续分子生物学验证实验中,对P-STAT3蛋白表达有明显下调,与已有的研究方法相比,基于网络药理学开展的基础实验研究,其过程更加完整。
STAT家族是潜在的胞质转录因子,具有双重功能:传递胞浆信号及启动核内基因转录,STAT3的活化与很多器官的恶性病变存在密切联系,如在实体瘤中对STAT3蛋白的组成型激活的初步研究。Janus激酶家族磷酸化激活STAT3,通过白细胞介素-6(interleukin-6,IL-6)信号传导通路进一步促进JAK2磷酸化及STAT3磷酸化,磷酸化后的STAT3形成二聚体,以二聚体形式进入细胞核,寻找并作用于相关反应元件上,从而使其下游的基因转录增强[10,17],活化的P-STAT3信号通路可以成为喉鳞状细胞癌基因治疗中一个重要的分子靶点[18]。本研究以Hep-2细胞作为研究对象,进一步通过实验验证发现用不同浓度的姜黄素处理喉癌细胞后,与对照组比较姜黄素可抑制喉癌细胞增殖能力,细胞划痕实验发现姜黄素亦可抑制喉癌细胞的水平迁移能力,提取不同浓度姜黄素作用的喉癌细胞蛋白,Western blot技术检测不同组别相关蛋白的表达差异,发现相较于对照组而言,各不同浓度的姜黄素组可不同程度地抑制P-STAT3蛋白的表达且差别具有统计学意义,但姜黄素并未完全呈剂量依赖效应抑制喉癌细胞中P-STAT3蛋白的表达量,在本实验中当姜黄素浓度为10 μmol/L时为姜黄素发挥作用的最好浓度,在此浓度下姜黄素可较大程度抑制细胞中P-STAT3蛋白的表达,进一步提高姜黄素的浓度发挥下调P-STAT3蛋白表达的作用有限,原因其一可能与姜黄素作为一种植物药物,生物利用度和药代动力学谱限制姜黄素的治疗用途有关,其二是姜黄素与细胞中P-STAT3的最大结合能为-4.98 kcal/mol有关,结合能偏低,其发挥抗癌的作用有限[19],但仍可进一步推测姜黄素可能通过下调P-STAT3蛋白的表达,抑制细胞增殖,其可能存在的通路为IL6/JAK/STAT3[20]通路,当仍需通过改变姜黄素的空间结构等方面以求发挥更大的抗癌作用。
在癌症化疗期间,某些癌症可能会对结构不同的抗肿瘤药物产生交叉耐药性,研究发现三磷酸腺苷(ATP)结合盒转运蛋白的过度表达可外排输出范围广泛的结构多样的内生物质和异生物质,包括抗癌剂。抗癌药物从癌细胞内部转移到外部的过程是以消耗ATP为代价的,克服多药耐药的策略之一是通过小分子抑制剂抑制外排转运蛋白功能,因此需寻找新型、高效且无毒的辅助化疗剂以解决ATP结合盒转运蛋白介导的多药耐药[21-22]。在本实验中发现姜黄素对化疗药物多柔比星具有化疗增效作用,联合应用姜黄素(2.5、5 μmol/L)与多柔比星(5 μmol/L)比单独使用多柔比星(5 μmol/L)抑制喉癌细胞增殖的能力作用更强,差别具有统计学意义,在其他肿瘤的研究中发现姜黄素可抑制某些耐药蛋白的表达[23-24],从而减少喉癌细胞对化疗药物多柔比星的外排作用,我们的研究可为ATP结合盒转运蛋白介导的多药耐药领域揭示新化合物,以期逆转喉癌多药耐药,并为化疗药物多柔比星更好地应用于喉癌的治疗提供新思路。
